新生儿溶血性黄疸的肠道菌群结构特点分析
2024-03-19闫怀宇乔继冰蒋亚洲
闫怀宇 乔继冰 蒋亚洲 沈 男 吴 让 宁 涛
(徐州医科大学附属宿迁医院儿科,江苏 宿迁,223800)
新生儿溶血病(hemolytic disease of newborn, HDN)是指母亲与子女血型不合引起的同种族免疫性溶血[1]。在发现的26个人类血型分类中, ABO血型溶血最为常见(85.3%),Rh血型和其他血型溶血则相对较少(14.7%)[2]。HDN的发病机制现已基本清晰,遗传自父亲(母亲不具有)的显性红细胞表面血型抗原经胎盘进入母体后,可刺激机体产生相应IgG,待其进入胎儿血流循环后可引发抗原-抗体反应,从而导致红细胞被破坏[1-2]。HDN不仅常造成新生儿贫血,代偿刺激肝脏、脾脏肿大,还可导致短期内血清未结合胆红素浓度急剧升高,出现重度黄疸,甚至损伤中枢神经系统[2-3]。
肠道菌群作为最大的免疫和内分泌“器官”,在机体内参与众多生理活动,如防御感染、生长代谢、免疫发育以及调节等。随着肠道微生态学的快速发展以及高通量测序技术的广泛应用,肠道菌群与新生儿黄疸的相关性日益受到关注。目前,肠道菌群参与胆红素代谢已在国内外相关研究中得到证实,包括动物实验和人体研究[4-7]。然而,HDN所致的新生儿黄疸与肠道菌群相关性尚未见报道。
1 资料与方法
1.1 一般资料
选取2022年10月—2023年3月于徐州医科大学附属宿迁医院出生且确诊为新生儿溶血性黄疸的患儿作为病例组,同期在医院出生的健康新生儿作为对照组。本研究已经徐州医科大学附属宿迁医院医学科研伦理委员会审查批准,并且所有新生儿父母或监护人均知情后签署同意书。
1.2 纳入与排除标准
病例组纳入标准:①HDN诊断符合2021年中国输血协会免疫血液学专业委员会制定的《胎儿新生儿溶血病实验室检测专家共识》[1];②新生儿高胆红素血症诊断符合2022版《美国儿科学会新生儿高胆红素血症管理指南》[8]; ③年龄小于1周龄,且为母乳喂养。④父母或监护人依从性良好。
排除标准:①存在使用抗生素、益生菌、益生元、合生元或其相关制剂;②存在或合并遗传性疾病、代谢性疾病、胃肠道疾病以及菌血症;③母亲孕期存在特殊结构饮食;④早产儿(胎龄小于259 d)。对照组排除标准与病例组一致。
1.3 方法
提取粪便DNA。试验人员在院内使用无菌器皿收集所有新生儿的新鲜粪便,挖取粪便中段里部,量约3~5 g,随后放入无菌冻存管内,于-80 ℃冰箱存储备用。待全部样本收集结束后,利用QIAamp DNA Stool Mini Kit试剂盒(生产企业:凯杰生物技术有限公司,上海)提取粪便基因组DNA,操作流程按说明书进行。采用1%琼脂糖凝胶电泳与紫外分光光度计(生产企业:梅特勒托利多科技有限公司,瑞士)分别质检提取后的DNA,仅当电泳存在明显主带且A260/280比值位于1.8~2.0之间时方视为合格。
高通量测序。以高变区V4段作为PCR待扩增区,设计并合成引物:515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWT CTAAT-3')。扩增后初始产物通过Agencourt AMPure XP磁珠纯化并随后溶于Elution Buffer,完成建库。选用Agilent 2 100 Bioanalyzer进行文库的片段长度及浓度质量检测,合格后于HiSeq平台测序。
生物学分析。对测序后的初级数据进行过滤,以获取有效数据,步骤如下。①设置窗口为25 bp,若平均质量小于20 bp,则截去窗口后端碱基。截短后的序列小于原始序列长度75%的,则去掉整条序列;②去除接头已污染的序列(默认接头序列与原始序列有15 bp重叠,允许错配数为3);③去除含有N的序列;④去除低复杂度序列(默认序列中连续碱基长度大于或等于10的为低复杂度序列)。依据序列之间的重叠关系,通过FLASH软件进行拼接,以获取高变区的Tags。利用USEARCH软件将Tags聚类为OTU代表序列(相似性大于97%),将所有Tags通过usearch_global法对比回原OTU代表序列,随即获取各样本的OTU丰度统计量表,期间嵌合体采用UCHIME去除。将OUT代表序列与数据库进行比较、注释对应物种,基于最终结果分别选用α多样性和β多样性分析肠道菌群的组间丰度、多样性和相似性差异。选用LDA数值和LEfSe分析明确显著差异菌类,即生物标记物。
1.4 统计学分析
选用SPSS 26.0软件进行数据分析。连续计量资料以(±s)表示,若两组间资料同时符合正态分布和方差齐性,选用独立样本t检验进行比较,反之则选择秩和检验。计量资料的正态性分布检验和方差齐性检验分别利用Shapiro-Wilktest法和Levene法进行判定。计数资料以[n(%)]表示,选用χ2检验。P<0.05表示差异有统计学意义。
2 结果
2.1 两组一般情况比较
本研究共计纳入新生儿55例,含HDN组29例(男性19例,女性10例),健康对照组26例(男性16例,女性10例)。两组之间的性别(男性占比65.5% vs 61.5%,P=0.94)和年龄[(3.70±1.35)d vs (3.66±1.23)d,P=0.81]比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组α和β多样性比较
HDN组和对照组一共聚类OTU数量为295个,含HDN组171个,对照组124个,共同拥有71个,见图1。α分析显示两组间的多样性存在显著差异(shannon指数,P<0.05),见图2A;而丰度差异无统计学意义(ace指数,P>0.05),见图2B。β分析显示基于unifrac距离的两组间相似性比较,差异有统计学意义(P<0.05),表明组间物种相似性存在显著差异,见图3。

图1 两组间OUT数量与交集
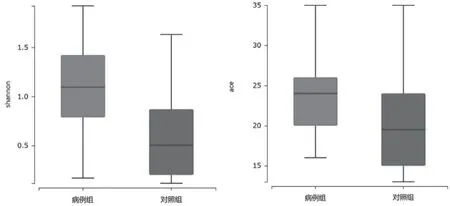
图2 α多样性分析:A shannon指数;B ace指数
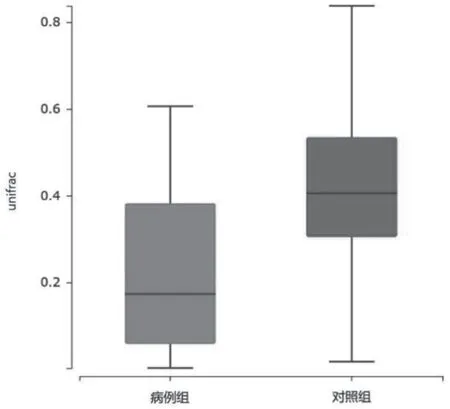
图3 β多样性分析
2.3 肠道菌群丰度结构比例
在门水平,HDN组主要由变形菌门(38.53%)、厚壁菌门(37.57%)、放线菌门(13.17%)和拟杆菌门(10.70%)组成;而对照组主要由厚壁菌门(81.15%)、变形菌门(16.68%)和放线菌门(2.11%)组成,见图4A。在属水平,HDN组关键菌属(丰度比例前十)为埃希氏菌属(25.94%)、链球菌属(21.87%)、双歧杆菌属(10.43%)、拟杆菌属(9.78%)、克雷伯菌属(9.42%)、肠球菌属(5.32%)、韦荣氏球菌属(4.77%)、梭菌属(2.78%)、罗氏菌属(2.72%)和沙门氏菌属(2.23%);而对照组则变为链球菌属(69.27%)、埃希氏菌属(9.99%)、肠球菌属(7.50%)、克雷伯菌属(6.54%)、韦荣氏球菌属(3.31%)、双歧杆菌属(1.48%)、梭菌属(0.77%)、罗氏菌属(0.62%)、乳酸菌属(0.17%)和拟杆菌属(0.02%),见图4B。

图4 相对丰度比例图: A 门水平;B 属水平
2.4 关键菌属差异判定
默认LDA预设定分值为2,获取显著差异物种,见图5,并进一步筛选关键菌属。结果显示,相对于对照组,HDN组关键菌属变化为埃希氏菌属、克雷伯菌属、拟杆菌属和罗氏菌属丰度升高,而链球菌属(唾液链球菌为主)丰度降低。LEfSe聚类图进一步支持了此关键菌属变化,见图6。

图5 LDA分值图

图6 LEfSe聚类图
3 讨论
本研究通过16S rDNA扩增子测序技术对新生儿溶血性黄疸患儿进行了肠道菌群检测,结果显示其主要变化为埃希氏菌属、克雷伯菌属、拟杆菌属和罗氏菌属丰度升高,而链球菌属丰度降低。
肠道菌群与胆红素代谢的相关性已在国内外相关研究中得到证实。小鼠模型实验显示,无菌小鼠的粪便中并不存在粪胆原,取而代之的是大量结合胆红素[4];通过粪菌移植的方法将野生小鼠肠道内的菌群转至无菌小鼠体内后,则可逆转该趋势,并在1周恢复粪便中的粪胆原生理含量[5]。在人体研究中,胆红素代谢与肠道菌群同样表现出紧密相关性。在一项肠道菌群与黄疸相关性研究中显示,新生儿胆汁淤积症患儿肠道中的菌群丰度明显增加,尤以机会致病菌为主,而以未结合胆红素升高为主要表现的患儿则以双歧杆菌属丰度降低为主要特点[6]。上述动物和人体试验均直接或间接证实了肠道菌群紊乱是引起胆红素代谢障碍的原因之一。
与前研究结果相似,本研究结果显示,HDN所致的新生儿高胆红素血症同样存在肠道菌群紊乱,且以机会致病菌丰度升高为主要变化,尤以致病性较强的埃希氏菌属和克雷伯菌属为代表。埃希氏菌属为革兰染色阴性短杆菌,大部分含有鞭毛,可运动,兼性厌氧[9]。在生命早期,该菌属就已在胃肠道、呼吸道、泌尿道以及口腔等部位定植,是人类和动物体内常见的共生菌之一[10]。然而,在一项对1 208例新生儿高胆红素血症患儿的血培养结果分析中,埃希氏菌属检出率竟高达5.92%[11]。此外,该菌属所致的新生儿败血症、化脓性脑膜炎、胆囊炎、腹腔脓肿、泌尿道和呼吸道感染在新生儿期也均可见报道,进一步提示埃希氏菌属在新生儿期具备较强的条件致病性[12-17]。克雷伯菌属同为革兰染色阴性菌,且兼性厌氧,但其形状与埃希氏菌属并不相同,表现为单独、成对或链条状的粗杆菌,多有较厚荚膜。生理状态下,该菌属可定植于人体的呼吸道和胃肠道,但当局部微环境改变后可导致感染性疾病。HDN发生后,血红蛋白破坏被加速,这不仅增加了体内胆红素的来源,而且还并发贫血[2-3]。贫血是胃肠蠕动和消化酶分泌的影响因素之一,同时因携氧量减少可导致肠道上皮屏障功能减弱及通透性增强,为埃希氏菌属和克雷伯菌属的感染提供条件[18]。国内一项病原学研究显示,新生儿高胆红素血症患儿的克雷伯菌属检出率约为3.62%[11]。因此,临床医生在诊疗新生儿溶血性黄疸过程中,需警惕上述两种菌属的肠源性感染可能。
拟杆菌属和罗氏菌属均可将肠道内不可消化的膳食纤维发酵成短链脂肪酸(short chain fatty acids, SCFAs),并间接参与免疫屏障和胆红素的代谢[19-21]:(1)SCFAs可促进肠道上皮的增殖与修复,并减少其凋亡;(2)SCFAs参与细胞间的紧密连接蛋白组装,从而减少上皮细胞间的 “肠漏”;(3)SCFAs可刺激黏蛋白的分泌,进一步提高黏液层厚度,减少致病菌的定植;(4)SCFAs可降低肠道微环境pH,为有益菌的增殖提供弱酸环境,有助于胆红素的肝-肠循环代谢。因此,SCFAs产生菌丰度升高有利于减少机会致病菌感染和加速胆红素的肠道内代谢,该变化可能为HDN发生后机体拮抗胆红素水平过高的代偿效应。
链球菌属是化脓性球菌中的另一大类常见革兰染色阳性球菌,包含69个种和亚种,广泛定植于人体肠道,多定义为正常菌群。本研究结果显示,新生儿溶血性黄疸患儿存在链球菌属丰度减低,尤以唾液链球菌为著。唾液链球菌为口腔早期定植的益生菌,但该菌在肠道内的作用尚处于初始研究阶段。有研究表明[22-24],唾液链球菌在肠道内的作用具有两面性,甚至在不同病种间可发挥截然相反的作用,故该菌在溶血性疾病中的效应还需更多后期研究。
综上所述,本研究明确了新生儿溶血性黄疸患儿存在肠道菌群紊乱,整体多样性增加,关键菌属中埃希氏菌属、克雷伯菌属、拟杆菌属和罗氏菌属丰度升高,而链球菌属丰度降低。该研究结果可能为HDN所致黄疸的靶向微生态干预提供部分理论依据。
