基于抗炎活性的香花崖豆藤化学成分研究*
2024-03-18姚采平郭燕华李燕华刘建锋
姚采平,邱 飞,2,郭燕华,李燕华,刘建锋,2△
(1. 湖南医药学院第一附属医院,湖南 怀化 418000; 2. 湖南医药学院·侗医药研究湖南省重点实验室,湖南 怀化 418000)
香花崖豆藤Millettia dielsianaHarms 是侗族常用民间药材,又名山鸡血藤、大巴豆、山胡豆,为豆科崖豆藤属植物的藤茎[1],味苦、微甘,性温,归肝、心、肾经,具有行气、解热、止血、驱风除湿、通经活络功效,常用于治疗偏头痛。研究表明,香花崖豆藤具有抗肿瘤、抗氧化、免疫调节、抗炎、促进造血等药理学作用[2],但未进行相关抗炎活性的化学成分研究。目前,分离出的化学成分主要有黄酮类、蒽醌类、生物碱类、萜类、甾类、有机酸或酯类、多糖等[3-12]。本研究中评价了香花崖豆藤70%乙醇提取物经聚酰胺柱初分后,不同极性部位对脂多糖(LPS)诱导的RAW264.7 巨噬细胞炎性模型一氧化氮(NO)释放量及环氧合酶2(COX-2)、诱导型一氧化氮合酶(iNOS)蛋白表达水平的影响,并以抗炎活性为导向对有效部位进行系统的化学成分分离,为阐明香花崖豆藤的抗炎机制提供理论依据。
1 仪器、试药与细胞
1.1 仪器
LC-20A型高效液相色谱仪,WondaSilC18柱(150mm×4.6 mm,5 μm),均购于日本Shimadzu 公司;Aston SC5制备柱[(280 mm × 10 mm,5 μm),湖南德米特仪器有限公司];AV-600 spectrometer 型核磁共振波谱仪(瑞士Bruker 公司);Ti2 - U 型倒置显微镜(日本Nikon 公司);5702R 型高速冷冻离心机(德国Eppendorf 公司);FORMA STERI-CYCLE i160 型二氧化碳培养箱(美国Thermo公司);iMark型全自动酶标仪(美国Bio-Rad公司);Bio-Rad 1658029型号蛋白电泳仪(伯乐生命医学产品<上海>有限公司);5200Multi型化学发光荧光成像仪(上海天能科技有限公司)。
1.2 试药
香崖豆藤于2017年11月采自湖南省怀化市,经湖南医药学院邓伟峰教授鉴定为正品;聚酰胺(国药集团化学试剂有限公司,批号分别为20151228 <30~60 目>,20180720 <100~200 目>);Sephadex LH - 20 凝胶色谱(上海阿拉丁生化科技股份有限公司,批号为C2012176);胰蛋白酶(批号为B121103),胎牛血清(批号为M430984),高糖DMEM 培养基(批号为K211005),L- 谷酰胺(货号为S210JV),5 × SDS 蛋白上样缓冲液(批号为20221214),均购于上海源培生物科技股份有限公司;LPS(西格玛奥德里齐<上海>贸易有限公司,批号为0000189647);NO 试剂盒(上海碧云天生物技术股份有限公司,货号为S0023);CCK - 8 试剂(批号为20220928),青-链霉素溶液(货号为C100C5),RIPA 裂解液(批号为20221107),14 - 250KD 蛋白预染marker(货号为P9006),超敏增强型化学发光(ECL)试剂盒(批号为20221115),均购于苏州新赛美生物科技有限公司;兔抗人抗体iNOS 一抗(货号为Ab178954),COX- 2 抗体(货号为Ab17988),均购于英国Abcam 公司;羊抗兔辣根过氧化物酶(HRP)标记二抗(货号为S0001),羊抗小鼠HRP 标记二抗(货号为S0002),均购于Affinity Biosciences;地塞米松(北京索莱宝科技有限公司,货号为ID0170);Greiss 试剂盒(北京百瑞极生物科技有限公司,货号为BN16025)。
1.3 细胞
RAW264.7 细胞系来自湖南医药学院生物医学研究中心细胞库。
2 方法与结果
2.1 提取与分离
取香花崖豆藤4.5 kg ,加10 倍量70%乙醇,室温冷浸15 d,冷浸液进一步浓缩得浸膏506 g,浸膏用适量甲醇溶解,经聚酰胺(30~60 目)搅拌挥干溶剂,并装于100~200目聚酰胺柱,用水、40%乙醇、70%乙醇、100%乙醇洗脱,回收溶剂后分别得水洗脱部位96 g,40%乙醇洗脱部位123 g,70%乙醇洗脱部位189 g,100%乙醇洗脱部位67 g。
根据抗炎活性筛选结果,对香花崖豆藤40%乙醇洗脱部位进行系统分离,依次经Sephadex LH-20 凝胶色谱及半制备高效液相色谱分离纯化,分别得化合物1(21 mg)和化合物2(35 mg)。
2.2 化合物结构鉴定
化合物1:白色针状结晶,易溶于甲醇,不溶于水。1H - NMR(600 MHz,DMSO -d6)δ:12.23(1H,s,5 -OH),10.81(1H,s,7 - OH),6.89(1H,d,J= 6.0 Hz,H - 5'),6.78(1H,d,J= 6.0 Hz,H - 6'),5.91(2H,s,6 - H,8 - H),4.46(2H,m,H - 2),4.31(1H,m,H -3),3.79(3H,s,4' - OCH3),3.74(3H,s,2' - OCH3),3.73(3H,s,3' - OCH3)。13C - NMR(600 MHz,DMSO -d6)δ:70.5(C - 2),46.9(C - 3),197.5(C - 4),167.0(C - 5),96.5(C - 6),164.4(C - 7),95.3(C - 8),163.5(C - 9),153.8(C - 10),121.2(C - 1'),153.8(C - 2'),151.9(C - 3'),142.2(C - 4'),108.3(C -5'),125.2(C - 6'),61.0(2' - OCH3),60.7(3' -OCH3),56.4(4'-OCH3)。以上波谱数据与文献[13]的报道结果基本一致,经鉴定,化合物1 为5,7 - dihydroxy-2',3',4'-trimethoxyisoflavanone(C18H18O7)。
化合物2:淡黄色针状结晶,易溶于甲醇,不溶于水。1H-NMR(600 MHz,DMSO-d6)δ:12.96(1H,s,5-OH),10.88(1H,s,7-OH),9.58(1H,s,4'-OH),8.33(1H,s,H - 2),7.39(2H,dd,J= 6.0 Hz,H - 3',H -5'),6.82(2H,dd,J=6.0 Hz,H-2',H-6'),6.39(1H,d,J= 6.0 Hz,H - 6),6.22(1H,d,J= 6.0 Hz,H - 8)。13C - NMR(600 MHz,DMSO -d6)δ:154.5(C - 2),122.7(C - 3),180.7(C - 4),162.5(C - 5),99.4(C -6),164.8(C-7),94.1(C-8),158.1(C-9),104.9(C-10),121.7(C-1'),115.5(C-2',C-6'),130.6(C-3',C-5'),157.9(C-4')。以上波谱数据与文献[14]的报道结果基本一致,经鉴定,化合物2 为5,7,4' - trihydroxyisoflavanone(C15H10O5)。
2.3 抗炎活性评价
2.3.1 细胞培养
RAW264.7细胞在含10%低内毒素胎牛血清、青霉素G(10 000 U/ mL)、链霉素(10 μg/ mL)、L- 谷酰胺(29.2 mg/ mL)的DMEM 培养基中,置37 ℃、5%CO2培养箱中传代培养,收集对数生长期细胞。
2.3.2 CCK-8 法检测细胞活力
取对数生长期的RAW264.7 细胞,用培养基制成2×106个/mL的单细胞悬液,接种于96孔板,置培养箱中培养24 h。试验分为水洗脱部位组(A 组)、40%乙醇洗脱部位组(B 组)、70%乙醇洗脱部位组(C 组)、100%乙醇洗脱部位组(D 组)、阳性对照组和空白组,每组各6 个复孔。吸弃各孔培养液,A 组、B 组、C 组、D 组每孔加质量浓度为50 μg/mL 的供试药液,阳性对照组加浓度为0.5 μmol/ L 的地塞米松,空白组加培养基。置培养箱中继续培养24 h后,上述各组各孔分别加10 μL质量浓度为5 mg/mL 的CCK-8溶液,30 min后利用酶标仪于570 nm 波长处测定吸光度值,计算细胞存活率,试验重复3 次。结果在50 μg / mL 质量浓度作用24 h 后,A 组、B 组、C 组、D 组细胞存活率均在80%以上,但组间无显著差异(P>0.05)。详见图1。

图1 不同极性部位作用下RAW264.7细胞的存活率Fig.1 Viability of RAW264.7 cells under different polar parts
2.3.3 Griess 法检测细胞产生NO 含量
试验分为A 组、B 组、C 组、D 组、阳性对照组、模型组和空白组。取对数生长期的RAW264.7 细胞,用培养基制成2 × 106个/ mL 的单细胞悬液,接种于96 孔板,置培养箱中培养24 h。24 h 后吸弃上清液,A 组、B 组、C组、D组分别加入待测物溶液(质量浓度为50 μg/mL),阳性对照组加入地塞米松(浓度为0.5 μmol/L),模型组和空白组加入等量完全培养液。2 h 后,A 组、B 组、C组、D组、阳性对照组加入LPS(质量浓度为10 μg/mL)继续培养,模型组加入LPS(质量浓度为10 μg/mL)刺激24 h,空白组加入等量完全培养液。24 h 后,取50 μL培养基上清液,加入Greiss1试剂,室温避光振摇10 min,再加入Greiss2 试剂,室温避光振摇10 min,以完全培养基加显色剂作为空白对照,利用酶标仪于540 nm波长处测定各孔的吸光度值。结果与模型组比较,A组NO释放量增多,B组、C组、D组NO释放量均显著减少(P<0.001),且B 组减少最多,故以40%乙醇洗脱部位进行系统分离。详见图2。
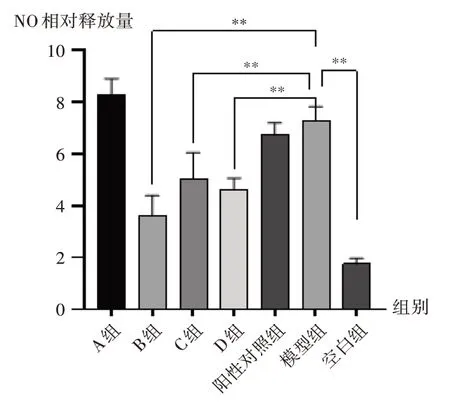
图2 不同极性部位对RAW264.7细胞产生NO的影响Note:Compared with those in the model group,*P <0.01,**P <0.001(for Fig.2 - 3).Fig.2 Effect of different polar parts on NO production in RAW264.7 cells
2.3.4 免疫印迹(Western blot)法检测iNOS 和COX-2蛋白表达
取对数生长期的RAW264.7 细胞,用培养基制成5×105个/mL的单细胞悬液,接种于12孔板,置培养箱中培养24 h。试验分组及给药同2.3.3 项下。24 h 后,提取细胞总蛋白,采用Western blot法检测iNOS和COX-2的蛋白表达水平。结果与模型组比较,A 组、B 组、D 组COX - 2 蛋白表达下调;B 组iNOS 蛋白表达显著下调(P<0.01),故以40%乙醇洗脱部位进行系统分离。详见图3。
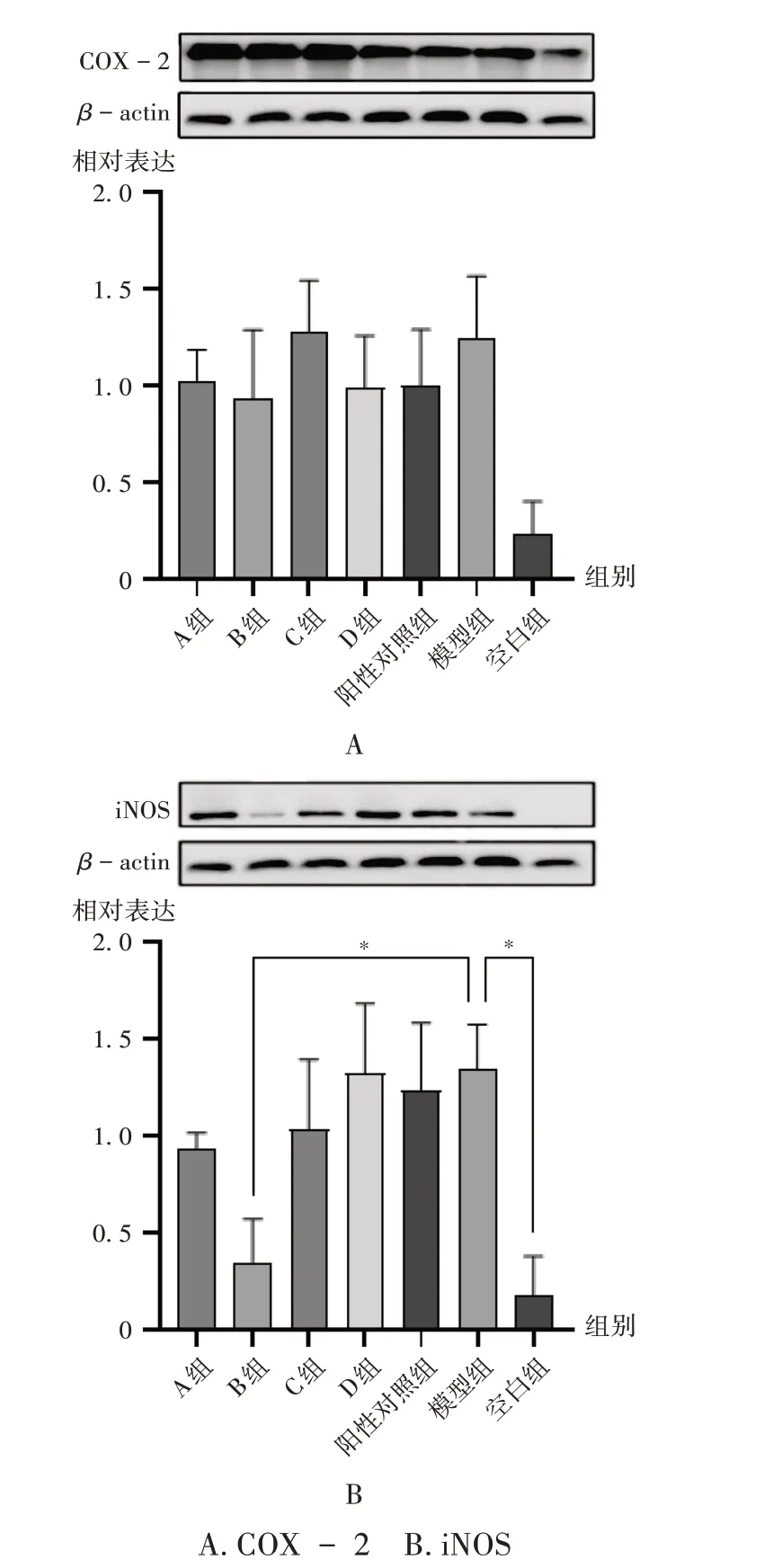
图3 不同极性部位对RAW264.7细胞COX-2和iNOS蛋白表达水平的影响A.COX - 2 B.iNOSFig.3 Effect of different polar parts on the expression of COX - 2 and iNOS protein in RAW264.7 cells
3 讨论
本研究中以LPS 诱导的RAW264.7 巨噬细胞炎性模型评价了侗药香花崖豆藤不同极性部位对COX - 2和iNOS 蛋白表达水平的影响。结果表明,其40%乙醇洗脱部位能显著降低NO 的释放量,并能选择性地抑制iNOS 蛋白的表达,提示40%乙醇洗脱部位可能为香花崖豆藤发挥抗炎活性的有效部位。采用凝胶柱色谱及半制备高效液相色谱对其进行系统分离,得到2个化合物,并经NMR 结合文献波谱数据比对确认为5,7 - dihydroxy-2',3',4'-trimethoxyisoflavanone(化合物1)和5,7,4'-trihydroxyisoflavanone(化合物2),其中化合物1为首次从香花崖豆藤中分离得到。
文献[13]报道,化合物1 对LPS 诱导RAW264.7 细胞的NO 生成具有较强的抑制活性,半数有效抑制浓度(IC50)低于50 μmol/ L,而化合物2 对LPS 诱导RAW264.7细胞的COX-2表达有显著抑制作用[15]。提示化合物1 和化合物2 可能为香花崖豆藤发挥抗炎活性的药效物质基础,并可能通过调控COX - 2 和iNOS蛋白的表达而发挥抗炎作用。
香花崖豆藤为治疗偏头痛的侗族常用民间药材,应用历史悠久。研究表明,偏头痛患者NO 水平增加引起的氧化应激性损伤是引起偏头痛的重要原因[16-18]。抑制一氧化氮合酶(NOS)对偏头痛的急性或预防性治疗提供了可行途径。本研究中初步探讨了香花崖豆藤40%乙醇洗脱部位通过选择性抑制iNOS 蛋白的表达,以发挥治疗偏头痛作用的部分药效物质基础,可为其治疗偏头痛的药理作用研究及后续开发提供参考。
