“港澳药械通”新药遴选评估维度及指标建立
2024-03-18陈佩玲王南松
李 颖,陈佩玲,王南松
(香港大学深圳医院,广东 深圳 518000)
2019年2月18日,中共中央、国务院印发《粤港澳大湾区发展规划纲要》[1],指出要推动大湾区优质医疗卫生资源紧密合作。2020年11月25日,国家市场监督管理总局等部门印发了《粤港澳大湾区药品医疗器械监管创新发展工作方案》[2],授权以我院为试点医院,使用临床急需、已在港澳上市的药品,即“港澳药械通”政策。依托香港大学附属医院的定位及前期引进港澳药品经验的优势,建立药品遴选、论证审查、项目申报、临床使用管理、患者随访、风险监控等环节的制度建设和流程管理。截至2023年5月29日,我院已通过该政策引进临床急需港澳药品20个,惠及740例患者,共计1 609人次。不仅解决了内地居民往来港澳的医疗需求,还实现药品“零差价”的公益性[3]。目前,“港澳药械通”政策指定医疗机构已扩至19家[4]。面对信息获取不易、种类广泛的港澳药品,不同医院开展药品综合评价的需求与能力可能存在差异,如何获取准确的港澳药品资料,遴选是否根据循证医学的基本原则,能否契合医院临床用药需求是亟待解决的问题。因此,本研究中建立了规范、统一标准的“港澳药械通”新药遴选模式,旨在为其他医疗机构开展药品遴选工作提供参考。现报道如下。
1 相关地区新药监管审批模式及医院新药引进制度
1.1 香港、澳门新药监管审批模式
香港、澳门与内地医疗体制不同,药品监管模式也存在差异。内地药品由国家药品监督管理局统筹注册审批和监管;香港由政府卫生署药物办公室负责西药行政管理,由药剂业及毒药管理局负责审批注册;澳门由卫生局负责药品注册和进口审批。香港申请进口注册需提交药物制造及品质管制程序的资料、临床研究报告及国外售后科学研究报告。如果药剂或生物组分从未在香港注册,还需提交其他国家的注册证明,药品建议说明书,安全疗效和质量方面的专家研究报告,欧盟风险管理计划,美国风险评估及缓解策略等。澳门申请进口注册需提交注册证书、生产准照、外包装样本、说明书,以及其他国家或地区注册及销售证明,安全疗效和质量方面的专家研究报告,亚洲人群的临床试验报告,欧盟风险管理计划或美国风险评估及缓解策略[5]。
1.2 海南博鳌乐城国际医疗旅游先行区特许药械审批模式
2019年至2023年,海南省针对博鳌乐城国际医疗旅游先行区特许药械审批出台了一系列政策[6-9],简化了进口药械审批流程,明确了申报条件、申报流程和申报材料。乐城国际医疗旅游先行区医疗机构因临床急需可申请引进在美国、欧盟、日本等国家或地区批准上市,但未获我国批准注册的,且国内已上市品种无法替代的药品。由海南省卫生健康委员会及海南省药品监督管理局共同负责审批,对药品自评文件、使用计划、境外临床使用情况、适用范围、适用人群、全球不良事件发生情况、人种差异使用风险、伦理审查资料、安全防范措施等开展综合评估[10]。
1.3 医疗机构药品遴选的决策流程要求
《关于规范开展药品临床综合评价工作的通知》[11]及其附件《药品临床综合评价管理指南》明确了药品临床综合评价的目的原则、组织管理、规范流程、内容方法、质量控制、结果应用等,提出了2 条主线(技术评价和政策评价)和6 个维度(安全性、有效性、经济性、创新性、适宜性、可及性)开展药品临床综合评价的要求。
2 “港澳药械通”新药遴选模式建立
2.1 新药遴选模式维度选择
参考香港、澳门的注册管理模式,结合相关政策和权威技术性文件,同时依据《香港大学深圳医院新药评估循证医学原则》《药品临床综合评价管理指南》《医疗机构药品遴选指南》[12],借鉴综合评价原则和方法[13-16],对遴选维度和指标进行拆分、整合和细化,药品遴选模式主要从药学特性、有效性、急需性、安全性、伦理审查、社会效益6 个维度进行评估,以实现评估的合理性、独立性、导向性、可操作性和可比性。
药学特性:参考世界卫生组织(WHO)基本药品目录,以港澳地区临床应用实践的有益做法和经验为基本依据,聚焦药品特性、药品生产企业及境内外注册情况和目录收载情况。
有效性:临床有效性即药物疗效,对境外药品的遴选评估以研究型指标为主,辅以港澳临床使用情况,建立指南推荐级别和强度、临床研究疗效证据及级别、港澳地区临床使用情况3个遴选指标。证据来源主要为各类具有循证医学证据的指南或研究文献,推荐分级的评价、制定与评估系统(GRADE)审查原则,证据等级根据文献质量分为“1+ +”“1+”“1-”“2+ +”“2+”“2-”“3”“4”,推荐级别根据证据级别和文献研究结果分为A级、B级、C级、D级。
急需性:临床急需药品一般用于诊疗危及生命或严重损害生存质量的疾病,可挽救生命、治愈疾病或显著延缓疾病进展,中断使用对患者健康结局影响显著。医院根据日常诊疗需求提出药品引进申请,应重点考虑临床急需性。根据药品适用人群不同,可从药品不可替代性、疾病的流行病学特点、药物临床使用情况、特殊人群用药等指标进行评价。我院引进的第1个港澳药品为抗D 免疫球蛋白注射液,用于抗D 免疫(Rho)阴性血液妇女分娩抗D免疫(Rho)阳性血液婴儿的常规抗D预防免疫,可有效降低母亲分娩或流产时新生儿溶血病的发生风险。虽然中国抗D 免疫(Rho)阴性血液妇女的发生率很低(0.2%~0.3%),但目前国内尚无可替代药品,结合“三孩”生育的鼓励政策,该药品的引进对于育龄妇女具有重大临床意义。
安全性:按《广东省粤港澳大湾区内地临床急需进口港澳药品医疗器械管理暂行规定》(粤药监许〔2021〕4 号),港澳药品申报资料需包括在已上市地区的药物警戒信息,如港澳地区或亚洲地区或亚裔人群中是否有出现过严重药品不良反应导致死亡、危及生命、致癌、致畸、致出生缺陷、致显著或永久的人体伤残或器官或功能的损伤等情况。不良反应发生率及严重程度,禁忌证及药物相互作用,药物警戒信息,安全性证据为遴选考量指标。
伦理审查:按《广东省药监局急需进口港澳药品医疗器械管理暂行规定》(粤药监许〔2021〕64号),使用急需药械前必须经医疗机构伦理委员会审查同意,并做好知情同意相关工作。考虑港澳药品可能会缺少我国内地或亚洲人群的临床试验研究,伦理审查也是药物引进前的必备步骤。医院药学部联合医务管理部、伦理委员会及临床试验中心共同讨论建立《非国内注册上市药品使用须知模板》《非国内注册上市药品使用知情同意书模板》《境外药械真实世界临床数据收集记录表通用参考模板》,并将前2个文件嵌入医院信息系统,纳入患者医疗文书记录。其中《非国内注册上市药品使用须知模板》除纳入药品简介、治疗方式和过程、用药方案、可能出现的不良反应和使用注意事项外,还要纳入港澳药品在欧美等发达国家上市说明书的黑框警告、召回或撤市说明等信息,以让患者充分知情。
社会效益:该维度是指引进境外药品后对社会起到的积极作用,主要从社会贡献、社会责任、社会影响等着重考量港澳药品是否能弥补我国内地注册药品空白、服务群众的满意度,是否具有积极引领导向的社会影响及除医疗诊疗效果以外的其他附加效益。如欧美国家抗D 免疫球蛋白注射液的普遍应用已基本上消除了相应的免疫性水肿所致围产儿死亡。我院引进的抗D 免疫球蛋白注射液,不仅弥补了目前国内无可替代的适应证空白,有效降低了抗D 免疫(Rho)阴性母亲分娩或流产抗D 免疫(Rho)阳性胎儿时的死亡风险,对有意愿生产多胎的家庭有较积极的社会影响力。
2.2 新药遴选模式建立
基于循证医学治疗原则,“港澳药械通”药品遴选模式参考药品临床综合评价管理方法,建立了6 个维度、15 个指标和评价内容,构成“港澳药械通”新药遴选的核心指标体系。详见表1。
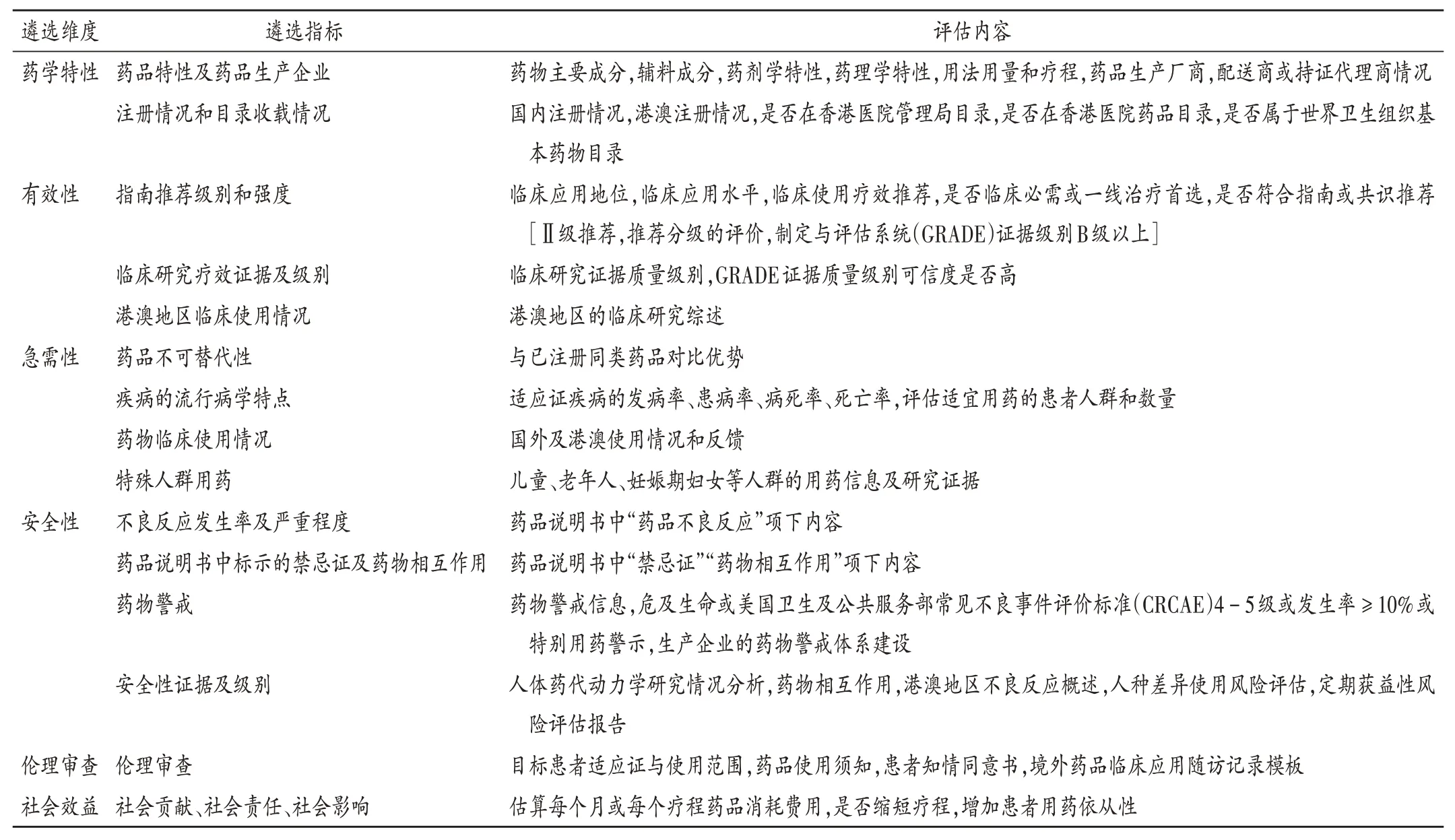
表1 “港澳药械通”新药遴选评估维度、指标和评价内容Tab.1 Evaluation dimensions,indicators,and contents of selection of new drugs based on ″Hong Kong and Macao Medicine and Equipment Connect″ policy
2.3 完善港澳药品风险防范与管理措施
港澳药品在我国内地无临床使用和药品管理调剂的经验,要求药品一经引进只能在确保正确使用的范围内开具,具体管理措施如下。1)临床科室牵头建立具体且切合临床实际的技术指南和操作规范,最好能形成临床路径。医师应熟知药品可能出现的不良反应及处置预案。2)充分评估医师的临床经验、诊疗能力和风险防控能力,进一步对医嘱开具权限进行分配和管理,避免药物滥用。医院制订了《港澳药械通临床使用监督管理制度》,要求对临床工作经验丰富的副高或副顾问及以上职称医师才能授予药品使用权限,使用前须有药品专项培训和考核记录,与香港教授共同商定用药方案,以确保用药安全。3)建立紧急就诊预案流程和随访档案。若患者用药后出现严重不良反应,应立即停药,采取合理的安全防范措施控制风险,并向广东省卫生健康委员会和广东省药品监督管理局报告。4)境外药品采购流通环节复杂,采购时限影响因素较多,临床科室应做好用药前的患者知情告知,制订港澳药品无法供应时的替代治疗方案。
我院药学部建立了详细的港澳药品管理制度,设置了专用库房,配备了自动药柜和摄像头,开发了小程序,港澳药品的采购、入库、分包、调剂、包装、回收等环节和流向均可追溯。对于港澳药品可能存在的风险(包括但不限于药品召回等)也出台了具体管理方案。根据《粤港澳大湾区内地指定医疗机构使用临床急需进口药品不良反应/ 事件报告和监测工作指南(试行)》[17],医院设置药械监测机构,制订清晰的管理制度和监测上报流程,对监测负责人和不良反应分析小组成员进行专业培训。医院安全事件管理系统设置了单独的港澳药械通模块,港澳药品不良反应/不良事件均需填报,并在系统中记录新的及严重不良反应随访信息,定期总结港澳药品的使用情况和不良反应监测情况,并向本单位和上级部门汇报。此外,将港澳药品说明书及时维护到医院合理用药软件和医院信息系统中,以便医师查看。
3 结语
目前,我院完成了从院内遴选、伦理审查、项目申报、订单采购、进口通关、配送查验、贮存出库、授权管理、知情同意、使用登记、收费管理、患者随访、不良事件监测等全流程的制度建设与实践操作,建立了“港澳药械通”新药遴选模式,为粤港澳大湾区药械监管创新发展政策的制订,以及全国卫生事业发展新模式的建立提供参考。
