参芪复方含药血清对高糖环境下大鼠骨髓EPCs的影响*
2024-03-18何敏慧谢红艳谢春光
何敏慧 高 泓 谢红艳 谢春光△
研究发现,当血管内皮损伤后,虽然周围的成熟内皮细胞可通过分裂增殖对其进行修复,但这一作用非常有限,而EPCs才是发挥血管内皮损伤修复的主要力量[1],EPCs通过动员、归巢、转化等一系列过程完成血管内皮损伤的修复[2]。调控EPCs干预糖尿病大血管损伤进程的思路成为近年研究热点。研究发现,通过提高EPCs数量和功能,可以有效改善糖尿病大血管损伤[3]。参芪复方由人参、黄芪、生地黄、天花粉、山萸肉、丹参、制大黄组成,具有益气养阴、活血化瘀的功效;临床应用20余年,是具有糖尿病大血管保护作用的临床有效验方[4]。现代药理研究证实参芪复方中大补元气的人参、黄芪,祛瘀生新的丹参对活化EPCs有重要意义,在其他复方对EPCs研究中,也证实滋阴调脾补肾的山药、山萸肉、生地黄占有重要席位[5]。为了明确研究参芪复方是否对能够保护血管内皮的EPCs具有促进和保护的作用,本实验拟采用离体实验的研究方法,观察高糖环境下大鼠骨髓源性EPCs的迁移、增殖作用。
1 材料
1.1 动物选择体质量120~140 g SD(Sprague-Dawley)大鼠,SFP(Specific pathogen free)级,本实验SD大鼠均于成都达硕生物科技有限公司处购买,实验动物生产许可证号:SCXK(川)2020-0030。
1.2 药物D-(+)葡萄糖(sigma,德国,批号:LC26022V);参芪复方中药饮片由成都中医药大学附属医院药剂科提供,参芪复方冻干粉由四川百草精工生物科技有限公司加工。
1.3 试剂EGM-2培养基(lonza,美国,批号:0001056859);Histopque-1083(sigma,德国,批号:RNBJ9540);FN(MCE,中国,批号:103747);Anti-CD34 antibody(abcam,英国, 批号:GR3240236-18);Anti-VEGF Receptor 2 antibody(abcam,英国,批号:GR3320191-9);CCK-8试剂盒(biosharp ,中国,批号:BS350B);结晶紫(碧云天,中国) ;Transwell(Corning,美国,批号:15421051)。
1.4 仪器流式细胞仪(Thermo Fisher Scientific,美国);低速冷冻离心机(四川蜀科仪器有限公司,中国);二氧化碳培养箱(上海力申科学仪器有限公司,中国);荧光显微镜(奥灵巴斯,日本);酶标仪(biobase,中国)。
1.5 方法
1.5.1 参芪复方含药血清制备将适应性喂养3 d后的12只体质量(200±20)g的SPF级雄性SD大鼠随机分为2组,各6只:①含药血清组:以参芪复方冻干粉灌胃1.44 kg·d,每天2次,连续灌药7 d;②空白血清组:用等量的生理盐水灌胃,每天2次,连续7 d。末次给药1 h后,取血,离心,除菌,灭活,无菌分装,放置-80℃保存备用。
1.5.2 EPCs的培养 鉴定大鼠麻醉处死后,取股骨、胫骨剪破,用PBS反复冲洗髓腔(操作保持无菌);细胞悬液用70 um Filter Unit过滤后,按1∶1的比例将Histopque-1083分离液与细胞悬液先后加入15 ml离心管中,离心,2000 r/min,20 min;取出中间云雾层的单个核细胞,用EGM-2培养基重悬细胞,1500 r/min离心10 min,操作2次;把细胞悬液接种FN包被的六孔板中,48~72 h进行第1次换液,从第2次换液起,每2~3 d换液1次,7~9 d可进行传代。
收集纯化后的原代EPCs,再用预冷的流式缓冲液调整细胞密度为5×106个/ml,将细胞悬液加入流式管中。再将Anti-CD34抗体(ab8158)、Anti-VEGF Receptor 2抗体(ab2349)加入流式管中,4 ℃避光孵育1 h。之后取400 g,离心5 min,然后重悬于冰冷的流式缓冲液,加入二抗,4 ℃避光孵育30 min。再取400 g,离心5 min,重悬于冰冷的流式缓冲液,进行洗涤,重复3次。上流式细胞仪分析。
1.5.3 构建高糖模型①分组。EGM-2培养基含糖5.5 mmol/L,将本底EGM-2培养基设为contrrol组;添加葡萄糖,用EGM-2培养基配制成含糖15 mmol/L、25 mmol/L、35 mmol/L、45 mmol/L、55 mmol/l培养基组[6]。按照分组提前备好含不同浓度葡萄糖的EGM-2培养基。②EPCs迁移能力检测。首先分别在上室和下室中加入100 μl和600 μl EGM-2培养基于温箱中平衡1 h,收集细胞后, 将EPCs用EGM-2培养基重悬,并计数。将平衡后的小室取出后去除培养基,按分组在上室中加密度为15000个/100 μl,200 μl细胞悬液,下室加入500 μl含10%FBS的培养基。培养24 h后,先将小室用4%多聚甲醛固定30 min,再用结晶紫染色,最后用PBS浸洗3遍,于倒置显微镜下任选5个视野观察,计数迁移细胞数量。③EPCs活性增殖能力检验。用0.25%胰蛋白酶消化收集贴壁细胞,用EGM-2培养基重悬,并计数,按8000个/孔的密度接种至 96 孔板中,每孔100 μl EGM-2培养液。培养箱中过夜使细胞贴壁。根据分组分别换用上述正常培养基及含糖培养基,至培养箱中培养24 h。每孔加入CCK-8 10 μl,避光孵育1 h后,酶标仪检测450 nm处吸光度(OD)值。
1.5.4 不同浓度参芪复方血清对高糖环境下EPCs增殖 迁移影响①分组及干预。选择45 mM高糖刺激24 h后,1组设为control组,加入45 mM高糖+EGM-2培养基,其余3组分别在45 mM高糖+EGM-2培养基的基础上加入终浓度为(5%、10%、15%)的参芪复方血清。分别培养24、48 h。按照分组提前备好含不同浓度参芪复方血清的高糖培养基。②EPCs迁移能力检测。③EPCs活性增殖检验。

2 结果
2.1 EPCs的鉴定通过流式细胞仪检测原代细胞培养至第11天表面标志物CD34和VEGFR-2的表达,所测细胞共同表达CD34、VEGFR-2的细胞占总细胞的96.4%。见图1。

图1 流式细胞检测原代细胞表面标志物CD34/VEGFR-2
2.2 不同浓度葡萄糖刺激下EPCs迁移能力各组细胞随着葡萄糖浓度的升高,细胞从上室迁移至下室的EPCs比例逐渐减少,正常培养基含糖量5.5 mM,作为contrrol组。与control组比15~55 mM迁移能力递减,其中55 mM浓度时抑制最明显(P<0.0001)。见图2。
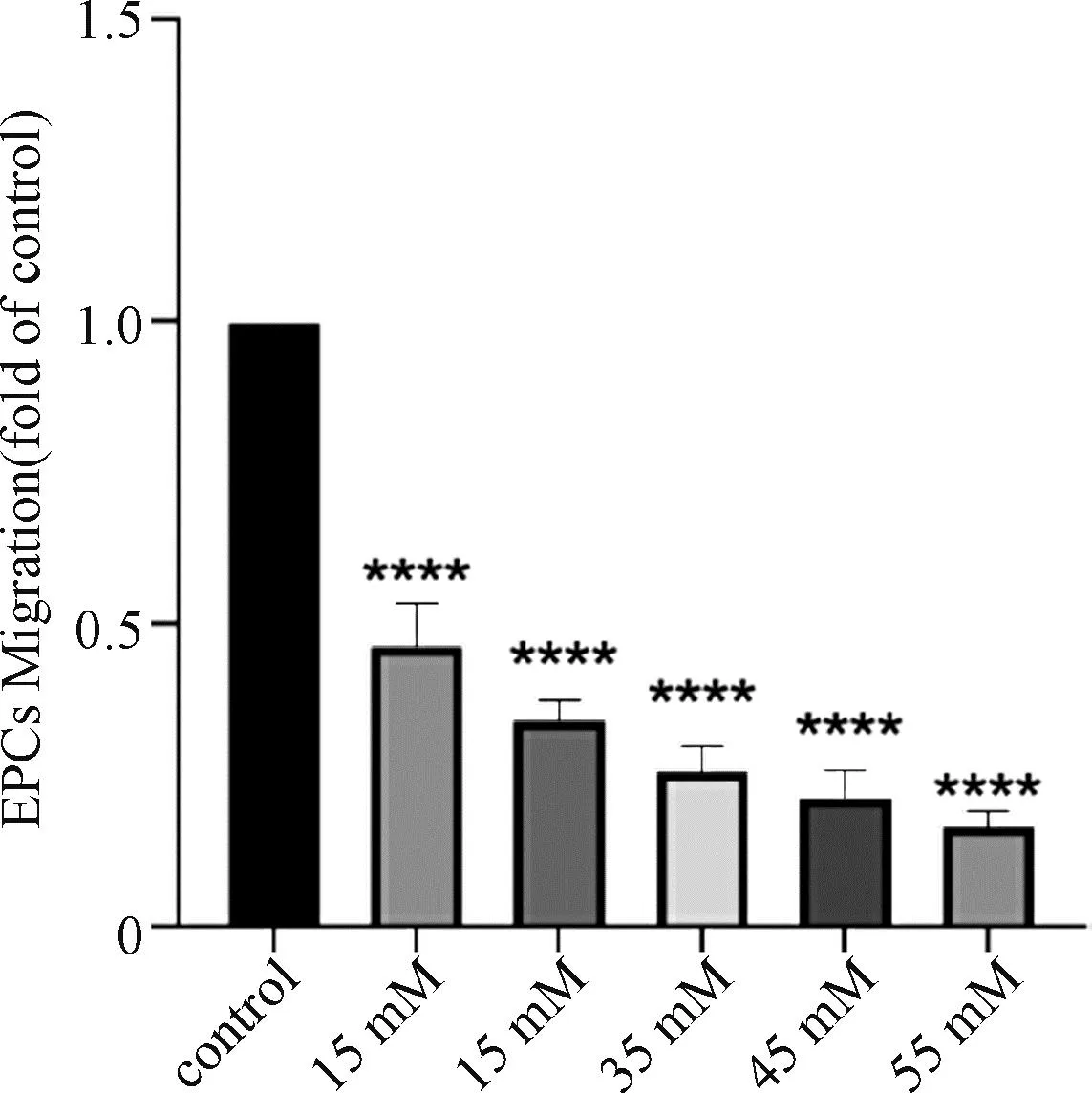
(注:****表示P<0.0001)
2.3 不同浓度葡萄糖刺激下EPCs活性增殖能力EPCs在不同浓度葡萄糖刺激24 h后,通过CCK-8检测其活性增殖能力,显示随着葡萄糖浓度的升高,对其的抑制率也越来越高,其IC50=37.43。与control组比55 mM组抑制率最高。EPCs的增殖活性与葡萄糖浓度成负相关。见图3。

图3 不同浓度葡萄糖对EPCs的抑制
得知葡萄糖浓度与EPCs的迁移能力、增殖活性为负相关,选择45 mM高糖细胞模型进行后续实验;本实验中葡萄糖对 EPCs的半数抑制率的有效浓度在37.43 mM,在45 mM时,与control组比,EPCs的迁移能力被抑制了80%左右,且45 mM、55 mM的迁移抑制,差异无统计学意义(P>0.05);结合高糖环境下EPCs增殖、迁移能力分析,45 mM是适合探究高糖环境对EPCs造成损伤的浓度。
2.4 高糖环境下不同浓度参芪复方血清对EPCs迁移能力影响在Transwell实验中EPCs在45 mM高糖刺激+参芪复方血清干预24 h及48 h后。结果显示:参芪复方可以一定程度恢复高糖对EPCs的迁移能力的抑制。高糖刺激+5%参芪复方血清干预24 h后,对EPCs的迁移能力改善最佳。见图4。

(注:****表示P<0.0001,***表示P<0.001,**表示P<0.005,*表示P<0.05)
2.5 高糖环境下不同浓度参芪复方血清对EPCs增殖能力的影响髓源EPCs在45 mM高糖刺激24 h后,用5%、10%、15%的参芪血清干预24、48 h后。结果显示:不同浓度参芪复方干预高糖环境下EPCs 24、48 h后,EPCs增殖能力均有所改善;干预48 h较24 h,改善更明显,且干预48 h时,5%参芪复方浓度作用最佳。见图5。

(注:****表示P<0.0001,***表示P<0.001,**表示P<0.005)
3 讨论
EPCs作为保护血管内皮的重要角色,主要来源于骨髓;EPCs不同于其他祖细胞,而与干细胞相似,具有自我更新和多种分化的潜能[7,8]。1997年Asahara等人从外周血循环中分离出EPCs[9,10],并证实EPCs是参与血管生成的未分化细胞。当人体受到外伤、缺血、缺氧等外界环境刺激时,EPCs会从骨髓动员、迁移到循环血液中,参与受损组织的修复和再生[11]。多项证据表明糖尿病(DM)中EPCs数量减少和EPCs功能的各个方面受损, EPCs的功能改善可以使DM患者受益[12,13]。目前已经进行了使用 EPCs治疗缺血性心脏病和严重外周动脉疾病的临床试验[14,15],但通过恢复EPCs的功能治疗DM或是通过正常EPCs治疗DM及其并发症的临床证据较少。通过恢复EPCs功能治疗DM具有巨大潜力。
通过课题组前期对糖尿病大血管并发症多维度的研究,临床随机对照试验证明参芪复方能够有效改善DM患者血糖控制水平[16]、调节血脂、显著提高患者生活质量,并在改善DM患者胰岛β细胞功能、增加餐GLP-1分泌、调节肠道菌群、改善微循环、降低DM患者炎症反应及氧化应激水平、修复患者血管内皮损伤等各个方面发挥积极作用,能够有效防控糖尿病大血管并发症的发生发展[17]。参芪复方,用人参、黄芪以升阳运脾、补中益气,营卫同守,血脉同固,助脾布散水谷精微,以升清降浊,补后天以养先天;用天花粉、生地黄以滋阴降火,共养肺脾肾阴,蓄真水之亏;山药、山茱萸以健脾温肾、养阴益气;用酒制大黄、丹参以活血化浊、祛瘀生新。方中黄芪与山药相配,补气升阳助脾复运,天花粉与生地黄、山药相配,肺脾肾及三焦之阴亏得以滋补,内蕴之火可以通降,全方君臣佐使相宜,养阴益气,活血化瘀,从而防止糖尿病大血管损伤。
EPCs的迁移与数量直接关系到修复内皮损伤的血管新生与血管形成[18]。提高高糖环境下EPCs的增殖、迁移是EPCs能否顺利完成糖尿病大血管并发症血管损伤修复的关键之一。本研究结果发现,参芪复方干预高糖环境下EPCs 24、48 h时,均可改善EPCs增殖,与其浓度呈负相关。在参芪复方干预高糖环境下的EPCs 24 h时,对增殖、迁移均有改善,且参芪复方血清5%为最佳;当干预48 h时,同是5%对增殖能力的改善最佳,而各组迁移能力差异无统计学意义;改善高糖环境下EPCs增殖活性而言,干预48 h的组皆优于干预24 h的组。综上,参芪复方可以明显改善高糖环境下EPCs的迁移能力、增殖活性。提示参芪复方治疗糖尿病大血管并发症可能还与其改善EPCs的迁移能力、增殖活性有关。同时也为临床从改善 EPCs 功能角度治疗糖尿病血管并发症提供了新的思路。
