螺蛳肉汤包的DNA提取方法效果比较及优化研究
2024-03-15黄晓韵杨丽玉
◎ 黄晓韵,杨丽玉,巫 坚
(1.广西-东盟食品检验检测中心,广西 南宁 530029;2.广西医科大学 公共卫生学院,广西 南宁 530021)
随着生活水平的提高,人们对食品安全及其质量越来越重视。特别是在深加工食品领域,由于复杂的加工工艺,掺伪、转基因成分、过敏原性成分等的检测问题越来越突出。基于核酸的分子生物学检测方法具有高特异性、高灵敏度和简单快速等特点,被广泛应用到深加工食品源性成分鉴定等检测中。深加工食品加工过程中多种因素会对核酸造成破坏[1],且内含成分复杂,造成核酸提取难度加大。因而,深加工食品的核酸提取一直是研究的难点及热点[2]。
柳州螺蛳粉以其独特的风味在最近几年迅速走红,其中独特的“鲜”味来源于螺蛳肉汤包。《食品安全地方标准 柳州螺蛳粉》(DBS 45/034—2021)中规定,螺蛳肉汤料包是以鲜(冻)螺蛳或螺蛳肉、鲜(冻)畜骨或禽骨、食用盐、食用油脂(或不添加)、调味料等为原料,经原料预处理、加水熬制、过滤、冷却(或不冷却)、包装、杀菌(或不杀菌)等工艺加工制成的。其中,螺蛳主要包括环棱螺属(Bellamya)和圆田螺属(Cipangopaludina)等淡水经济螺类,畜骨或禽骨也没有明确的种类,动物源性成分不明;甚至各种调味料还可能涉及转基因成分或过敏原性成分。基于核酸分子特别是脱氧核糖核酸(Deoxyribo Nucleic Acid,DNA)分子的检测方法,在鉴定源性成分领域具有独特的优势[3]。近年来得到广泛应用的有聚合酶链式反应(Polymerase Chain Reaction,PCR)技术[4]、实时荧光PCR(Quantitative Real-Time PCR,qPCR)技术[5]和数字PCR(Digital PCR,dPCR)技术[6]。
螺蛳肉汤包内含物成分复杂,多油脂、盐类和色素,且经高温熬制,对核酸分子破坏严重。本研究通过比较分析常用的核酸提取方法,优化改良适合类似深加工食品的核酸提取方法,尽量去除杂质干扰,得到能进行下一步分子检测的有效核酸,为汤料包内含物源性成分的分析奠定基础。
1 材料与方法
1.1 材料与试剂
预包装螺蛳粉,均为市售。
十二烷基硫酸钠(SDS)、十六烷基三甲基溴化铵(CTAB)、三(羟甲基)氨基甲烷(Tris)、乙二胺四乙酸二钠(Na2EDTA)、乙酸钾、3 mol·L-1乙酸钠、苯酚(Tris-饱和酚)及核酸抽提液(三氯甲烷和异戊醇的体积比为24 ∶1):北京索莱宝科技有限公司产品;蛋白酶K:宝生物工程(大连)有限公司产品;食品DNA 提取试剂盒:德国凯杰(QIAGEN)公司产品;深加工食品DNA 提取试剂盒、荧光PCR 试剂盒:天根生化科技(北京)有限公司产品。
1.2 仪器与设备
OSE-DB-03 型恒温振荡金属浴、OSE-260-01TGem Plus 型全波长微量分光光度计:天根生化科技(北京)有限公司产品;MIKPO185 型小型离心机:德国赫提驰科学仪器公司产品;Applied Biosystems 7500 Fast 实时荧光定量PCR 仪:美国应用生物系统公司产品。
1.3 试验方法
1.3.1 DNA 提取方法
(1)CTAB 法提取DNA。 参考标准《 肉及肉制品中动物源性成分的测定 实时荧光PCR 法》(SB/T 10923—2012)中样品的总DNA 提取方法。
(2)SDS 法提取DNA。参考《转基因动物及其产品成分检测 DNA 提取和纯化》(农业部2406 号公告-7-2016)中样品的总DNA 提取方法。
(3)TIANGEN 沉淀式DNA 提取试剂盒(以下简称TIANGEN 试剂盒)提取DNA。参考天根生化科技(北京)有限公司的深加工食品DNA 提取试剂盒的操作说明书进行试验。
(4)QIAGEN 过柱式DNA 提取试剂盒(以下简称QIAGEN 试剂盒)提取DNA。参考德国凯杰(QIAGEN)食品DNA提取试剂盒的操作说明进行试验。
(5)改良CTAB 法提取DNA。吸取混匀的1.5 mL螺蛳肉汤包样品液于2 mL EP 管中,8 000 r·min-1离心5 min,用一次性无菌脱脂棉签小心刮去凝结浮在上层的油脂,保留沉淀物。加入1 mL 无菌双蒸水,涡旋振荡洗涤,12 000 r·min-1离心5 min 后弃上清。再次用一次性无菌脱脂棉签小心刮去凝结浮在上层的油脂,保留沉淀物。重复上述流程,直至离心后上层无明显油脂且洗涤的液体颜色基本褪色变淡。向所得沉淀中加入700 μL DNA 提取裂解液,再加入20 μL蛋白酶K,混匀,置于65 ℃水浴3 h,并不时振荡;12 000 r·min-1离心5 min,取上清液至新的1.5 mL 离心管中,加入等体积苯酚,充分混匀后12 000 r·min-1离心5 min;取上清,加入等体积核酸抽提液,充分混匀,12 000 r·min-1离心5 min;取上清,加入1/10 体积的3 mol·L-1乙酸钠溶液,混匀后再加入2 倍体积-20 ℃预冷的无水乙醇,-20 ℃下静置1 h,12 000 r·min-1离心5 min,弃上清;70%乙醇洗涤3 次沉淀,于室温下晾干,加入50 μL 双蒸水溶解沉淀,-20 ℃保存备用。
1.3.2 螺蛳肉汤包中DNA 提取效果比较分析
(1)DNA 的浓度和纯度测定分析。吸取1 μL DNA样液,使用全波长微量分光光度计测定DNA 的质量浓度与纯度。在仪器上可直接读出DNA 的质量浓度以及A260/A280和A260/A230的值。根据A260/A280和A260/A230的值判断所提取的基因组DNA 的纯度,其中A260/A280表示DNA 中去除蛋白质和酚物质的情况,A260/A230的值表示DNA 中去除碳水化合物或有机溶剂的情况[7]。
(2)实时荧光PCR 上机检测提取DNA 的有效性。参考《常见畜禽动物源性成分检测方法 实时荧光PCR 法》(GB/T 38164—2019)中的18S rRNA 基因内参引物探针,上机检测提取DNA 是否有效满足下游分子检测需要。其中上游引物序列为TCTGCCCTATC AACTTTCGATGGTA,下游引物序列为AATTTGCGC GCCTGCTGCCTTCCTT,荧光探针序列5’FAM-CCG TTTCTCAGGCTCCCTCTCCGGAATCGAACC-3’TAMRA。
实时荧光PCR 总反应体系为20 μL,体系组成为PCR Master Mix 10 μL,模板DNA 5 μL(稀释到5~50 ng·μL-1),内参引物的上下游引物各0.6 μL,荧光探针0.4 μL,加双蒸水至20 μL。实时荧光PCR 扩增程序为95 ℃预变性10 min,95 ℃变性15 s,60 ℃延伸1 min 并收集荧光,40 次循环。
2 结果与分析
2.1 DNA 提取效果比较
2.1.1 DNA 浓度和纯度的比较
用同一包预包装螺蛳粉的螺蛳肉汤包,分别按照1.3.1 中的(1)~(4)4 种方法平行提取DNA 两份,用全波长微量分光光度计测定DNA 的质量浓度和纯度,如表1 所示。

表1 4 种不同DNA 提取方法对螺蛳肉汤包样品的DNA 提取效果比较表
本试验采用的4 种方法取样量均相同,经仪器测定可直接比较DNA 的质量浓度。4 种提取方法中TIANGEN 试剂盒法提取得到的DNA 质量浓度最高,其次分别是CTAB 法和SDS 法,QIAGEN 试剂盒最低。4 种提取方法的DNA 提取浓度平均值之间最大相差近66 倍,说明不同提取方法分离纯化汤包中总DNA 的效率有较大差异。TIANGEN 试剂盒法使用的是沉淀法,裂解上清液损失最少,这可能是该方法DNA 提取浓度最大的原因;虽然QIAGEN 试剂盒法也使用了蛋白酶K 辅助裂解组织,但螺蛳肉汤包的原料在经过复杂加工后,核酸被破坏严重,特别是被打断短小化,所以使用过柱吸附DNA 的方式损失量较大,这可能是该方法DNA 提取浓度最小的原因。
一般来说,理想DNA 的A260/A280值在1.6 ~2.0,小于1.6 表明有蛋白质污染,大于2.0 可能有RNA 污染;A260/A230值在2.0 左右,小于2.0 可能存在盐类及其他有机化合物的污染。如表1 所示,4 种不同DNA提取方法提取得到的总DNA 的纯度差别较大。其中,CTAB 法的A260/A280值更接近1.6,蛋白质的去除较好,但还有提高的空间;其他3 种方法的A260/A280值相对较低。4 种提取方法的A260/A230值普遍较低,螺蛳肉汤包的汤料含有大量的油脂没有被去除,其可能会与某些盐离子吸附,DNA 中盐类杂质残留较多,在230 nm处亦有较高的吸收值,使得A260/A230值降低。
2.1.2 DNA 有效性的比较
以18S rRNA 基因内参引物探针进行实时荧光PCR 扩增试验。当荧光通道有荧光信号检出,且出现典型的扩增曲线,Ct 值≤30.0,表明提取得到的DNA的浓度及纯度基本满足分子检测扩增试验的要求。对4 种方法提取得到的DNA 进行实时荧光PCR 扩增,其扩增曲线图谱及扩增效果如图1 和表2 所示。
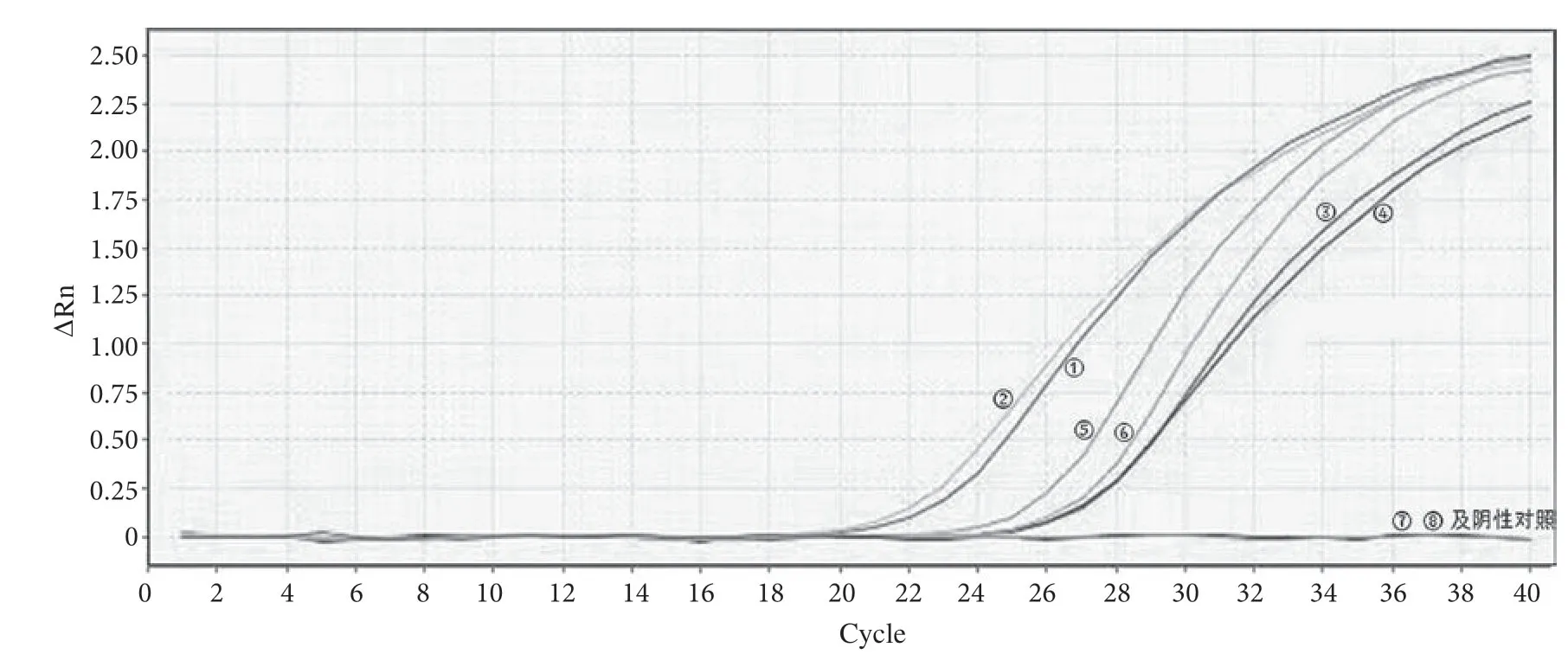
①~⑧的扩增曲线分别表示相对应的提取序号。图1 4种DNA 提取方法提取的DNA 样液实时荧光PCR 扩增曲线图
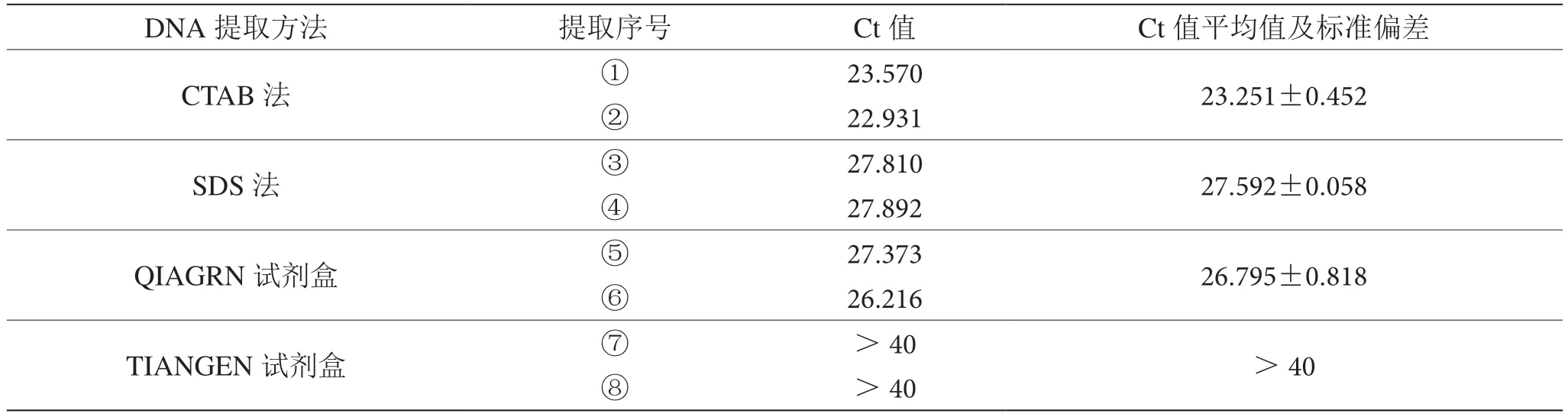
表2 4 种DNA 提取方法提取的DNA 样液实时荧光PCR 扩增效果表
结合图1 及表2,可见CTAB 法、SDS 法和QIAGEN试剂盒法所提取的总DNA 以18S rRNA 基因内参引物探针进行实时荧光PCR 扩增试验时均有较好的荧光扩增曲线,且Ct 值均在30.0 以内,即表明以上3 种方法提取的DNA 是有效可行的。其中CTAB 法提取的总DNA 扩增的Ct 值最低,效果最好。TIANGEN 试剂盒法所提取的总DNA 未检测到有效荧光,可能是提取得到的DNA 中杂质较多,含有抑制荧光扩增的物质。
2.2 改良CTAB 法提取螺蛳肉汤包中DNA 的效果及分析
螺蛳肉汤包包含了大量的盐类、脂肪以及色素等物质,严重降低提取DNA 的效果。针对前述4 种提取DNA 方法的结果,选取初步提取效果较好的CTAB法进行改良。在加入裂解提取液前,用无菌双蒸水多次洗涤沉淀,去除水溶性的盐类及色素,同时脂肪由于离心作用凝结浮在液体上层,可用无菌脱脂棉签去除。此外,由于提取的DNA 的A260/A230值普遍较低,所以在乙醇沉淀DNA 后用70%乙醇洗涤时,增加两次洗涤,尽量去除残留盐类等杂质。经相同取样,按照改良CTAB 法提取的DNA 的质量浓度如表3 所示。对改良CTAB 法提取的DNA 进行实时荧光PCR 上机检测,有效性如图2 及表4 所示。

①和②的扩增曲线分别表示相对应的提取重复序号。图2 改良CTAB 法提取的DNA 样液实时荧光PCR 扩增曲线图

表3 改良CTAB 法对螺蛳肉汤包样品的DNA 提取效果比较表

表4 改良CTAB 法提取的DNA 样液实时荧光PCR 扩增效果表
结合表1 及表3 可知,CTAB 法经改良后,提取DNA 的A260/A280值明显提高且在正常范围内,表明提取过程中蛋白质去除比较彻底。这可能是因为在加入蛋白酶K 恒温酶解前用无菌双蒸水去除汤包中的杂质,特别是水溶性的盐类以及脂肪,减少了抑制蛋白酶K 酶活的物质,提高了酶解效率。这也从最后的质量浓度提高了接近一倍得到佐证。此外,改良CTAB法由于在加入提取裂解液前用无菌双蒸水去除汤包中的杂质,特别是水溶性的盐类以及脂肪,使得最后A260/A230值大大提高。虽然还达不到理想值,但实时荧光PCR 上机检测结果表明其完全满足后续分子检测扩增试验的要求,改良提取方法后,降低了Ct 值(表4)。
2.3 多批次不同品牌预包装螺蛳粉螺蛳肉汤包中DNA的提取及效果分析
按照改良CTAB 法对多批次不同品牌预包装螺蛳粉螺肉汤包中的DNA 进行提取,对得到的DNA 进行实时荧光PCR 效果分析,结果见图3 和表5。改良后的CTAB 法提取多批次不同品牌实际样品DNA 的效果良好,DNA 的浓度和纯度满足实时荧光PCR 要求,且有典型扩增曲线,各样品的扩增Ct 值在16.045 ~26.116,适宜进行下一步物源性成分分子检测。

表5 改良CTAB 法提取的DNA 样液实时荧光PCR 扩增效果表
3 结语
汤料包类深加工食品内含成分既包含动物源性成分,也包含植物源性成分,在食品安全监管中对源性成分的检测还是空白。这是因为这类深加工食品工艺复杂,对其中的成分物质破坏严重,如特征蛋白质完全变性;同时各种成分物质含量较少,传统检测方法无法对微量成分进行检测。基于核酸物质的分子检测方法可以弥补传统检测方法的缺点,但是必须提取到有效可行的核酸。本研究针对预包装柳州螺蛳粉螺蛳肉汤包,比较了4 种常见DNA 提取方法的提取效果,选取提取效果较好的CTAB 法进行改良,通过真核生物通用18S rRNA 内参基因设计的引物探针进行实时荧光PCR 验证提取效果,并进一步用多批次实际样品进行提取DNA 上机确认,成功寻找到一种简单、快捷、可行的提取预包装柳州螺蛳粉中螺蛳肉汤包DNA 的方法,为下一步的源性成分鉴定奠定基础。
