XELOX方案新辅助化疗治疗Ⅱ(T4)期、Ⅲ期结肠癌的疗效分析
2024-03-14王少怡聂凯李冉冉陈达丰薛小军叶磊刘建平周松
王少怡 聂凯 李冉冉 陈达丰 薛小军 叶磊 刘建平 周松
结直肠癌(colorectal cancer,CRC)在所有恶性肿瘤中发病率排名第4,死亡率排名第2[1]。病灶完全性手术切除是结直肠癌根治的唯一有效方法,但确诊后能够第一时间接受根治性手术的病人不超过15%[2-4],即使直接接受了根治性手术,依然有超过约25%病人会出现肿瘤的转移与局部复发[5]。随着新辅助治疗的发展,结肠癌病人接受根治性手术的比例越来越高,术后肿瘤的局部复发和转移率有了明显的降低[6]。2019年中国临床肿瘤协会结直肠诊疗指南[7]建议对Ⅳ期可切除结肠癌肝转移病人行新辅助化疗,对于Ⅱ期、Ⅲ期结肠癌病人并没有明确推荐。本研究探讨XELOX方案新辅助化疗治疗Ⅱ(T4)期、Ⅲ期结肠癌的临床疗效。
对象与方法
一、对象
2012年1月1日~2021年1月1日,我院收治的临床Ⅱ(T4)期、Ⅲ期结肠癌病人50例,均接受腹腔镜根治术治疗。根据病人既往是否接受XELOX方案新辅助化疗分为新辅助化疗(NACT)组和辅助化疗(ACT)组。两组年龄、性别、肿瘤位置、肿瘤类型、临床分期、治疗前CEA、CA19-9水平比较,差异无统计学意义(p>0.05)。见表1。纳入标准:(1)电子结肠镜病理检查诊断为结直肠癌;(2)入院时根据X线胸部平片、CT等影像学检查排除肝脏、肺等远处转移,确定为临床Ⅱ(T4)期、Ⅲ期;(3)年龄50~80岁;(4)肝、肾功能、血常规等无异常; (5)病人体力状况评分(ECOG)≤2分;(6)接受腹腔镜结直肠癌根治性手术;(7)病人或其家属签署知情同意书。排除标准:NACT组未按XELOX方案规律给药;肠穿孔、急性肠梗阻、严重感染、急诊手术;既往有恶性肿瘤放化疗或免疫治疗病史;未在规定的时间内接受术后辅助化疗;病例资料不完善及治疗后失访。
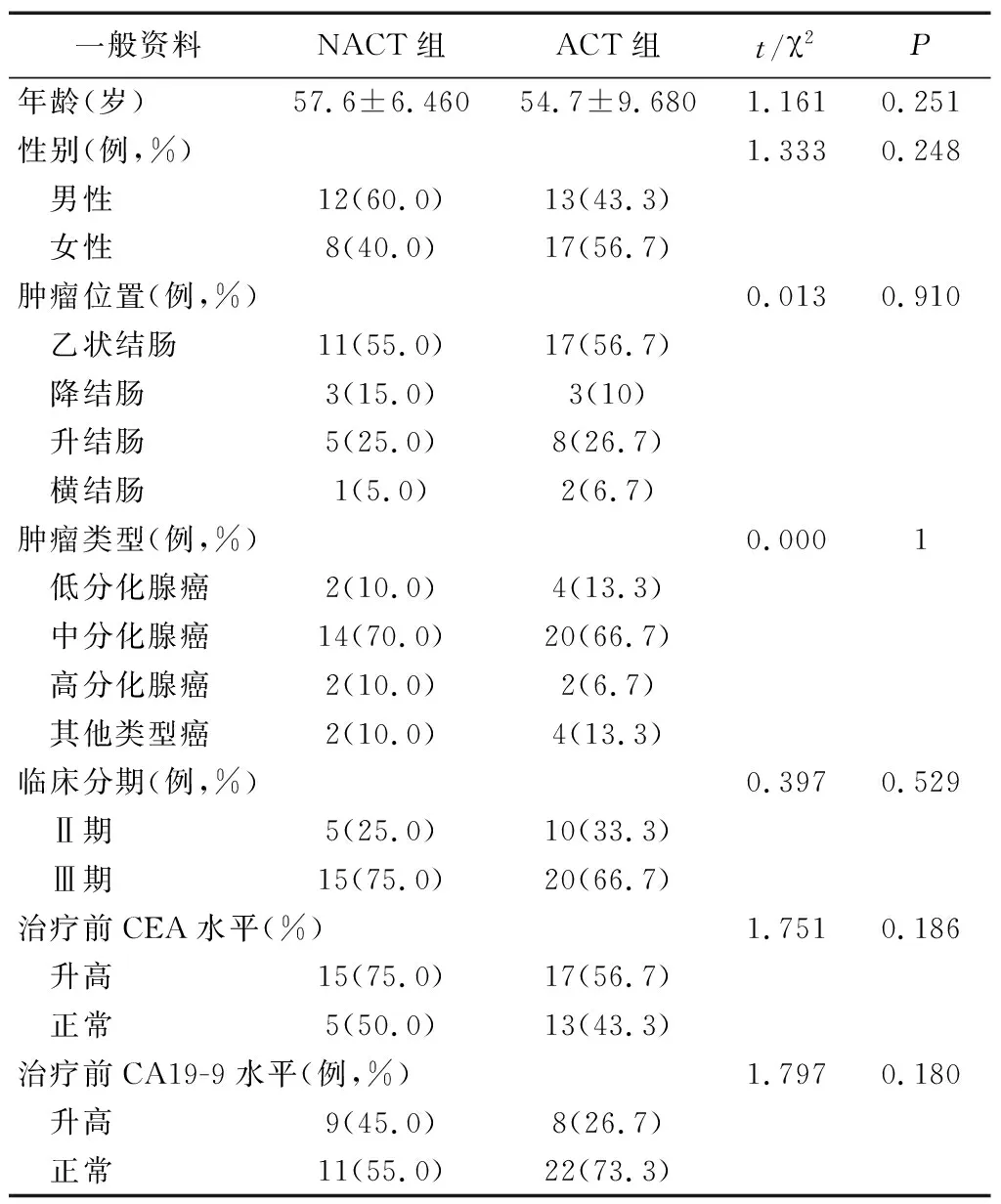
表1 两组一般资料比较
二、方法
1.治疗方法:NACT组方案为术前新辅助化疗+腹腔镜根治性手术+术后辅助化疗;ACT组为腹腔镜根治性手术+术后辅助化疗。新辅助化疗方案为XELOX方案(奥沙利铂130 mg/m2,静脉滴注 ,第1天;卡培他滨 1 000 mg/m2,口服 , 第1~14天),每3周1个疗程,术前化疗3个疗程,新辅助化疗结束后等待2周再次返院行手术治疗。自手术开始计算,术后1个月返院行术后辅助化疗,方案仍按XELOX方案,每3周1个疗程,NACT组术后辅助化疗共5个周期,ACT组术后辅助化疗共8个周期。
2.观察指标:包括性别、年龄、肿瘤分化类型、肿瘤位置、CEA、CA19-9、术后辅助化疗不良反应(骨髓抑制)的发生率、NACT组病例初次入院评估的临床分期、术前评估的临床分期、肿瘤退缩程度、病理反应等级,术中并发症、术后并发症的发生率以及发生类型,术后肿瘤标记物,手术时间、术中出血、术后排气排便时间、住院时间、住院费用;总生存时间(OS)和无病生存期(DFS)。随访日期截止2021年12月30日。
三、统计学方法
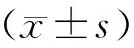
结果
1.两组治疗过程中不良反应比较见表2。NACT组化疗后WBC与NEU降低的发生率低于ACT组,差异有统计学意义(P<0.05)。NACT组出现术中并发症1例,ACT组3例,NACT组术后并发症3例(1例术后胃动力障碍,2例其他并发症);ACT组7例(3例术后胃动力障碍,1例切口感染,3例其他并发症)。两组术中与术后并发症比较,差异无统计学意义(P>0.05)。
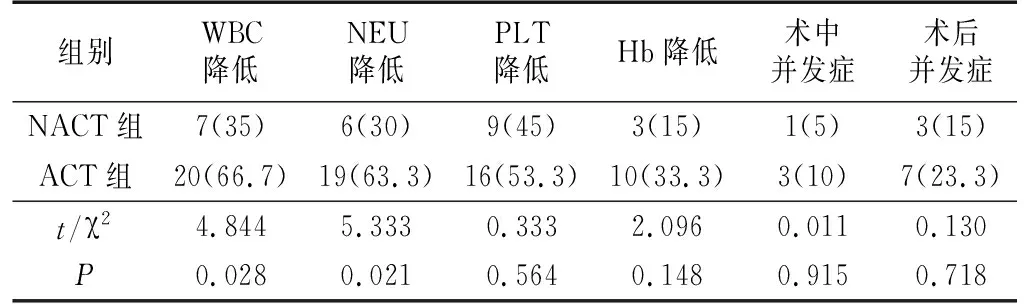
表2 两组安全性比较(例,%)
2.两组近期疗效比较见表3。NACT组较ACT组在术后CAE、CA19-9标志物转阴上具有明显优势,差异有统计学意义(P<0.05)。NACT组手术时长、术中出血、住院费用优于ACT组,两组比较差异有统计学意义(P<0.05)。两组术后排气时间、住院时长比较,差异无统计学意义(P>0.05)。
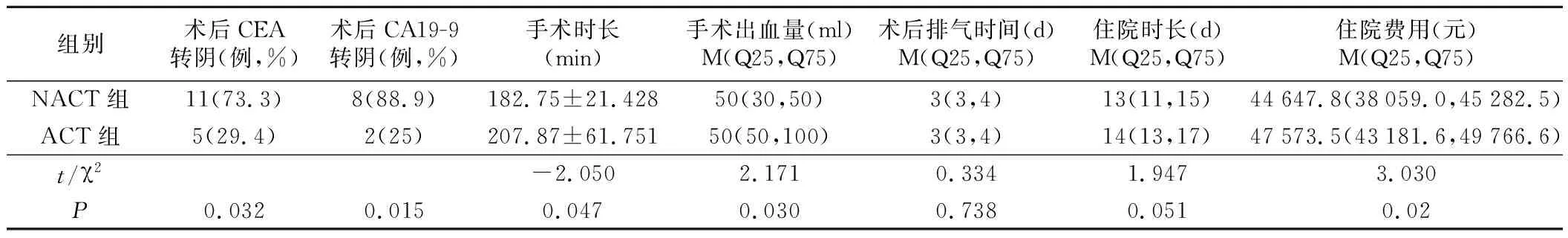
表3 两组近期疗效比较
3.两组中期疗效比较:NACT组化疗前Ⅱ期5例,Ⅲ期15例,化疗后Ⅰ期1例,Ⅱ期10例,Ⅲ期9例,Ⅱ期降期率为20%,Ⅲ期降期率为40%。NACT组术前均经过影像学评估(RECIST1.1标准),达到PR8例(40%),SD12例(60%),无1例出现PD。在Mandard标准下新辅助治疗后病理学TGR评价等级中0级(完全退缩)2例(10.0%),1级(接近完全退缩)6例(30.0%),2级(部分退缩)5例(25.0%),3级(退缩不良或无退缩)7例(35.0%)。病理学评价总体有效率达到65%。NACT组无疾病生存期(DFS)比ACT组长,差异有统计学意义(P<0.05)。两组总生存期(OS)比较,差异无统计学意义(P>0.05)。见图1、图2。
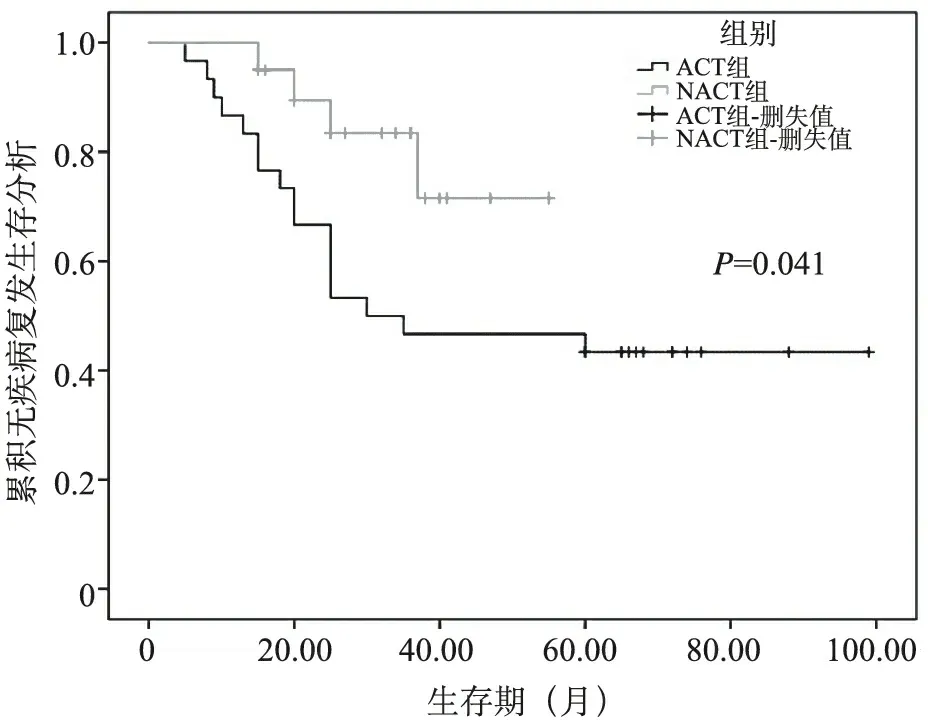
图1 无疾病复发生存期生存分析
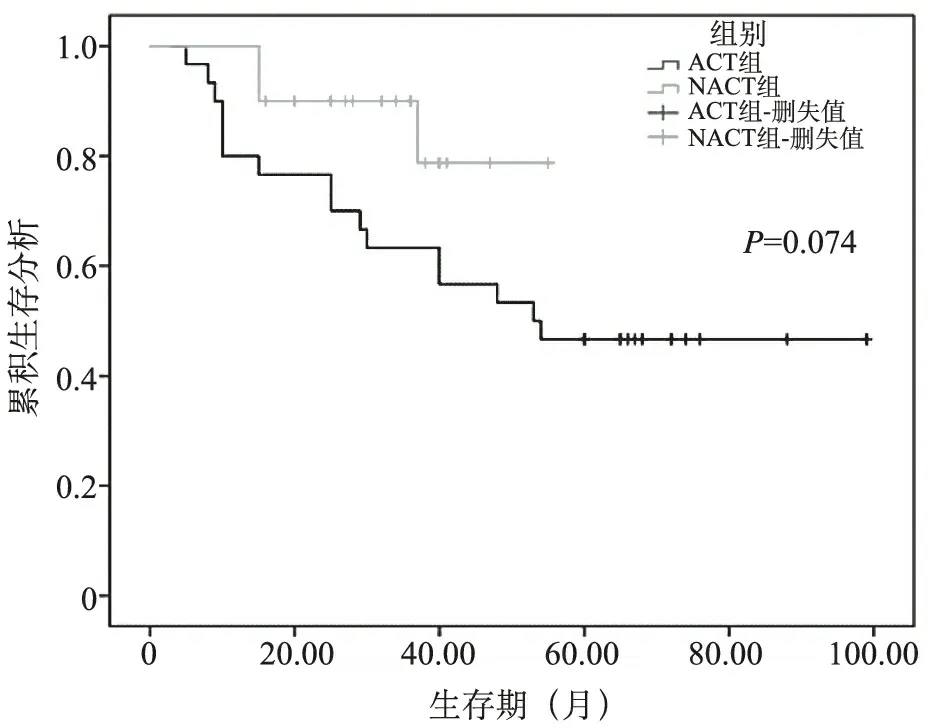
图2 总生存期生存分析
讨论
结直肠癌在我国的发病率排名第三,死亡率排名第五[8]。大部分病人发现时已是晚期,失去手术机会,其中Ⅳ期的病人5年生存率不到10%[9]。自1982 Frei首次将新辅助化疗用于局部晚期不可切除乳腺癌的治疗开始,新辅助化疗缩瘤降期、改善预后的疗效得到了肯定。但同时也面临着一些问题,比如术前行新辅助化疗可能会延误肿瘤的手术时机[10];其次,在新辅助化疗过程中的不良反应导致病人未能接受完整的疗程,严重者会使病人对术后辅助化产生恐惧感,不能接受完整的疗程,影响治疗效果。对于Ⅱ期、Ⅲ期可切除结肠癌病人,各大指南并未推荐新辅助化疗。结肠癌相对直肠癌或其他部位肿瘤而言,腔镜下操作空间相对较大,做到R0切除相对较为容易,同时也没有像直肠癌那样存在“保留肛门”的需求,对于进展期可切除的结肠癌病人,新辅助化疗所带来的获益相对于其引起的不良事件而言似乎没有大的优势。近年来,有研究表明,新辅助化疗在进展期结肠癌的治疗中同样具有较好的可行性与安全性。
本研究中,接受新辅助化疗的20例结肠癌病人均接受完整疗程的化疗,部分病人出现骨髓抑制、胃肠道等不良反应,经对症治疗后均得到缓解,无中止治疗病例。在20例病人中无1例出现肿瘤进展。两组术中、术后并发症无明显差异。对于术后化疗的不良反应,NACT组比ACT组表现出了更温和的化疗效果,术后辅助化疗过程中WBC、NEU出现不良反应率的差异更为明显。可能是因为新辅助化疗后经过手术恢复期再次行术后辅助化疗时,病人的缓解时间延长,提高了病人的耐受性。有研究表明,结肠癌术后全程接受辅助化疗的概率约为70%~80%,部分病人因为化疗的不良反应而产生恐惧心理,从而放弃化疗,新辅助化疗可以将整个化疗过程阶段化,长程化,使化疗的不良反应更小,病人更愿意接受[11]。本研究证明了新辅助化疗治疗Ⅱ期、Ⅲ期结肠癌的安全性。
有研究证实了新辅助化疗对于结肠癌的疗效。2019年美国临床肿瘤学年会上汇报FOXTROT实验的结果显示,在接受新辅助化疗的1 052例结肠癌病人中,有59%的病人出现了肿瘤退缩,其中有一部分甚至出现了病理完全缓解,组织学分期明显降低,使得非R0切除减少了一半,为进一步确认其长期获益,该研究还在继续随访。一项Mate分析中,共纳入了5项随机试验和2项观察性研究,共29 504例病人,新辅助化疗在总生存期[风险比 (HR) =0.76,95% 置信区间 (CI):0.65~0.89,P=0.000 5] 和无病生存期 (HR=0.74,95%CI:0.58) 方面表现出统计学上的显着改善,P=0.02)[12]。这些研究均证明了新辅助化疗在进展期结肠癌治疗中的有利作用。本研究20例接受新辅助化疗的结肠癌病人中,8例达到了PR,无1例出现PD,Ⅱ期的降期率达到了20%,Ⅲ期的降期率达到了40%,新辅助化疗在结肠癌缩瘤降期方面有明细疗效。本研究中入选病例临床分期较早,所有病人基本都可达到R0切除,但是经过缩瘤降期后的手术难度仍然会下降,术中血管的处理、淋巴的清扫会相对顺利。因此,本研究中NACT组术中出血、手术时长与ACT组比较更低。CEA、CA19-9是结直肠癌预后的重要因素,临床上常用于监测肿瘤术后复发以及预测病人的预后[13]。本研究中,NACT组术后肿瘤标志物转阴率优于ACT组,我们预测,在结直肠癌肿瘤复发以及病人预后方面,NACT组优于ACT组。在中远期疗效方面,结肠癌NACT组1年生存率为100%,1年无病生存率100%;ACT组1年生存率为84.4%,1年无病生存率80%,两组DFS、OS的生存曲线均随着时间的推迟呈现出逐步下降的趋势,但NACT组比ACT组下降的幅度小,两组 DFS比较,差异有统计学意义,OS无明细差异。这与部分病人随访时间过短导致删失值过多以及总样本量过小有关。但整体趋势表明,NACT组的预后优于ACT组。
综上所述,新辅助化疗治疗Ⅱ期、Ⅲ期结肠癌安全、可行。新辅助化疗可以适当扩大结肠癌的适用范围,使更多的病人获得更好的预后。
