尿外泌体miR-29c对器官和非器官局限性膀胱尿路上皮癌临床结局的预测价值
2024-03-14王志刚董青川孙羿段万里管振锋潘亮
王志刚 董青川 孙羿 段万里 管振锋 潘亮

对象与方法
一、对象
2017年1月~2017年5月,我院泌尿外科招募了12例BUC病人(器官局限性和非器官局限性疾病各6例)和4例非癌志愿者,作为发现适合生物标志物的miRNA的发现集。2017年1月~2022年3月,进一步从我院泌尿外科招募BUC病人作为验证集。纳入标准:(1)首次诊治;(2)由两名病理学家根据美国癌症联合委员会(AJCC)癌症分期手册第8版对活检组织进行审查[6];(3)接受根治性膀胱切除手术;(4)诊断前未接受过任何抗癌治疗。排除任何其他活动性恶性肿瘤、接受非根治性手术或姑息治疗的BUC病人或者近3个月合并其他严重基础疾病、活动性感染或炎症者。获得书面知情同意。共采集了152例BUC病人诊断时的尿液样本作为验证集样本,男性121例,女性31例,年龄37~94岁,平均年龄(68.47±10.22)岁,非器官局限性疾病57例,器官局限性疾病95例。器官局限性疾病为临床诊断T分期在Tis-T2,且无淋巴结转移(N0)/远处转移(M0);非器官局限性疾病为手术时分期≥pT3(pT3~T4N0M0)或病理性淋巴结转移(pTxN+M0)或远处转移性疾病(TxNxM1)[3,7-8]。从我院体检中心选择了126例非癌对照,男性111例,女性15例,年龄37~94岁,平均年龄(67.37±12.03)岁,年龄和性别与BUC病人相匹配(P>0.05)。本研究经我院伦理委员会批准。
二、方法
1.尿外泌体提纯及鉴定: 收集的尿液样品以高速和超高速离心分离外泌体。用JEOL 1011 CX-T透射电子显微镜(TEM)、NanoSight NS300纳米颗粒追踪分析仪(NTA)和蛋白免疫印迹[兔抗CD9,兔抗钙连蛋白(Calnexin),兔抗肿瘤易感基因101(TSG101),英国Abcam]进行外泌体表征分析。
2.发现集尿样外泌体miRNA高通量测序及分析:使用Illumina的NEB Next Multiplex Small RNA Library Prep Set生成测序文库。将适配器连接的RNA与ProtoScript Ⅱ逆转录酶、RNase抑制剂、第一链合成反应缓冲液混合,50 ℃孵育60分钟。在Illumina Hiseq X ten平台上对文库进行测序。
3.尿外泌体miR-29c水平验证 使用Trizol试剂分离外泌体总mRNA。PrimeScript miRNA cDNA合成试剂盒对miRNA逆转录合成后,使用SYBR Premix Ex Taq Ⅱ进行实时荧光定量PCR(RT-qPCR)。用2-ΔΔCT法将miR-29c标准化为对照cel-miR-39或内源性对照U6 snRNA中的峰值。
4.随访:包括体格检查、尿液细胞学检查、血液分析、胸腹部计算机断层扫描和膀胱镜检查。肿瘤复发:放射影像学检查中局部区域复发或远处转移的发生。无病生存(DFS)期从手术日期计算到肿瘤复发或最后一次随访。总生存(OS)期依据手术日期到死亡日期确定,或在最后一次随访日期进行审查。疾病特异性生存(DSS)期从手术之日起计算至疾病死亡或最后一次随访。
三、统计学处理
采用SPSS26.0软件处理数据,二分类变量以率(频率)表示和χ2检验。偏态分布数据以中位数(四分位值[IQR])表示和Mann-Whitney U检验。采用受试者工作特征(ROC)曲线评估尿外泌体miR-29c对于BUC的临床诊断。用Kaplan-Meier生存曲线分析尿外泌体miR-29c与BUC病人临床结局的关系。P<0.05为差异有统计学意义。
结果
1.尿外泌体鉴定 :尿外泌体表征为直径50~200 nm椭圆形或碗状的双层膜囊泡,没有细胞核(图1A,B),其存在外泌体特征蛋白CD9和TSG101;相反,外泌体阴性标记Calnexin表达缺失(图1C)。
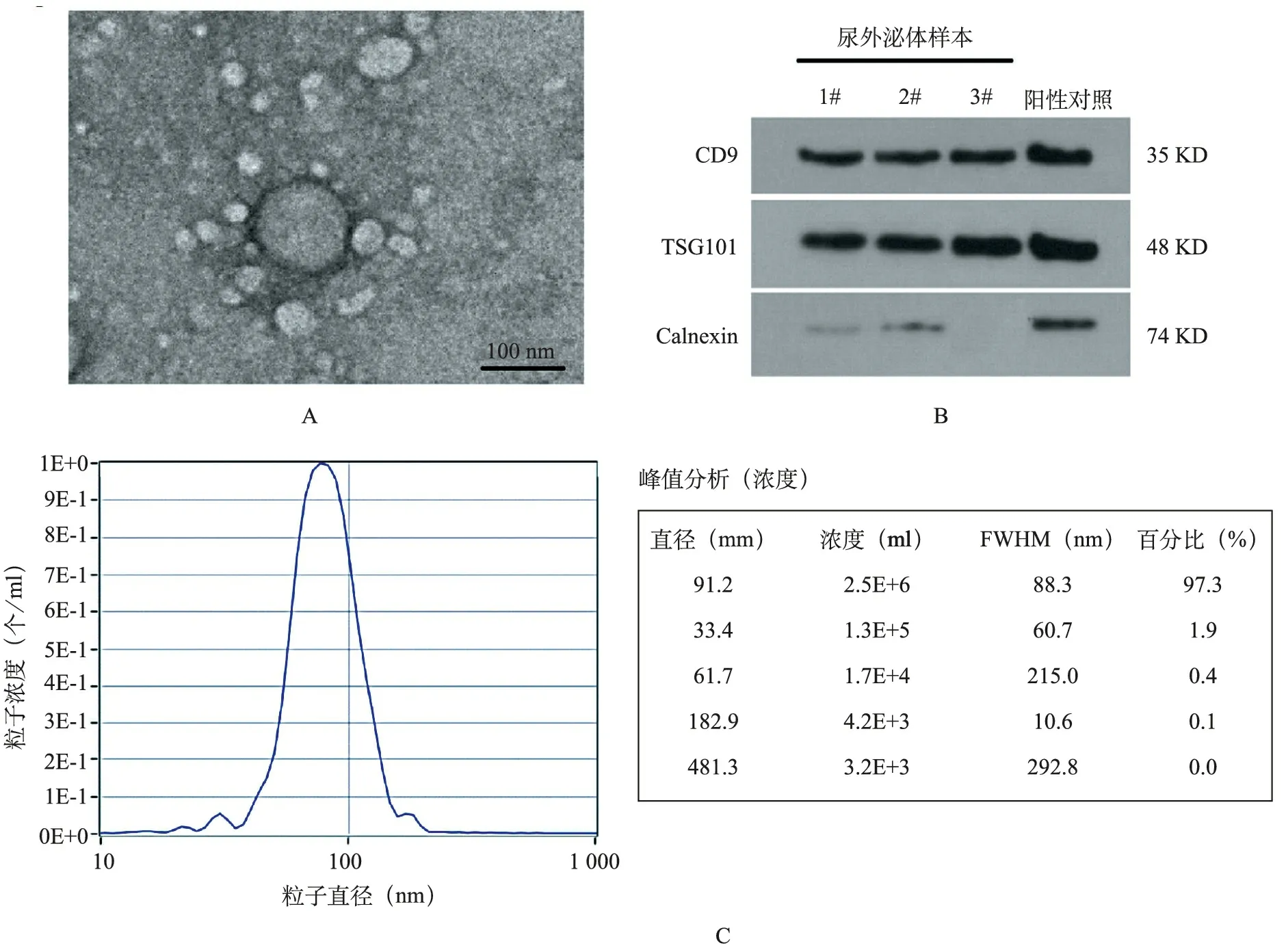
A示TEM图像;B示蛋白免疫印迹检测;C示NTA结果表明,从尿液中富集的外泌体约为50~200 nm
2.高通量测序分析尿外泌体miRNA表达谱: 在发现集样本中,与非癌对照组相比,在BUC病人的尿液外泌体中发现17个miRNA上调,22个miRNA下调。热图显示了尿外泌体miRNA的显著不同的分布(图2A)。在TCGA数据集中也进行了DEMs分析,发现与邻近正常组织相比,BC组织中有106个miRNA上调,26个miRNA下调。交叉分析和Venn图显示,这2种分析之间共有3种DEMs,且都是上调(图2B),包括miR-29c、miR-17-5p、miR-590-5p。
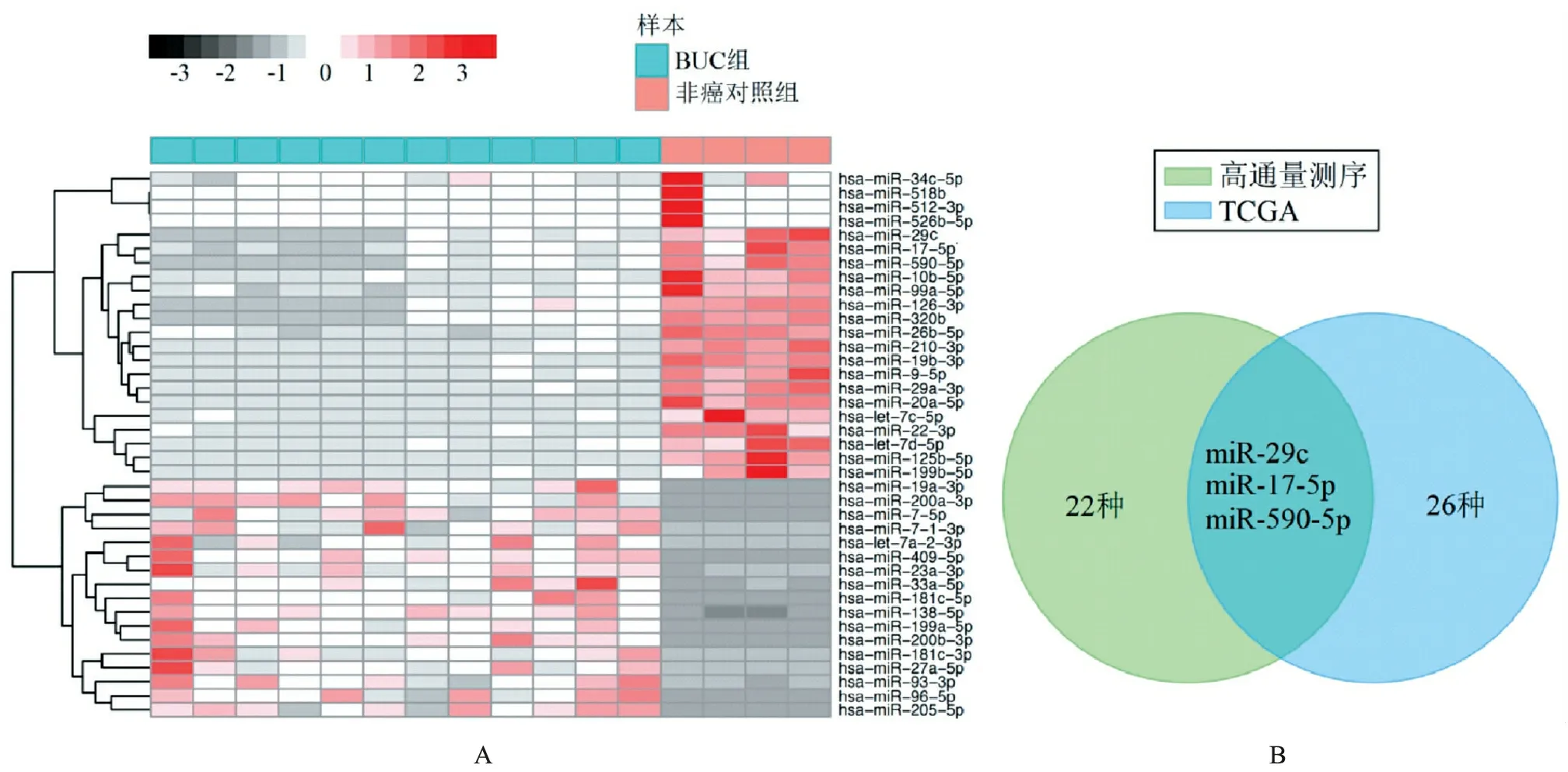
(A)差异表达尿外泌体衍生生miRNA的热图(BUC vs.非癌对照);(B)Venn图显示了TCGA数据库的差异miRNA表达谱和高通量测序技术之间的下调miRNA
3.尿外泌体miRNAs结果验证: 在验证集中,152份尿外泌体中miR-29c水平低于非癌对照组[0.30(0.17,0.46) VS 1.04(0.74,1.37),Z=-13.475,P<0.001]。然而,在BUC和非癌对照组之间,尿外泌体miR-17-5p水平[0.91(0.57,1.80) VS 0.99(0.65,1.72),Z=-0.911,P=0.204]和miR-590-5p水平[1.07(0.70,1.85) VS 1.12(0.65,2.03),Z=-0.894,P=0.317]没有显著差异。进一步分析,尿外泌体miR-29c用于诊断BUC的AUC值为0.969(95%CI:0.953~0.986)(图3)。相应的敏感性和特异性分别为92.1%和90.2%。与尿细胞学(敏感性:25.9%,特异性:100.0%)相比,尿外泌体miR-29c的敏感性更高(P<0.001)。
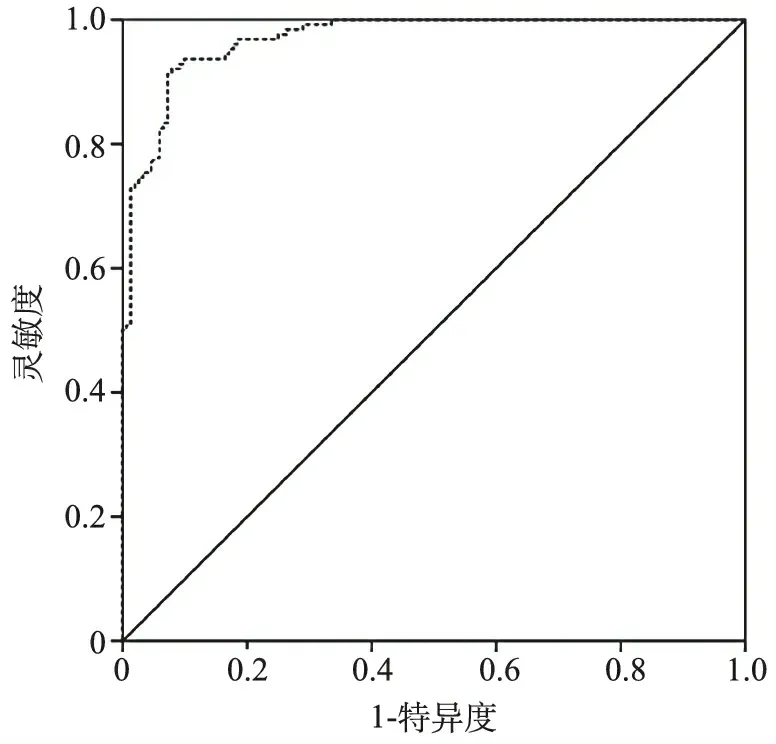
图3 尿外泌体miR-29c水平对BUC的诊断价值
4.亚型分析 :非器官局限性BUC病人尿外泌体miR-29c水平较器官局限性BUC病人进一步降低[0.24(0.08,0.41)vs.0.35(0.23,0.52),Z=-2.517,P=0.009]。
5.Kaplan-Meier生存分析:最短随访1.0个月,最长随访78.5个月,中位随访17.75个月。无论是在器官局限性BUC病人中,还是在非器官局限性BUC病人中,尿外泌体miR-29c高表达组病人OS期、DFS期和DSS期均更长(P<0.05,表1,图4和图5)。
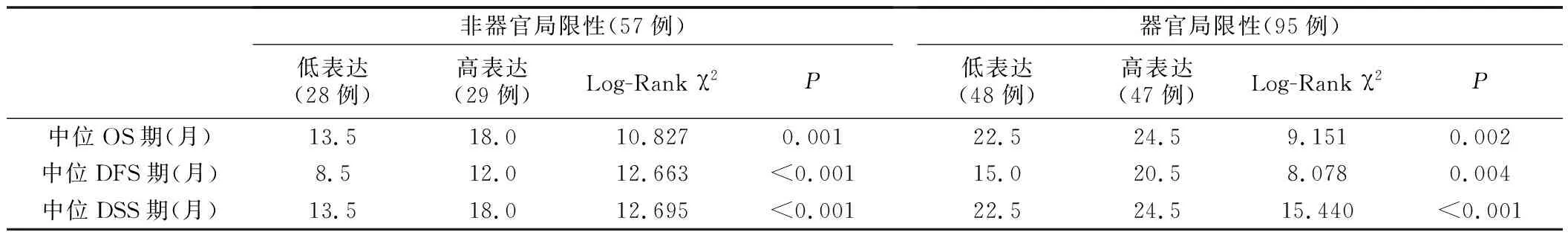
表1 尿外泌体miR-29c水平与BUC病人生存预后的关系
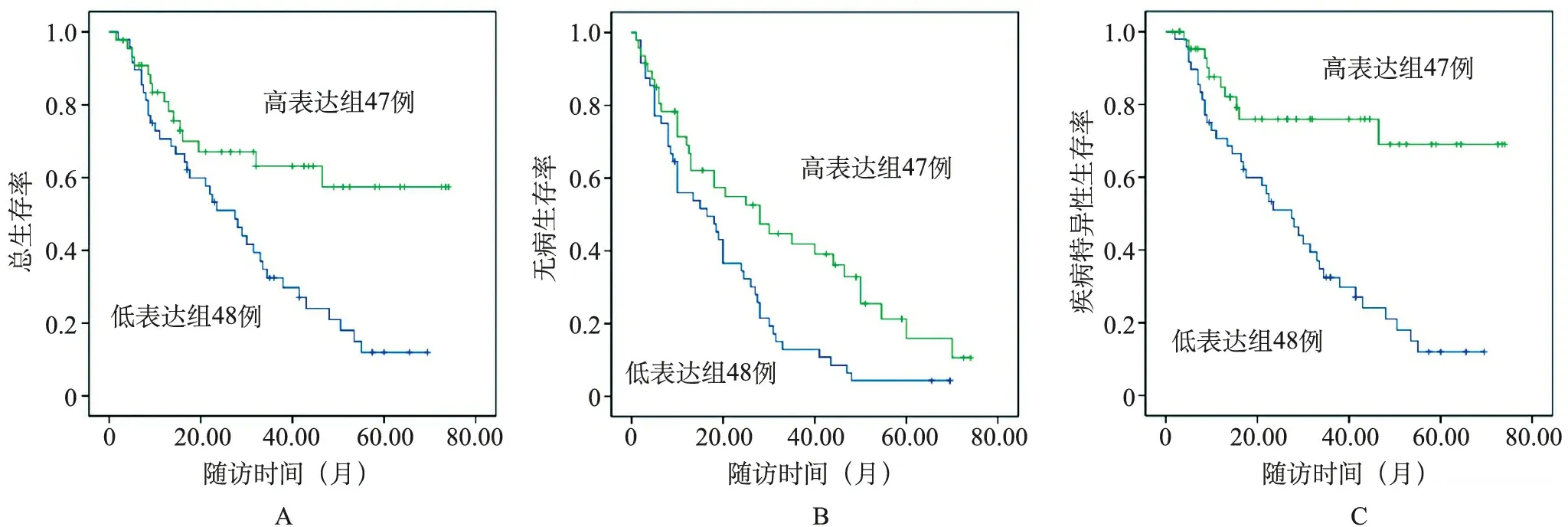
图4 器官局限性病人Kaplan-Meier曲线
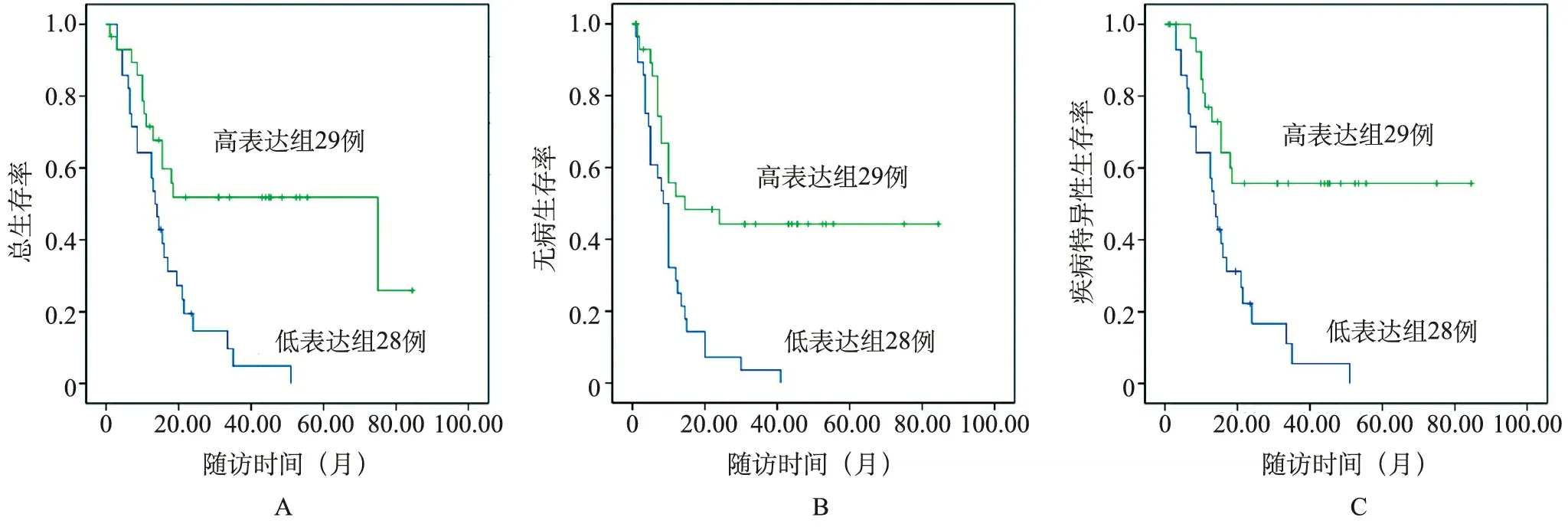
图5 非器官局限性病人Kaplan-Meier曲线
讨论
BUC是一种异质性疾病,具有多变的自然病史[9]。由于缺乏准确的分期工具,肌层浸润性膀胱癌的管理一直受到影响[7]。本研究结果发现,术前尿外泌体miR-29c低表达水平与更差的肿瘤学结局有关,有希望作为预测RC后器官和非器官局限性BUC病人的不良临床结局的生物标志物。尿外泌体miR-29c水平可能有助于促进病人围手术期化疗和切除范围的临床决策。
与血液等其他临床样本相比,尿液在临床应用中具有独特的优势:非侵入性获取且易于获取,miRNA在尿液来源的外泌体中更加丰富和稳定[4]。本研究通过高通量测序结合RT-qPCR检测,对BUC病人和非癌对照的尿外泌体衍生miRNA谱进行分析,结果显示,BUC组病人尿外泌体miR-29c水平较非癌对照组显著且稳定降低。ROC分析表明,尿外泌体miR-29c在BUC诊断中具有较高的AUC值,而且非器官局限性BUC病人尿外泌体miR-29c水平较器官局限性BUC病人进一步降低。这些结果说明,miR-29c低表达可能预示着疾病进展。在预后分析中,无论是器官局限性BUC病人还是在非器官局限性BUC病人,尿外泌体miR-29c高表达组病人OS期、DFS期和DSS期均更长,表明miR-29c是BUC病人预后的有利因素。
miR-29c为癌症抑制基因,可以抑制膀胱癌细胞增殖、迁移和侵袭,其表达下调与肿瘤转移有关[10-13]。miR-29c可通过靶向血管内皮生长因子抑制上皮-间充质转化,抑制胃癌细胞的增殖、侵袭和转移[12]。Yu等[13]研究表明,miR-29c通过调节靶基因CAPN7的表达影响UC细胞的迁移和侵袭。Guo等[14]研究发现,通过抑制miR-29c可上调TUG1从而促进膀胱癌细胞的增殖、迁移和侵袭。这些研究均提示miR-29c水平降低可能促进肿瘤细胞增殖、侵袭和转移,导致癌症相关死亡率增加。
总之,本研究结果提供了尿外泌体miR-29c在BUC诊断以及器官局限性和非器官局限性BUC中重要预后生物标志物的证据。术前检测尿外泌体miR-29c可能有助于改善BUC病人的风险分层,并促进临床决策。尿外泌体miR-29c高水平是BUC病人有利的预后因子,对于考虑BUC临床风险分层有一定指导意义。
