青蒿素类化合物抗肿瘤作用机制研究进展
2024-03-14盛思晗沈征武1上海交通大学医学院上海0005上海中医药大学中药学院上海0103
盛思晗,沈征武1,*(1.上海交通大学医学院,上海 0005;.上海中医药大学中药学院,上海 0103)
青蒿素(artemisinin,见图1)是20世纪70年代从传统中药菊科植物黄花蒿中分离提取的一种含有过氧桥结构的倍半萜内酯化合物,具有强大的抗疟活性[1]。近年来,有大量研究报道了青蒿素及其衍生物在抗肿瘤方面的作用[2-4]。青蒿素类衍生物包括双氢青蒿素、蒿甲醚及青蒿琥酯(见图1)。目前临床上主要使用的是蒿甲醚和青蒿琥酯。一项英国的随机双盲临床试验显示,口服青蒿琥酯片可降低结直肠癌的复发率,并且具有良好的耐受性[5]。对于垂体腺瘤患者,口服蒿甲醚12个月后,CT扫描显示其肿瘤密度降低,相关症状和体征明显缓解[6]。研究表明青蒿素及其衍生物具有开发为新型抗肿瘤药物的潜力。
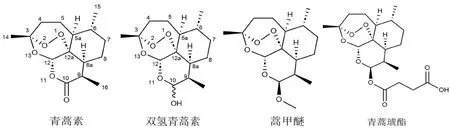
图1 青蒿素及其常见衍生物的结构Fig 1 Chemical structure of artemisinin and its common derivatives
然而,青蒿素及其衍生物的抗肿瘤机制尚未完全阐明,许多关键问题仍然存在争议。首先,青蒿素对肿瘤细胞特有的细胞毒性尚未被完全了解,这种特异性可能源于肿瘤细胞比正常细胞有更高的血红素合成能力[7]。其次,青蒿素类衍生物作用的靶标和具体作用机制尚不明确,青蒿素可以作用于多种关键的生物途径,导致肿瘤细胞死亡,其中较为关键的信号通路包括P38-MAPK信号通路、PI3K/Akt信号通路、Ras信号通路、NF-κB信号通路和Wnt/β-catenin信号通路[8-9]。鉴于青蒿素类衍生物的多重靶向性,可以通过高通量的研究方法对其作用机制进行系统性探索。
1 青蒿素及其衍生物的抗肿瘤作用机制
1.1 青蒿素及其衍生物的激活
青蒿素过氧桥被激活后断裂,产生大量的自由基,参与蛋白质的烷基化[10]。过氧桥结构对抗疟和抗肿瘤作用至关重要。然而,激活过氧桥的确切机制仍存在争议,游离亚铁与血红素都被认为是过氧桥的激活剂。肿瘤细胞表达高浓度的细胞表面转铁蛋白受体,通过内吞作用促进血浆铁转运蛋白的摄取。青蒿素可通过与转铁蛋白共价标记被肿瘤细胞选择性地富集[11]。与正常细胞相比,肿瘤细胞具有更高的细胞铁含量,这为青蒿素的抗肿瘤特异性提供了一个合理的解释,即肿瘤细胞的富铁环境导致青蒿素的活化增强[2]。Zhang等[12]发现添加亚铁血红素的合成前体可以增加青蒿素对细胞的毒性,加入亚铁血红素合成抑制剂(SA)则抑制青蒿素的细胞毒性。荧光探针检测结果显示,青蒿素治疗后的活性氧生成与血红素合成和细胞毒性成正相关。Stockwin等[13]发现添加血红素加氧酶可以抑制青蒿素二聚体的抗肿瘤活性。
蛋白质组学(proteomics)是系统生物学的重要组成部分,能快速准确地解释药物分子作用机制。Wang等[14]利用炔烃官能化的青蒿素探针AP1(见图2)与荧光染料偶联,监测其与疟原虫蛋白的结合。只有在添加血红素后,AP1探针才能与靶点蛋白结合,在血红素还原剂的存在下这种结合能力会进一步增强。Wang等[15]在肿瘤细胞中也发现类似的激活机制,青蒿琥酯对结直肠癌(CRC)细胞的特异性细胞毒性是由于肿瘤细胞中血红素合成能力的提高。添加血红素合成前体ALA(α-氨基乙酰丙酸)可以显著增加AP1对结直肠癌细胞的毒性以及与癌蛋白的结合,进而抑制肿瘤生长。Zhou等[16]使用青蒿素探针ART-yne(见图2)对HeLa细胞蛋白质组进行了研究,在氯化血红素的存在下,青蒿素探针通过共价修饰多种蛋白质,约80种蛋白质被富集并鉴定为青蒿素烷基化靶标。Zhang等[17]通过化学蛋白质组学方法研究了青蒿素在肿瘤细胞中的作用机制,基于游离血红素是青蒿素类化合物的激活剂,他们设计并合成了青蒿素衍生物ART-TPP(见图2),以点击化学发光法证明炔基化的青蒿素探针ART-TPP-AlK(见图2)中的TPP基团可以有效地将青蒿素导入线粒体。与青蒿素相比,ART-TPP对肿瘤细胞具有更强的抑制作用。以上结果表明,血红素在青蒿素活化中起主要作用,而不是游离亚铁离子。这可能是青蒿素类衍生物抗肿瘤作用的分子机制之一。

图2 青蒿素探针Fig 2 Artemisinin probes
青蒿素被激活后产生活性氧自由基(ROS),其包括羟基、超氧物和过氧化氢[18],ROS可以诱导细胞膜、DNA、蛋白质和细胞器的损伤,在细胞自噬、凋亡和周期阻滞中起重要作用[19-20]。与正常细胞相比,肿瘤细胞抗氧化酶的表达水平比正常细胞低,因此对ROS损伤更为敏感。由此推测青蒿素的抗肿瘤作用可能依赖于ROS的产生[21]。Mercer等[22]发现,用青蒿琥酯处理HeLa细胞16 h后,细胞中ROS水平增加,48 h后细胞毒性作用才出现,该实验表明ROS损伤是青蒿琥酯对抗肿瘤作用的起点。Greenshields等[23]发现青蒿琥酯处理的卵巢癌细胞表现出强烈的ROS诱导和细胞增殖周期阻滞。其中ROS依赖性细胞增殖周期阻滞于G2/M期,而非ROS依赖性细胞周期阻滞于G1期。不同的细胞周期阻滞取决于卵巢癌细胞暴露的青蒿琥酯浓度。Wang等[24]发现,双氢青蒿素可以通过诱导ROS的产生,使K562细胞内线粒体功能紊乱并引发细胞自噬。然而Lu 等[25]的研究表明双氢青蒿素诱导 HL-60 细胞线粒体损伤和细胞凋亡是通过激活p38 MAPK信号通路,而与 ROS 无关,因为细胞内 ROS 的含量没有变化,并且双氢青蒿素在不同细胞内不一定都能产生 ROS,可能与细胞的不同生物学背景有关,青蒿素及其衍生物的活性氧机制仍在研究中。
1.2 诱导肿瘤细胞周期阻滞
细胞周期紊乱和失控性生长几乎是所有肿瘤的共同特征[26]。青蒿素及其衍生物能够调控细胞周期相关基因的表达,阻断细胞周期进程,从而发挥抗肿瘤作用。Mondal等[27]研究发现,青蒿素可诱导宫颈癌细胞发生G0/G1期细胞周期阻滞,并推测这可能是通过下调G0/G1期细胞周期蛋白Cyclin D1和CDK4的表达,上调周期蛋白p21Waf1/Cip1的表达,从而影响细胞有丝分裂,抑制肿瘤细胞的增殖。双氢青蒿素在体内外显著抑制HCT116、DLD1和RKO细胞的增殖,全基因组RNA-seq分析发现双氢青蒿素诱导的差异表达基因主要富集在细胞周期途径中,包括CDK1、CCNB1和PLK1。分子对接结果表明双氢青蒿素与CDK1/CCNB1复合物之间存在较强的结合[28]。青蒿琥酯可以通过下调CDK2、CDK4、Cyclin D1、Cyclin B1的表达,将胶质母细胞瘤细胞系A172、U87、U251的细胞周期阻滞在G0/G1期[29]。青蒿琥酯剂量依赖性地抑制BRL-3A和AML12小鼠肝细胞的增殖,使得其细胞增殖周期阻滞于G0/G1期。Western blot结果显示青蒿琥酯可诱导CDK2、CDK4、Cyclin D1和Cyclin E1显著下调[30]。上述研究显示,青蒿素类衍生物在不同的肿瘤细胞系中可以导致细胞周期阻滞发生在G0/G1或G2/M期,具体取决于细胞系的差异。
1.3 诱导肿瘤细胞凋亡
细胞凋亡是由基因控制的细胞自主有序的死亡过程,旨在维持内环境稳定。青蒿素类衍生物主要通过线粒体途径诱导细胞凋亡,其敏感性与肿瘤细胞中抗凋亡基因和促凋亡基因的表达水平相关。大量研究已经报道,青蒿素类衍生物在多种肿瘤细胞中具有显著的凋亡诱导作用。Jamalzadeh等[31]发现经青蒿琥酯处理的乳腺癌细胞中,caspase-8、caspase-9、caspase-3的水平显著升高,表明青蒿琥酯通过内源性和外源性半胱氨酸蛋白酶依赖途径诱导细胞凋亡,从而抑制乳腺癌MCF-7细胞的生长。另外,Xiao等[32]的研究发现,在A-253细胞中,青蒿素上调了Bax、Bim、Bad、Bak蛋白的表达,下调抗凋亡蛋白Bcl-2、Bcl-XL的表达,并释放了细胞色素C进入细胞质。此外,青蒿素还可以增加ROS的生成,进一步激活促凋亡蛋白PARP1和caspase-3,从而引发细胞凋亡。双氢青蒿素对Jurkat淋巴瘤细胞具有明显的增殖抑制作用,细胞凋亡率与药物浓度成正相关。Western blot分析结果显示,凋亡相关基因p53、c-caspase3、Bax和cPARP的蛋白表达显著增加,Bcl-2蛋白表达则降低[33]。青蒿素衍生物诱导肿瘤细胞发生凋亡可能是其有效的作用机制之一。
1.4 诱导肿瘤细胞自噬
自噬是细胞为清除功能失调的细胞器或错误折叠的蛋白质而进行的进化保守过程[34]。自噬通过清除受损细胞和细胞器,发挥机体对肿瘤细胞的抑制作用,从而限制细胞增殖。在恶性肿瘤发生的早期阶段,自噬发挥抑制肿瘤的作用。Li等[35]的研究发现,在上皮性卵巢癌中,青蒿素可通过诱导自噬来干预细胞周期相关的NF-κB信号通路,使肿瘤细胞周期停滞于G2/M期,从而抑制其生长。双氢青蒿素可促进人舌鳞肿瘤细胞发生自噬,经双氢青蒿素处理后的肿瘤细胞中,自噬体形成标志蛋白(LC3-Ⅲ)和自噬起始因子(Beclin-1)的表达明显增加[36]。经青蒿琥酯处理的恶性淋巴瘤细胞中,可以观察到自噬小体出现,并且自噬相关蛋白Beclin-1及LC3-Ⅰ/Ⅱ的表达也增加[37]。PI3K/AKT/mTOR信号通路是自噬的经典负调控途径,双氢青蒿素通过抑制PI3K/AKT/mTOR信号通路,来促进SMMC-7721细胞自噬,并抑制人肝癌SMMC-7721细胞的增殖[38]。青蒿素类衍生物能诱导多种肿瘤细胞发生自噬性细胞死亡,如脑胶质瘤细胞和结肠癌细胞等[39-40]。
1.5 抑制肿瘤血管生成
血管生成在肿瘤的生长和转移中起重要作用。青蒿素类衍生物能够通过调节不同癌细胞株的血管内皮生长因子(VEGF)来抑制血管生成。在血管生成调节因子中,VEGF及其受体(VEGFR2和VEGFR1)都是生理和病理条件下最有效的血管生成刺激因子。Verma等[41]通过动物模型实验证明,青蒿琥酯能下调β-连环蛋白(β-catenin)信号传导,降低VEGF及基质金属蛋白酶-9(MMP-9)等血管生成标志物的水平,抑制血管生成,发挥抗肿瘤作用。双氢青蒿素通过上调ETS-1转录因子抑制VEGFR1介导的促血管生成反应,诱导VEGFR1的表达[42]。因此,青蒿素类衍生物通过抑制血管生成相关基因的表达,进而抑制肿瘤细胞的促血管生成作用。因此,青蒿素类衍生物通过抑制血管生成相关基因的表达,进而抑制肿瘤细胞的促血管生成作用。
1.6 降低肿瘤细胞耐药性
肿瘤化疗受到药物毒性和肿瘤耐药性的限制,其中多药耐药(multidrug resistance,MDR)最为常见。MDR表现为细胞内游离的细胞毒性药物浓度较低,这通常与蛋白膜转运蛋白有关,如P-糖蛋白(ABCB1/MDR1/P-gp)、多药耐药相关蛋白(MRPs)、乳腺癌耐药蛋白(BCRP/ABCG2)和肺耐药蛋白等,它们通过三磷酸腺苷(ATP)将药物排出细胞外,从而降低药物功效[43]。青蒿素与传统的抗肿瘤药物作用机制不同,不会出现交叉耐药,并且可逆转肿瘤细胞的多重耐药。Zhang等[44]研究发现,双氢青蒿素可以抑制肿瘤细胞中P-糖蛋白的表达,增强肿瘤细胞对顺铂的敏感性。青蒿素类衍生物还可以增加多药耐药的肿瘤细胞中吡柔比星和阿霉素的细胞毒性[45]。食管癌组织中ABCG2的异常高表达与食管癌的多药耐药有关。研究显示青蒿琥酯可以调节肿瘤细胞中ABCG2的表达,逆转食管癌的耐药性[46]。青蒿素衍生物还可抑制转运蛋白的表达,当与其他化疗药物联合使用时,可增加细胞内药物的浓度,从而在一定程度上缓解肿瘤细胞对化疗药物的耐药性。青蒿素类衍生物显示出降低肿瘤细胞耐药性的潜力,可通过抑制耐药相关蛋白的表达,增强化疗药物的疗效,有可能为肿瘤治疗提供新的策略和途径。
1.7 免疫调节作用
肿瘤免疫治疗旨在激发或调动机体的免疫系统,增强肿瘤微环境中免疫细胞对肿瘤的活性,以控制和杀伤肿瘤细胞。然而,近年来部分肿瘤免疫治疗的效果并不理想,其中一部分原因是机体未能产生免疫应答或免疫抑制[47]。有研究表明,青蒿素在不同的疾病模型可能具有双向调节免疫系统的作用[48]。青蒿素通过促进T细胞活化和抑制肿瘤中调节性T细胞(Tregs)及髓系抑制细胞(MDSCs)的免疫抑制来抑制4T1肿瘤细胞在体内的生长[49]。适当浓度的双氢青蒿素有助于T细胞的增殖,增强T细胞介导的对胰腺癌细胞的杀伤活性,其机制可能是通过增加细胞内穿孔素、颗粒酶B和IFN-γ的分泌来提高T细胞的抗肿瘤活性[50]。双氢青蒿素-熊去氧胆酸偶联物可以抑制多种肿瘤细胞的增殖,并且在裸鼠的A549异种移植瘤和小鼠的Lewis肺癌模型中也显示出体内抗肿瘤活性[51]。进一步的研究表明该化合物可以抑制PI3K/Akt、NF-κB和MAPK信号通路,进而抑制T细胞的增殖与激活,抑制IFN-γ的产生,表现出强烈的免疫抑制活性,因而具有治疗自身免疫性疾病的潜力[52]。由于PI3K/Akt、NF-κB和MAPK信号通路不仅与细胞免疫相关,也与肿瘤的发生和发展密切相关。因此,青蒿素类化合物有可能是与上述信号通路共同的调节因子结合,而表现出肿瘤抑制和免疫抑制的双重活性。同样,青蒿琥酯可抑制NF-κB、PI3K/Akt、JAK/STAT和MAPK通路,具有治疗类风湿关节炎、系统性红斑狼疮和溃疡性结肠炎等自身免疫性疾病的潜力[53]。双氢青蒿素对系统性红斑狼疮小鼠的Treg/Th17具有免疫调节作用,通过恢复Treg/Th17平衡来减轻系统性红斑狼疮症状[54]。因此,通过对青蒿素作用机制的深入研究,有可能开发出治疗肿瘤及自身免疫性疾病的新型青蒿素类药物[55]。
2 总结
青蒿素类化合物在体内外抗肿瘤实验中,展现出高效和广谱的抗肿瘤效果。然而,关于青蒿素类化合物的抗肿瘤作用机制存在众多且复杂的观点,有些观点甚至相互矛盾。综合文献报道,青蒿素类化合物主要的抗肿瘤作用机制包括产生ROS损伤、阻滞肿瘤细胞周期、诱导细胞凋亡和抑制肿瘤细胞血管生成,从而减少肿瘤细胞的侵袭和转移。至于青蒿素类化合物究竟是以某种特定作用机制为主,还是通过多种作用机制共同发挥抗肿瘤作用,仍需进一步研究。与传统化疗药物相比,青蒿素类化合物具有降低肿瘤耐药性和调节肿瘤免疫的潜力,这可能成为未来研究的重点。然而,在临床实践中,青蒿素类化合物作为抗肿瘤药物的使用案例相对较少。此外,青蒿素类化合物产生抗肿瘤效应的靶蛋白尚未明确,通过结合化学生物学与蛋白质组学的研究,可以更好地了解青蒿素类化合物的细胞和分子机制,有可能发现青蒿素类化合物治疗肿瘤的真正作用靶点,这对于进一步开发青蒿素类抗肿瘤药物具有重要意义。
