pH值对氟马西尼注射液质量的影响研究
2024-03-14郭丹峰金怡平肖利辉袁金桥嘉实湖南医药科技有限公司长沙410217
郭丹峰,金怡平,肖利辉,袁金桥(嘉实(湖南)医药科技有限公司,长沙 410217)
氟马西尼作为一种苯二氮䓬类药物的拮抗剂,可与苯二氮䓬受体特异性结合,减少γ-氨基丁酸的释放[1],临床主要用于逆转苯二氮䓬类药物所致的中枢镇静作用[2],如终止用苯二氮䓬类药物诱导及维持的全身麻醉。根据其特定的临床用途以及肝脏首过效应的影响[3],目前国内外上市的剂型均为注射液[4]。氟马西尼是一种酯类化合物,易水解生成杂质A,如图1所示,可能导致氟马西尼注射液的性状、溶液澄清度与颜色、可见异物、不溶性微粒和含量在贮藏期间发生改变,影响药品的安全性和有效性。pH值作为影响杂质A降解速度的关键因素之一,暂无文献报告其对氟马西尼注射液质量稳定性的影响。本文参考国内外药典规定的pH值范围,按照参比制剂的处方制备不同pH值的氟马西尼注射液,考察自制氟马西尼注射液与参比制剂质量的稳定性,为制剂工艺中pH值的选择提供科学依据。
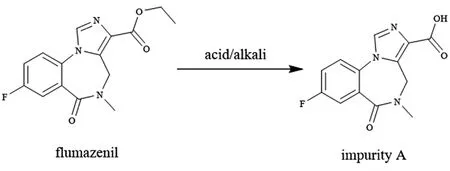
图1 氟马西尼的水解反应Fig 1 Hydrolysis reaction of flumazenil
1 仪器与试药
Agilent 1260型高效液相色谱仪(美国安捷伦公司);XS105DU型分析天平(精度:0.01 mg)、FE28型pH计(瑞士梅特勒托利多);FCD-2000型恒温鼓风干燥箱(上海琅玕实验设备有限公司);Milli-Q纯水仪(德国默克);YXQ-LS-50A型立式高压蒸汽灭菌器(上海博讯实业有限公司医疗设备厂);AGL-2型安瓿拉丝灌封机(长沙益广制药机械有限公司);SHH-12W-SD型稳定性试验箱(重庆康诚永生试验设备有限公司);YB-2型澄明度检测仪(天大天发科技有限公司);LE100型微粒检测仪(苏州苏净仪器自控设备有限公司)。
氟马西尼对照品(批号:100727-202003,纯度:99.9%,中国食品药品检定研究院);杂质A对照品(批号:190901,纯度:99.4%,自制);氟马西尼(原料药,批号:180101,湖南华纳大药厂手性药物有限公司);依地酸二钠(辅料级,批号:102320180301,湖南尔康制药股份有限公司);醋酸(辅料级,批号:20180403,台山市新宁制药有限公司);氯化钠(辅料级,批号:01170803,天津寿光药业股份有限公司),氢氧化钠(辅料级,批号:180901,四川金山制药有限公司),甲醇(色谱纯,Sigma,批号:WXBC3660V);水为超纯水;磷酸(分析纯,国药集团化学试剂有限公司,批号:20180315);四氢呋喃(色谱纯,Sigma,批号:WXBC6565V);氟马西尼参比制剂(批号:F4001F02,规格:5 mL/0.5 mg,Cheplapharm Arzneimittel GmbH)。
2 方法与结果
2.1 氟马西尼注射液的制备
取纯化水400 mL,水浴维持60~70℃,依次加入参比制剂处方量的氯化钠、依地酸二钠和冰醋酸,搅拌使溶解,再加入氟马西尼50 mg,搅拌使溶解,冷却,平行配制6份,用稀冰醋酸溶液或0.1%氢氧化钠溶液分别调节pH值为3.0、3.4、3.8、4.2、4.6和5.0,再分别用纯化水定容至500 mL,用0.22 μm滤膜过滤,照每支5 mL灌装,熔封,于121℃湿热灭菌15 min,放冷,即得。
2.2 有关物质和含量分析方法的验证
2.2.1 色谱条件 照《中国药典》2020年版二部氟马西尼注射液有关物质和含量测定方法的色谱条件[5],以十八烷基硅烷键合硅胶为填充剂[Waters Symmetry C18(4.6 mm×250 mm,5 μm)],以稀磷酸溶液(取水1000 mL,用磷酸调节pH至2.0)-甲醇-四氢呋喃(80∶13∶7)为流动相进行洗脱;流速为1.0 mL·min-1;检测波长为230 nm;柱温为30℃;进样量为20 μL。
2.2.2 专属性试验 取冰醋酸、依地酸二钠、氯化钠和氢氧化钠适量,用水溶解并稀释制成处方浓度的溶液,作为空白辅料溶液;以流动相作为空白溶液;取杂质A适量,加甲醇适量使溶解,再用水定量稀释制成每l mL中约含杂质A 0.5 μg的溶液,作为杂质A溶液;取氟马西尼注射液作为样品溶液。取各溶液进样,结果空白溶液和辅料不干扰主峰和杂质峰检测,样品溶液色谱图中无未知杂质,杂质A峰与主峰之间的分离度为22.2,主峰拖尾因子为1.1,说明本方法具有良好的专属性,典型图谱见图2。
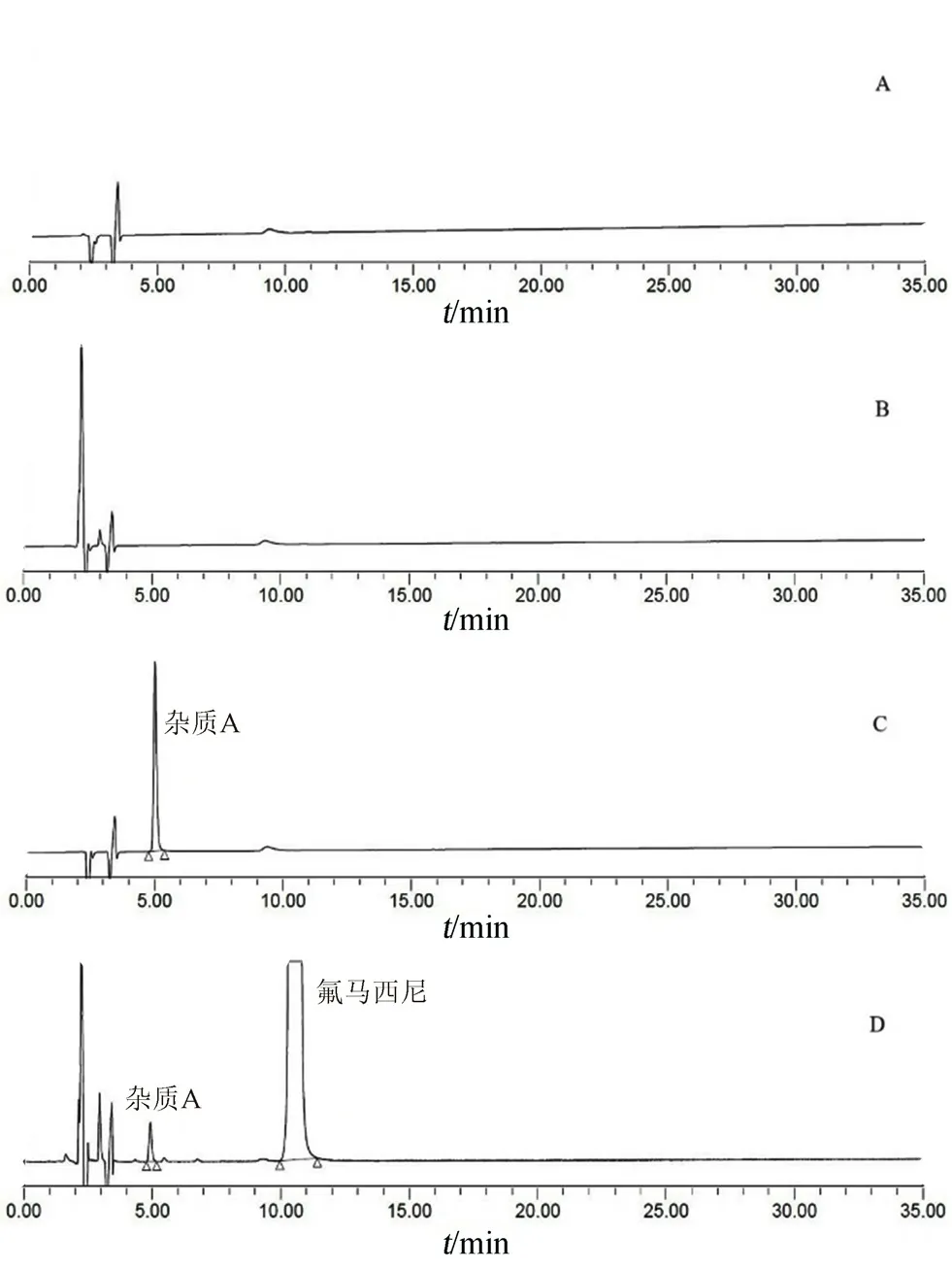
图2 氟马西尼注射液色谱图Fig 2 HPLC chromatogram of flumazenil injection
2.2.3 检测限和定量限 取杂质A对照品和氟马西尼对照品适量,精密称定,加甲醇适量使溶解,再用水稀释至信噪比等于3的溶液(即检测限溶液),信噪比等于10的溶液(即定量限溶液)。结果杂质A和氟马西尼检测限分别为0.001和0.002 μg·mL-1,定量限分别为0.003和0.006 μg·mL-1。杂质A和氟马西尼定量限浓度相当于样品溶液中主成分浓度的0.003%和0.006%,说明本方法具有较好的灵敏度。
2.2.4 线性关系考察 取杂质A对照品和氟马西尼对照品适量,精密称定,加甲醇适量使溶解,再用水稀释至含杂质A和氟马西尼0.05、0.2、0.8、1.0、1.2和1.5 μg·mL-1的溶液,作为线性溶液。杂质A浓度(X)与峰面积(Y)的线性方程为Y=7.758×104X-72,r=1.000;氟马西尼浓度(X)与峰面积(Y)的线性方程为Y=7.074×104X-51,r=1.000。根据标准曲线斜率比法测定杂质A的校正因子,所得校正因子在0.9~1.1,因此杂质A可按照不加校正因子的自身对照法计算[6]。
2.2.5 加样回收试验 取杂质A对照品适量,精密称定,加甲醇适量使溶解,按照50%、100%和150%的杂质限度浓度加入氟马西尼注射液(pH 3.8)中;另取氟马西尼对照品适量,精密称定,按照80%、100%和120%的理论浓度加入空白辅料溶液中,按外标法以峰面积计算杂质A和氟马西尼的回收率。结果低、中、高浓度水平杂质A的回收率在97.2%~101.2%,氟马西尼的回收率在100.3%~101.2%,RSD值均小于2.0%,说明本方法能准确检测氟马西尼注射液中杂质A和主药含量。
2.2.6 重复性试验 取氟马西尼注射液(pH 3.8)6支,精密量取样品溶液适量,加水定量稀释制成每l mL中约含氟马西尼1 μg的溶液,作为对照溶液,按不加校正因子的自身对照法计算重复性样品溶液中有关物质,按外标法计算主药含量。6份重复性样品溶液中杂质A平均含量为0.05%,RSD为0.83%;氟马西尼平均含量为100.9%,RSD为0.36%,说明本方法具有良好的重复性。
2.2.7 精密度试验 取氟马西尼注射液作为样品溶液,连续进样6次,氟马西尼主峰面积的RSD为0.26%,杂质A峰面积的RSD为0.92%,说明本方法具有良好的精密度。
2.3 pH值对氟马西尼注射液质量的影响
2.3.1 初始质量属性对比 取不同pH值的自制氟马西尼注射液与参比制剂,解析性状、溶液澄清度与颜色、可见异物、不溶性微粒、有关物质和含量等关键质量属性,结果见表1,所有样品的性状、溶液澄清度与颜色、可见异物、不溶性微粒和含量结果基本一致,符合国内外药典标准以及通则要求;有关物质除杂质A外,均未检出其他杂质。当pH值在3.4~4.6,自制氟马西尼注射液中杂质A含量相对较低,说明当pH值控制在上述范围时,氟马西尼注射液在生产过程中稳定性较好,不易降解。参比制剂中杂质A含量明显高于自制氟马西尼注射液,这可能与参比制剂所用原料药中杂质A含量较高以及参比制剂在贮藏期间降解有关。
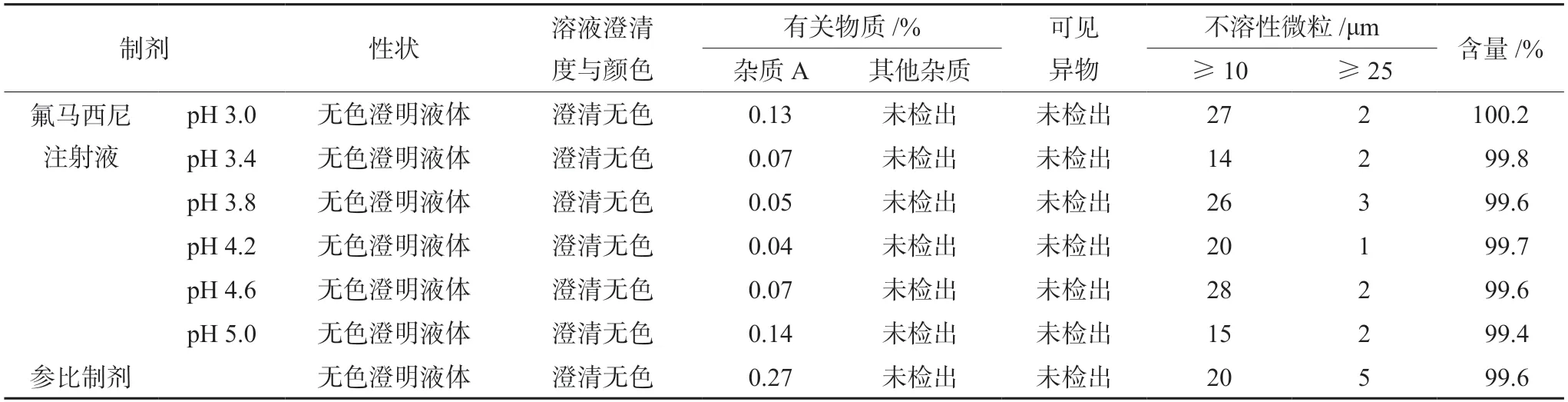
表1 不同pH的氟马西尼注射液和参比制剂检测结果Tab 1 Determination of flumazenil injections at different pH and reference preparations
2.3.2 pH值对氟马西尼注射液稳定性的影响 取不同pH值的氟马西尼注射液,与参比制剂同时置于长期(30℃,65% RH)和加速(40℃,75%RH)稳定性试验箱中,于1、3和6个月后分别取样,评估不同pH值的氟马西尼注射液与参比制剂的稳定性差异。所有样品的性状、溶液澄清度与颜色、可见异物、不溶性微粒在加速和长期稳定性试验条件下基本不变;有关物质除杂质A外,未检出其他杂质,杂质A检测结果见表2,氟马西尼含量测定结果见表3。不同pH的氟马西尼注射液中杂质A呈现不同幅度增长,当pH值在3.8~4.6内,自制氟马西尼注射液中杂质A在长期和加速稳定性试验条件下的增长速率与参比制剂相当。含量在长期试验条件下变化较小,受检测误差的影响,变化趋势不明显,在加速试验条件下总体呈现逐渐降低的趋势,但未发生显著变化。当pH为3.0时,加速3、6个月的氟马西尼注射液中杂质A含量已超出国内外药典限度,样品的性状、溶液澄清度与颜色、可见异物、不溶性微粒检测结果不变,说明氟马西尼降解不会导致本品的性状、溶液澄清度与颜色、可见异物、不溶性微粒在贮藏期间改变。
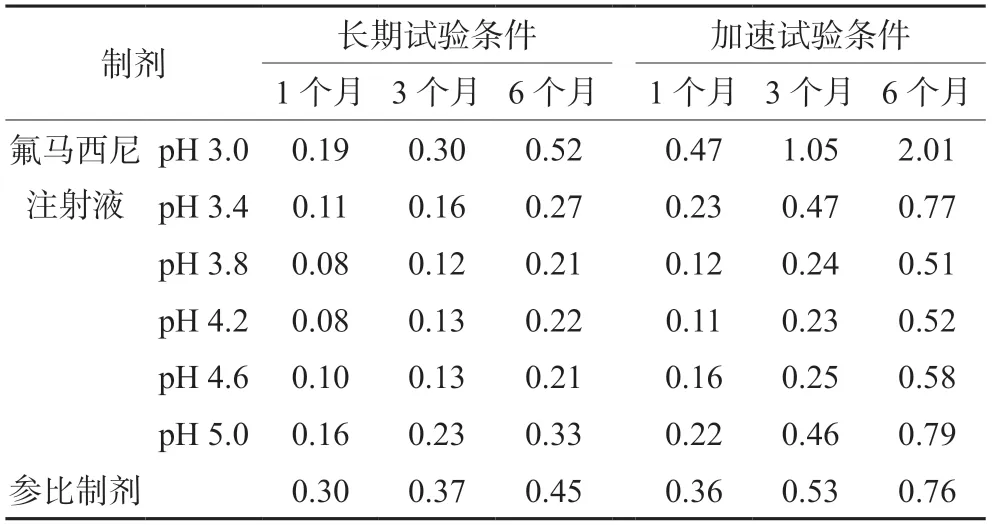
表2 杂质A的含量检测结果(%)Tab 2 Content of impurity A (%)
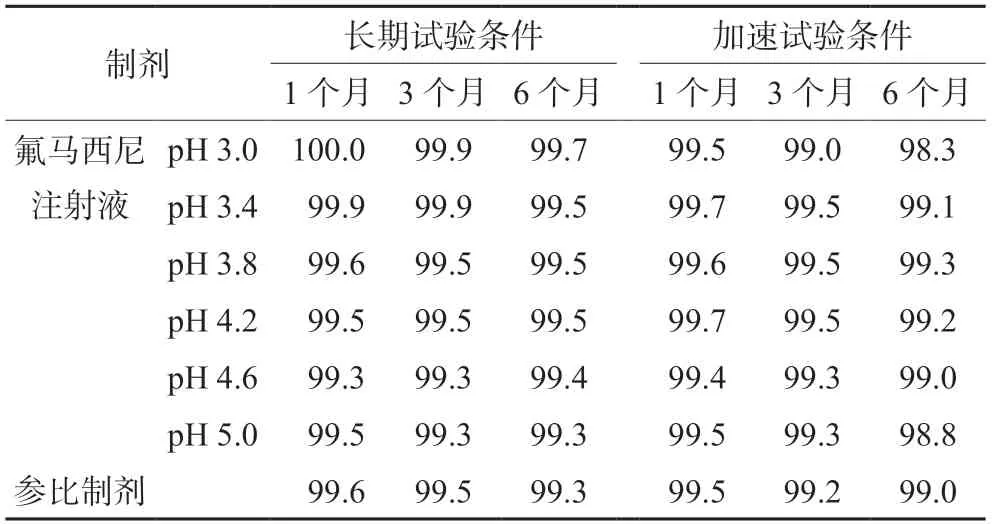
表3 氟马西尼注射液中氟马西尼的含量(%)Tab 3 Content of flumazenil in flumazenil injection (%)
3 讨论
3.1 有关物质检测方法
本文对《中国药典》2020年版二部氟马西尼注射液有关物质检测方法进行了验证,结果表明该方法具有较好的专属性、灵敏度、准确度、线性、重复性和精密度,能有效检测降解杂质A和其他杂质。氟马西尼注射液无需稀释直接注入色谱系统,辅料浓度较高,使用该方法检测有关物质时,应注意识别空白辅料峰。
3.2 氟马西尼注射液的制备方法
氟马西尼在冰醋酸中易溶,在水中几乎不溶,室温下氟马西尼溶解速率非常缓慢,升高温度氟马西尼溶解速率增加,但杂质A降解加剧。如何增加氟马西尼的溶解速率,提升配液效率,减少杂质降解是氟马西尼注射液配制时需要关注的重点。有专利报道了氟马西尼注射液的制备方法[7],专利处方与参比制剂基本一致,配液温度为室温。重现该专利方法配制氟马西尼注射液时,尽管有关物质未增长,但原料药完全溶解所需时间长达2 h,不利于工业化生产。本文介绍的氟马西尼注射液配制方法为充分评估氟马西尼溶解速率以及杂质增长后制订的,当配液温度为60~70℃,氟马西尼完全溶解所需时间缩短至30 min以内,杂质A增长可忽略不计,更适用于工业化生产。
3.3 pH值控制范围
在氟马西尼注射液的法定药品标准中,《中国药典》规定的pH值为3.5~4.2,《美国药典》规定的pH值是3.4~4.6。根据pH值对氟马西尼注射液稳定性影响的研究结果,当pH值控制在3.8~4.6时,氟马西尼注射液在生产和贮藏过程中稳定性好,与参比制剂的稳定性一致,说明《美国药典》制定的pH值范围上限更加合理。当pH等于3.4,杂质A增长速度显著加快,不利于本品在货架期内贮藏。为严格控制产品质量,提高产品的稳定性,生产过程中应将氟马西尼注射液的pH值控制在3.8~4.6。
