奥氮平对乳腺癌相关巨噬细胞增殖与分化功能的影响
2024-03-14孟娟李东辉高元慧刘梅李建旺海口市人民医院肿瘤内科泌尿外科中心实验室海口570208
孟娟,李东辉,高元慧,刘梅,李建旺(海口市人民医院,.肿瘤内科;2.泌尿外科;.中心实验室,海口 570208)
乳腺癌已成为全球女性发病率最高的肿瘤,严重威胁到女性的健康。乳腺癌的发生发展是多种因素共同作用产生的,除了生殖、遗传、饮食、生活方式及环境因素外,精神因素也是造成乳腺癌发病风险增加的重要因素[1]。奥氮平(OLZ)作为一种能拮抗5-羟色胺(5-HT)、多巴胺、胆碱能作用的精神类药物,不仅能稳定精神情绪,改善抑郁状态,提高睡眠质量,还具有良好的止吐作用[2-3]。作为止吐药物,奥氮平已成为美国国立综合癌症网络(NCCN)、欧洲肿瘤内科学会(ESMO)指南中预防高、中度致吐风险化疗药物的标准方案,在肿瘤对症治疗中广泛使用。然而奥氮平对于肿瘤的影响尚不明确,本研究通过奥氮平作用于体外乳腺癌细胞-巨噬细胞共培养体系,研究其对巨噬细胞增殖与分化的影响,探讨奥氮平在乳腺癌治疗中的作用。
1 材料与方法
1.1 细胞系、主要试剂及仪器
奥氮平(上海阿拉丁生化科技股份有限公司),佛波酯(PMA,Sigma,USA),DMEM基础培养基、胎牛血清(FBS)(Gibco,USA),Transwell培养板(Corning,USA),CCK-8(碧云天生物技术有限公司),动物组织/细胞总RNA提取试剂盒[天根生化科技(北京)有限公司],miRNeasy Mini Handbook(德国Qiagen),HiScriptⅡQ Select RT SuperMix for qPCR(+gDNA Wiper)试剂盒、miRNA 1st Strand cDNA Synthesis试剂盒(by stem-loop)、ChamQ Universal SYBR qPCR Master Mix、miRNA Universal SYBR qPCR Master Mix(诺唯赞),CO2恒温培养箱(上海一恒),酶标仪(Thermo,USA),荧光定量PCR仪(BioRad CFX96,USA)等。
1.2 细胞培养
THP-1细胞用完全培养基为含10% FBS的RPMI 1640培养,MDA-MB-231细胞用含10%FBS的DMEM培养。所有细胞置于37℃、5%CO2培养箱中培养,当MDA-MB-231细胞生长至融合时,先用pH 7.4 PBS缓冲液漂洗一次,然后用1 mL 0.25%胰酶消化细胞,待细胞开始变圆后,加入3 mL培养基终止胰酶的消化作用,吹吸细胞使其完全分散,再1∶3传代培养或调至所需细胞密度进行铺板。
1.3 CCK-8法检测共培养条件下THP-1的细胞增殖活性
将400 μL 1×105个·mL-1的密度的THP-1、MDA-MB-231细胞铺进24 Transwell培养板中,培养24 h后,分别加入2 μmol·L-1和100 μmol·L-1的奥氮平,继续培养48 h后每100 μL加入10 μLCCK-8试剂,继续培养2 h,酶标仪450 nm测定吸光度。
1.4 实时荧光定量PCR(qRT-PCR)检测巨噬细胞表面分子与相关炎症因子的表达
将400 μL 1×105个·mL-1的密度的细胞铺进24 Transwell培养板中,培养24 h后,分别加入50 μmol·L-1奥氮平和100 ng·mL-1佛波酯。不同按处理方式,分为PMA-T组:佛波酯处理的THP-1细胞;PMA-OLZ-T组:奥氮平和佛波酯共同处理的THP-1细胞;PMA-TM组:佛波酯处理的THP-1与MDA-MB-231共培养体系;PMA-OLZ-TM组:奥氮平和佛波酯共同处理的THP-1细胞与MDA-MB-231共培养体系。继续培养72 h后收集巨噬细胞,细胞总RNA提取使用动物组织/细胞总RNA提取试剂盒。以提取的总RNA为模板,使用HiScriptⅡQ Select RT SuperMix for qPCR(+gDNA Wiper)试剂盒进行反转录,使用ChamQ Universal SYBR qPCR Master Mix进行qRT-PCR实验检测各基因的表达。qRT-PCR扩增程序为:95℃ 预变性30 s,95℃ 变性5 s,60℃退火并延伸30 s,共40个循环,熔解曲线65℃ 5 s,95℃ 5 s,1个循环。利用2-ΔΔCt公式计算miRNA相对表达量。miRNA引物序列见表1。

表1 qRT-PCR检测miRNA表达用引物序列Tab 1 Primer sequences for qRT-PCR detection of miRNA expression
1.5 qRT-PCR检测巨噬细胞极化相关miRNA的表达
将400 μL 1×105个·mL-1的密度的THP-1、MDA-MB-231共培养细胞铺进24 Transwell培养板中,培养24 h后,分别加入50 μmol·L-1奥氮平和100 ng·mL-1佛波酯,继续培养72 h后收集细胞,细胞miRNA提取使用miRNeasy Mini Handbook。以提取的miRNA为模板,利用Stem-loop引物,使用miRNA 1st Strand cDNA Synthesis 试剂盒(by stem-loop)进行反转录,使用miRNA Universal SYBR qPCR Master Mix进行qRT-PCR实验检测各miRNA的表达。利用2-ΔΔCt公式计算miRNA相对表达量。实验所用miRNA的Stem-loop引物、上下游引物序列见表2。

表2 qRT-PCR检测miRNA表达用引物序列Tab 2 Primer sequences for qRT-PCR detection of miRNA expression
1.6 统计学分析
实验独立重复2次,结果用Graphpad Prism 10统计软件进行分析。符合正态分布的计量资料以±s表示,两组间比较采用t检验,以P<0.05表示差异具有统计学意义。
2 结果
2.1 奥氮平在体外抑制THP-1、MDA-MB-231共培养条件下THP-1细胞的增殖活性
经过不同浓度的奥氮平处理48 h后,CCK-8法检测THP-1单独培养组中及其与MDA-MB-231共培养组(Co-THP-1)中THP-1细胞的增殖活性,结果显示:2 μmol·L-1和100 μmol·L-1奥氮平对单独培养的THP-1细胞增殖均有明显抑制作用(P<0.05),100 μmol·L-1奥氮平对Co-THP-1也有一定程度的抑制作用(P<0.05)。两组THP-1(Co-THP-1)的细胞活性并无明显差异(P>0.05)(见图1)。
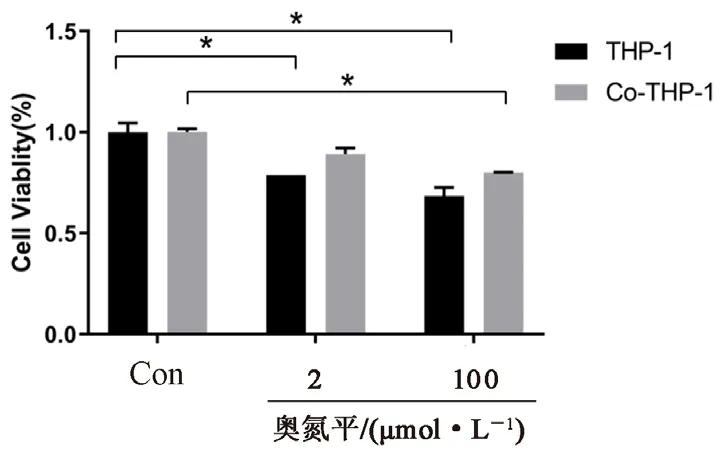
图1 不同浓度奥氮平对THP-1和Co-THP-1组中THP-1的增殖活性的影响(*P<0.05)Fig 1 Effect of different concentrations of olanzapine on activity of THP-1 in the THP-1-alone group and the co-culture group (*P<0.05)
2.2 奥氮平对巨噬细胞表面标志物表达的调节
与PMA-T组相比,PMA-OLZ-T组中THP-1细胞表面分子CD68显著增加(P<0.05);与PMA-T组相比,PMA-TM组中THP-1细胞表面分子CD68、CD80和CD163均无明显变化(P>0.05);而与PMA-TM组相比,PMA-OLZ-TM组中THP-1细胞中CD68、CD80、CD163的表达显著升高(P<0.05);与PMA-OLZ-T组相比,PMA-OLZ-TM组中THP-1细胞的CD68、CD80、CD163水平也均有不同程度升高(P<0.05)(见图2)。
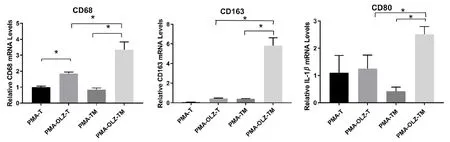
图2 qRT-PCR法检测各组中巨噬细胞表面分子CD68、CD80及CD163的表达(*P<0.05)Fig 2 Expression of THP-1 surface molecules CD68,CD80,and CD163 by qRT-PCR(*P<0.05)
2.3 奥氮平对巨噬细胞炎性因子和趋化因子表达的调控
与PMA-T组相比,PMA-OLZ-T组中THP-1的炎症因子IL-12显著增加(P<0.05),其余因子的变化并不明显;与PMA-T组相比,PMA-TM组中THP-1的炎症因子和趋化因子均无明显变化(P>0.05);与PMA-TM组相比,PMA-OLZ-TM组中THP-1的CCL2、CXCL10、IL-1β、IL-10、IL-6、IL-12、TNF-α表达水平显著升高(P<0.05);与PMA-OLZ-T组相比,PMA-OLZ-TM组中THP-1的CCL2、CXCL10、IL-1β、IL-10、TNF-α水平也均有不同程度升高(P<0.05)(见图3)。

图3 qRT-PCR法检测各组巨噬细胞炎性因子和趋化因子表达水平(*P<0.05)Fig 3 Expression of THP-1 surface molecules and inflammatory factors by qRT-PCR(*P<0.05)
2.4 奥氮平对巨噬细胞极化相关miRNA分子表达的调控
奥氮平处理THP-1细胞72 h的结果显示,THP-1组中,奥氮平仅对miR155和Let7c的表达有明显影响(P<0.05),对miR146、miR9和miR34a的影响并不明显。但在佛波酯诱导THP-1分化的情况下,与Co-THP-1组巨噬细胞极化相关miRNA分子miR34a和Let7c出现显著变化(P<0.05)(见图4)。

图4 qRT-PCR法检测各组巨噬细胞极化相关miRNA分子的表达(*P<0.05)Fig 4 Expression of macrophage differentiation-associated miRNAs by qRT-PCR(*P<0.05)
3 讨论
药物治疗是乳腺癌治疗的关键,但新药的研发成本巨大,而药物再利用与新药开发相比,可大幅缩短药物的研发时间、成本和风险,奥氮平作为一种经济、安全有效的药物,在临床中广泛应用。它可阻断多种神经递质,包括多巴胺D1、D2、D3和D4受体,5-HT2A、5-HT2C、5-HT3受体,儿茶酚胺受体,α1-肾上腺素能受体,毒蕈碱受体的乙酰胆碱M1,组胺H1受体等。而乳腺癌的发生与精神压力密切相关,在精神压力作用下神经系统调节交感神经,刺激末梢神经释放高浓度的儿茶酚胺和糖皮质激素,干扰神经内分泌和免疫系统的平衡,调节肿瘤微环境,诱导巨噬细胞分化[4]。而巨噬细胞是肿瘤微环境中重要的免疫细胞,参与抗原呈递、吞噬和其他免疫调节过程,在肿瘤的发生发展过程中起到重要作用。THP-1细胞通常可被佛波酯诱导分化为巨噬细胞,广泛用于单核细胞和巨噬细胞相关的机制、信号通路以及营养和药物运输等研究中。巨噬细胞在不同因素的刺激下可分化为M1型或M2型巨噬细胞[5]。在肿瘤发展的初始阶段,巨噬细胞可以通过杀死肿瘤细胞直接促进抗肿瘤反应,表现为M1型[6]。由于肿瘤进展,肿瘤相关巨噬细胞(TAM)开始表现出免疫抑制的M2型,通过产生大量生长因子、细胞外基质重塑分子和细胞因子促进肿瘤的生长、迁移和血管生成[7-8]。本课题组推测,具有神经系统调节功能的奥氮平可影响巨噬细胞的增殖和分化,从而影响肿瘤生长。因此进一步明确奥氮平在乳腺癌中的作用机制,为奥氮平的药物再利用提供充分依据。
在前期实验中发现,不同浓度的奥氮平对单独THP-1细胞和MDA-MB-231细胞共培养条件下的THP-1细胞均有抑制作用,但两者之间并无差异。这提示奥氮平对THP-1细胞增殖活性的影响并不会受到MDA-MB-231细胞的影响。由于100 μmol·L-1的奥氮平对THP-1细胞增殖活性的影响较为明显,后续的实验中,采用50 μmol·L-1的奥氮平对巨噬细胞的分化进行研究。
为了进一步研究奥氮平对THP-1细胞和MDA-MB-231细胞共培养条件下THP-1的分化是否存在差异,本研究通过佛波酯诱导THP-1细胞向巨噬细胞分化,然后对巨噬细胞表面分子的表达进行检测。结果显示,在THP-1细胞单独培养组中,奥氮平仅参与CD68表达的调控;而在MDA-MB-231细胞参与的情况下,奥氮平能够显著提高CD68、CD80和CD163的表达水平,这提示奥氮平的存在对于THP-1细胞向巨噬细胞分化有着重要的意义,而MDA-MB-231细胞的存在对奥氮平影响巨噬细胞分化起着基础作用,但尚不能明确巨噬细胞M1或M2分化的方向。
为了进一步探索奥氮平对巨噬细胞分化的影响,我们检测了THP-1细胞向巨噬细胞分化时趋化因子和炎症因子表达的变化。结果显示,在MDA-MB-231细胞的参与下,单纯佛波酯诱导的THP-1细胞向巨噬细胞分化过程中炎症因子的变化并不明显。但是,在奥氮平的参与下,佛波酯诱导THP-1向巨噬细胞分化时IL-12的表达增加;随着MDA-MB-231细胞的进一步参与,CCL2、CXCL10、IL-1β、IL-10、IL-6、IL-12、TNF-α、TGF-β表达水平均显著升高。这一结果进一步证明了奥氮平对肿瘤微环境下巨噬细胞分化存在重要意义。已有文献显示,CCL-2、IL-6、IL-12、IL-1β是M1型亚群表型[9],说明经奥氮平处理后的THP-1有向M1型分化增强,向M2型分化减弱的可能。但M2型炎症因子CXCL10、IL-10、TNF-α也有升高[10],这提示肿瘤相关巨噬细胞的极化是一个复杂的过程,受多因素的调控。
miRNAs作为一种单链RNA,可以调节许多病理生理过程,如细胞增殖、代谢、凋亡等[11]。越来越多的证据表明,miRNA可以调节巨噬细胞极化[12]。结合前面的研究,肿瘤细胞的存在是奥氮平在巨噬细胞分化和极化中发挥作用的重要基础,因而我们进一步检测了巨噬细胞极化相关miRNA分子表达的变化。结果显示,在肿瘤细胞参与的情况下,奥氮平对miR155、miR34a和Let7c都有一定的调节作用。Graff等[13]比较了极化的人单核细胞源性巨噬细胞和极化的人单核细胞THP-1细胞系中miRNA的表达,结果发现miR-155在M1和M2b条件下均升高。研究表明,miR-9通过靶向过氧化物酶体增殖体激活受体δ增强M1极化[14],miR-155水平在巨噬细胞M1向M2极化时显著下降,但在巨噬细胞M2向M1极化时升高[15]。但有研究得出不同的结论,张艳青等[16]发现TGF-β1下调miR-155的表达,巨噬细胞会趋向M2型活化。另外,miRNA34a抑制TAMs细胞极化过程,TAMs细胞过表达miRNA34a后可以显著抑制MDA-MB-231细胞的生长增殖过程[17]。
综上所述,本研究证明奥氮平能够通过调节巨噬细胞表面分子、炎症因子和极化相关miRNA分子,参与肿瘤微环境的调控。因此,奥氮平具有肿瘤治疗的潜力及深入研究的价值。今后我们会进一步研究奥氮平调控乳腺癌肿瘤微环境的作用机制,并结合临床病例进行深入研究,探索奥氮平在抗肿瘤治疗中的新作用。
