基于血清代谢组学分析人参化橘红干预慢性阻塞性肺疾病的代谢机制
2024-03-14钟鹏英张玉超张芳华张喜利刘文龙湖南中医药大学药学院长沙410208中药成药性与制剂制备湖南省重点实验室长沙410208湖南省中医药研究院附属医院长沙410208
钟鹏英,张玉超,张芳华,张喜利,刘文龙*(1.湖南中医药大学药学院,长沙 410208;2.中药成药性与制剂制备湖南省重点实验室,长沙 410208;.湖南省中医药研究院附属医院,长沙 410208)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是一种慢性肺部疾病,其特点是气道气流受限,并伴有炎症和肺气肿,COPD患者气流受限的直接原因是气道重塑,而肺气肿则源于肺泡壁的广泛破坏[1-2]。烟雾中含有各种有毒物质,容易吸引巨噬细胞和中性粒细胞,促进内源性物质的释放,并加速氧化应激引起的肺组织损伤[3]。现代医学研究发现,到2030 年,COPD可能与高血压和糖尿病一起成为全球三大死因,极大地阻碍医疗保健的发展,损害人类健康[4]。目前还没有可逆转或阻止疾病发展的治疗方案,为此,迫切需要确定治疗研究的新机制或新靶点。代谢组学(代谢物分析)是一种新兴的方法,可用于鉴定代谢物的生物标志物和发现受干扰的代谢途径,依据代谢途径的变化从而发现不同疾病中的治疗标志物[5-7],在COPD疾病中发现其部分代谢表达也出现了紊乱[8],选取关键代谢途径进行治疗,有可能成为治疗新方式。
人参化橘红复方含人参、甘草、化橘红和陈皮,其中,药材陈皮和化橘红含有柚皮素、柚皮苷和陈皮苷,其抑制黏蛋白分泌和调节炎症的作用已得到广泛认可,具有祛痰和镇咳作用,可用于治疗慢性支气管疾病[9],人参皂苷Rg1、人参皂苷Rg3和总人参皂苷早已被证明可通过调节辅助性T细胞1和T细胞2 的比例来平衡内环境。人参皂苷Rg1可介导上皮-间质转化(EMT),进而抑制气道重塑来增强COPD患者的肺功能和存活水平[10-11]。然而,对于其如何干预 COPD的作用机制并不清晰,本研究经血清代谢组学分析并验证与COPD相关的生物标志物和代谢通路,为人参化橘红治疗COPD提供更加丰富的理论基础。
1 材料
1.1 动物
24只雄性SPF级SD大鼠,(200±20)g [湖南晶达实验动物有限公司,生产许可证号为:SYXK 2019-0009]。大鼠自由进食和饮水,饲养温度为20~25℃,湿度为50%~70%。所有实验均按照湖南中医药大学医学伦理审查委员会批准的动物实验方案和指南进行(伦理审查号:LL2022090602)。
1.2 试药
人参化橘红(西藏嘉唐保健品有限公司);TBST、BCA蛋白浓度测定试剂盒,RIPA(强)组织细胞快速裂解液(赛文科技有限公司);脂多糖(LPS,Sigma生物技术有限公司);HE染色(武汉皮诺飞生物技术有限公司);黄果树香烟(中国,含焦油 10 mg,尼古丁 0.9 mg,一氧化碳 12 mg);琥珀酸合成酶(ASS1)、激活激酶(P21)、磷脂酶(PLD1)抗体、山羊抗鼠IgG二抗(Affnity);肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、基质金属蛋白酶-9(MMP-9)和基质金属蛋白酶抑制剂-1(TIMP-1)ELISA试剂盒(上海抚生生物有限公司);氨茶碱(太原集团有限公司);水合氯醛(合肥博美生物科技有限责任公司);氯化钠注射液(湖南科伦制药有限公司);无水乙醇、甲醇和乙腈(上海安谱实验有限公司);超纯水(屈臣氏集团有限公司),自制烟熏盒子(80 cm×40 cm×20 cm)。
1.3 仪器
Q1320583超声仪(昆山禾创超声仪器有限公司);电泳仪和化学发光成像分析仪(美国Bio-Rad公司);UPLC-Q-TOF/MS质谱仪、Heraeus Fresco17离心机、酶标仪(美国赛默飞世尔科技有限公司)。
2 方法
2.1 COPD造模和给药
大鼠适应性喂养3 d后,随机分为对照组和模型组。对照组(6只)暴露于室内空气中,模型组(18只)于自制箱子中熏二手烟,每次 1.5 h,每次9支烟,每日2次(间隔4 h),每周6 d,共45 d;第1日和第14日用10%水合氯醛(0.3 mL/100 g)麻醉大鼠,用脱毛膏清创咽喉部,暴露喉部,用静脉注射针代替气管插管,向气管内注入0.2 mL质量浓度为1 mL·mg-1的LPS,然后将大鼠直立旋转10~20 s,使LPS均匀分布在肺部,2 d内不接触二手烟。人参化橘红人体给药每日3 g,氨茶碱每日1 g,大鼠按1 mL/100 g灌胃,人参化橘红给药质量浓度为0.027 g·mL-1,氨茶碱给药质量浓度为0.009 g·mL-1。
2.2 样品采集
末次给药后,禁食12 h,各组大鼠经麻醉处理,腹主动脉取血;室温下静置30 min后,以4℃、3000 r·min-1(离心半径9 cm)离心15 min,分离上层血清,-80℃保存。
2.3 组织病理学观察
取大鼠右肺组织于4%多聚甲醛溶液中固定48 h后,严格按照试剂盒说明书步骤,HE染色观察肺组织内炎症情况。参考文献报道分级[12]:0级,正常形态;1级,轻度肺间质充血和中性粒细胞浸润;2级,血管周围水肿形成,肺组织结构部分损坏,中度中性粒细胞浸润;3级,肺组织结构损坏严重,高密度中性粒细胞浸润。
2.4 ELISA法检测血清TNF-α、IL-1β、MMP-9和TIMP-1水平
收集血清按照相关试剂盒说明书严格操作,检测血清中TNF-α、IL-1β、MMP-9和TIMP-1水平。
2.5 血清代谢组学分析
移取100 μL样品至EP管中,加入400 μL提取液(甲醇-乙腈=1∶1,含同位素标记内标混合物),涡旋混匀30 s;超声10 min(冰水浴);-40℃静置1 h;将样品于4℃、12 000 r·min-1(半径8.6 cm)离心15 min;取上清液及QC样品(另取等量上清混合成)上机检测。
2.6 检测条件
色谱柱 Waters ACQUITY UPLC BEH Amide(2.1 mm×100 mm,1.7 μm);流动相A为含25 mmol·L-1乙酸铵和 25 mmol·L-1氨水,B为乙腈,采用梯度洗脱(0~0.5 min,95%B;0.5~7 min,95%~65%B;7~8 min,65%~40%B;8~9 min,40%B;9~9.1 min,40%~95%B;9.1~12 min,95%B);流速0.5 mL·min-1,柱温30℃,样品盘温度4℃,进样量2 μL。
2.7 Western blot检测
取大鼠左肺组织于-80℃保存。按照 BCA法蛋白质含量检测试剂盒的说明测定蛋白质浓度。取50 mg右肺组织,用冷PBS冲洗 3 次,用RIPA 裂解液提取蛋白质,用 BCA 法检测匀浆中的蛋白质浓度。将 5×SDS上样缓冲液与100 μg蛋白按比例混合,煮沸5 min,然后用 10% SDSPAGE 凝胶电泳分离,电泳条件为120 V,1 h;用甲醇活化的 PVDF 转膜,转膜条件为 200 A,1 h。转膜后,用 5%脱脂奶粉在 37℃下封闭2 h。按说明书用 P21、PLD1、ASS1和 GAPDH 一抗(1∶2200)在 4℃下孵育过夜,洗膜后加入稀释的二抗。二抗稀释后加入山羊抗兔 IgG 二抗(1∶7000)封闭,37℃室温下轻轻振荡孵育2 h。使用 BIO-Rad-ChemiDoc XRS 凝胶电泳,导出图像,测定各目标条带与 GAPDH 内参的灰度值,计算比值,得出预测蛋白的相对表达含量。
2.8 数据分析
使用SPSS 25软件对结果进行统计分析,结果表示为平均值±标准差(mean±SD)。使用单因素方差分析(ANOVA)进行统计比较。P<0.05表示差异有统计学意义。
原始数据经ProteoWizard软件转成mzXML格式后,使用自主编写的R程序包(内核为XCMS)进行峰识别、峰提取、峰对齐和积分等处理,然后与BiotreeDB(V2.1)自建二级质谱数据库匹配进行物质注释,算法打分的Cutoff值设为0.3。采用Sigmca-17软件对所得数据进行无监督模式的主成分分析(PCA)及有监督模式的正交偏最小二乘判别分析(OPLS-DA),得到能够反映组间贡献率的代谢物变量重要性投影(VIP)值散点图,利用HMDB数据库(http://hmdb.ca)与KEGG数据库(http://www.kegg.jp)对筛选得到的差异代谢物进行鉴定,辨别出潜在生物标志物,随后使用MetaboAnalyst 5.0数据库(http://www.metaboanalyst.ca)对潜在生物标志物进行富集分析。
3 结果
3.1 病理切片结果
HE染色显示,对照组大鼠肺组织有少许炎性细胞浸润,支气管壁基本完整,未见明显黏膜水肿和肺泡破坏;模型组大鼠支气管壁增厚,炎症细胞浸润,肺泡破裂,形成了大肺泡,肺泡壁增厚。与对照组比较,模型组大鼠肺组织病理评分升高(P<0.01);与模型组相比,人参化橘红组炎性浸润减少,肺泡破裂情况少见,病理评分降低(P<0.01)。结果见图1。
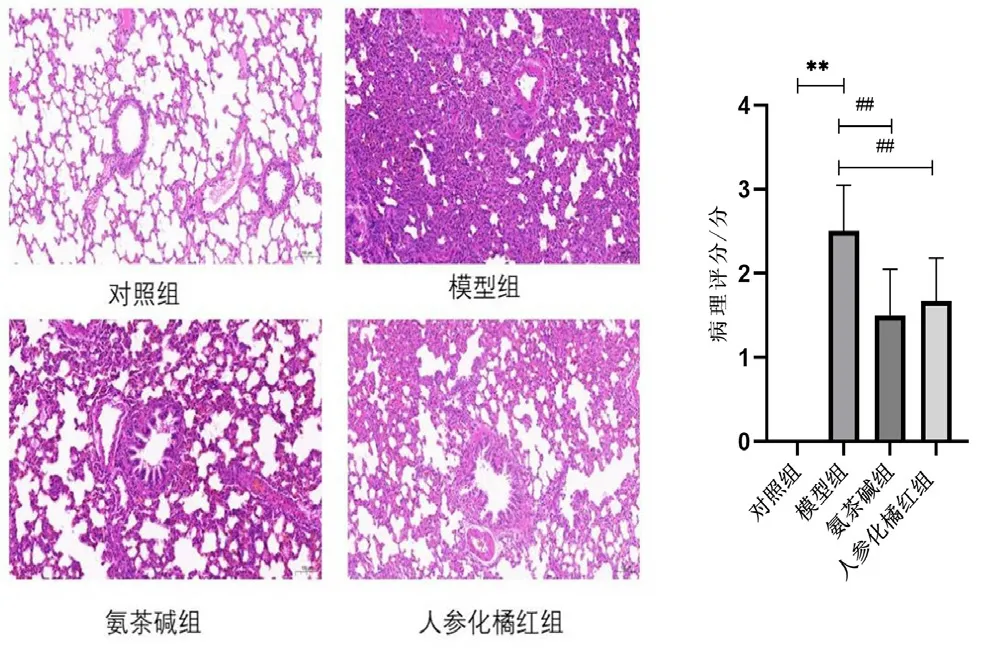
图1 不同组别HE染色及评分图(×200,n=6)Fig 1 HE staining and scoring charts of different groups(×200,n=6)
3.2 人参化橘红对COPD大鼠血清内TNF-α、IL-1β、MMP-9和TIMP-1水平的影响
与对照组比较,模型组大鼠血清内TNF-α、IL-1β、MMP-9和TIMP-1显著上升(P<0.01);与模型组比较,人参化橘红组TNF-α、IL-1β、MMP-9和TIMP-1均出现不同程度下降(P<0.05,P<0.01),可知用药后炎症浸润的效果明显改善,且肺气道内气道壁增厚现象有所改善(见图2)。
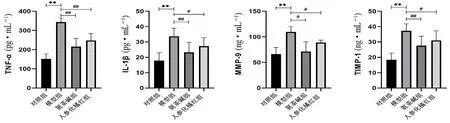
图2 大鼠血清内TNF-α、IL-1β、MMP-9和TIMP-1水平比较(n=6)Fig 2 TNF-α,IL-1β,MMP-9,and TIMP-1 levels in rat serum(n=6)
3.3 多元统计分析
模型组大鼠和人参化橘红组血清样品能够明显分离,且无交叉重叠,表明COPD大鼠体内发生了明显的代谢差异变化;PCA图中横坐标PC[1]和纵坐标PC[2]分别表示排名第一和第二的主成分的得分,每个散点代表一个样本,散点的颜色和形状表示不同的分组,样本点分布越靠近,说明样本中代谢物的种和含量越相似;反之,样本越远,其整体代谢水平差异越大,其结果可知样本全部处于95%置信区间内。结果见图3。
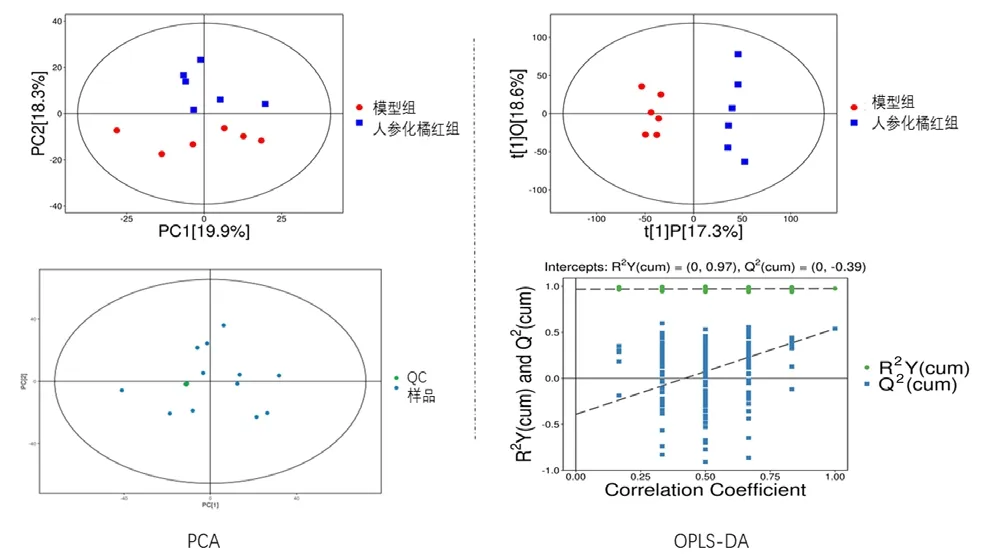
图3 大鼠血清代谢物的多元统计分析Fig 3 Multivariate statistical analysis of rat serum metabolites
在图3结果中,OPLS-DA模型中R2Y与Q2接近于1,则表明模型对Y变量的解释性越好且模型的预测能力越好,同时采用200次置换测试验证了OPLS-DA模型的可靠性,所有模拟值均小于真实值,且Q2的回归线截距均小于 0.05。结果表明,OPLS-DA模型具有良好的拟合度和预测能力,其对血清样品的差异具有良好的解释性。
3.4 人参化橘红生物标志物及KEGG富集分析
采用UPLC-Q-TOF/MS技术的代谢组学分析,根据设定的参数(VIP>1且P<0.05)筛选差异代谢物,将它们的二级质谱图分别与HMDB数据库、KEGG数据库中代谢物的二级质谱图进行匹配,反复比对,共得到33个潜在生物标志物,详细见表1;将上述差异代谢物代入Metabo Analyst 5.0富集分析共发现15条代谢路径,见图4,其中涉及组氨酸代谢、精氨酸合成、花生四烯酸代谢、甘油磷脂代谢和胆碱代谢等,随后通过相关文献找到与COPD相关的通路(精氨酸合成[13]、花生四烯酸代谢[14]和甘油磷脂代谢[15])及其对应的酶(ASS1、P21和PLD1)。

表1 人参化橘红潜在生物标志物Tab 1 Potential biomarkers Ginseng-Chemotaxis
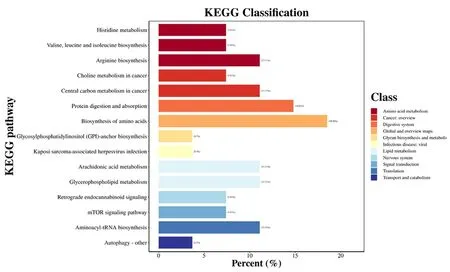
图4 KEGG富集分析得出15条路径Fig 4 15 paths yielded by KEGG enrichment analysis
3.5 代谢通路结果验证
选择上述涉及的酶,利用Western blot验证,结果如图5,与模型组相比,P21和ASS1的蛋白灰度值差异具有统计学意义,而PLD1无显著差异,由此推测人参化橘红可能通过促进ASS1和抑制P21,以促进精氨酸合成和抑制花生四烯酸代谢来干预COPD的发生发展。
4 讨论
COPD是一种多种症状叠在一起的肺功能性疾病,其发病机制复杂,治愈难度大,临床上对其治疗多以延缓其发展,减轻患者症状为首要目标[16]。本研究以LPS和烟雾诱导大鼠COPD模型,经人参化橘红干预一段时间,可明显看出肺组织和血清内炎症浸润减少,MMP-9和TIMP-1的抑制对于气道壁的增厚有所改善,提示该方对COPD的肺组织具有一定的保护作用,随后为了探明其代谢机制,利用UPLC-Q-TOF/MS分析模型组和人参化橘红组之间的血清,考察COPD相关生物标志物及其代谢通路。
精氨酸是必需氨基酸的一种,促进精氨酸的合成,对于抑制COPD发展是有积极意义的。有研究发现,COPD患者病情恶化时,精氨酸酶支气管上皮细胞、内皮细胞、成纤维细胞和肺泡巨噬中参与调节炎症和气道重塑的关键成分[17]。随着时间的推移,COPD患者肺动脉高压和动脉压呈现上升趋势,应用精氨酸干预后,肺组织损伤减轻,肺功能得到改善[18-19]。
花生四烯酸代谢是构成炎症的重要一环,通过抑制炎症反应达到阻碍疾病进程是治疗众多疾病的基础,经脂氧酶的代谢作用后,可活化NF-κB,肺泡灌洗液和肺组织内炎症因子白细胞数量显著增加,推测其可能增加氧化应激和蛋白酶的负荷,加重了COPD的发生发展[20]。其次其通过改变花生四烯酸代谢后,可阻碍血栓素B2和白三烯等炎症因子的形成,降低肺组织内细胞凋亡指数,减少烟雾诱导累积的毒性效应[21]。甘油磷脂代谢作为COPD患者肺组织内代谢紊乱的重要标志物[22],其前体物质植物鞘磷脂可代谢为脂肪酸,随后并入甘油磷脂内,在细胞的凋亡、迁移和炎症中均可表达,对于COPD的诊断具有重大价值[23]。但根据Western blot的检测结果可知,人参化橘红对抑制其表达无显著性差异,可能对甘油磷脂代谢抑制无明显作用。
综上所述,本研究通过血清代谢组学探究人参化橘红干预COPD的作用机制,发现人参化橘红可通过促进精氨酸的合成和抑制花生四烯酸代谢,抑制肺组织的炎症浸润,保护肺功能。
