荷斯坦奶牛DPP6和PRKN基因的生物信息学及表达规律分析
2024-03-13李瑞瑞虎红红杨文飞
李瑞瑞,虎红红,冯 雪,杨文飞,马 云
(1.宁夏大学动物科技学院/宁夏回族自治区反刍动物分子细胞育种重点实验室,银川 750021;2.宁夏新澳农牧有限公司,宁夏 灵武 750406)
【研究意义】乳业是健康中国、强壮民族的重要产业[1],促进其健康稳定发展,既是为了生产牛奶,提高国民的整体生活水平,又可高效利用国土资源,营造良好的生态环境,优化农业结构,促进农村经济持续发展。根据2023年发布的《中国农业展望报告(2023—2032)》,我国奶制品生产量和消费量均增长较快,奶源自给率不断提高,然而,供给缺口依然存在,进口保持增长但增速放缓。预计2032年奶制品进口量将增至2.32×107t(折合生鲜乳),年均增长1.6%。此外,我国奶类消费也存在着地区、城乡之间的不平衡,这为我国的奶业发展提供了更多的潜力和方向,提髙奶品质和奶产量已成为我国奶业亟待解决的问题之一。遗传育种技术作为对奶业生产效率影响达到40%的因素,成为了改善产奶性状的有效手段[2]。【前人研究进展】二肽基肽酶样6(Dipeptidyl Peptidase-like 6,DPP6)又称为DPPX、DPL1、BSPL、钾通道加速因子(KAF),是一种II型(单次)跨膜蛋白,来源于一个普遍存在的丝氨酸肽酶家族,该家族对原核生物和真核生物的正常细胞功能至关重要,其家族多个成员都被证实参与了细胞死亡的炎症形式[3]。在成年啮齿动物大脑中已发现了DPP6的3种替代亚型:DPP6-K、DPP6-S和DPP6-L。DPP6-S的表达水平最高,其次是DPP6-K和DPP6-L[4]。DPP6-S和DPP6-K主要存在于CA1~CA3区域的海马锥体神经元中。然而,DPP6-L主要局限于嗅球和小脑[4]。有研究表明[5],DPP6基因具有关键的酶催化丝氨酸取代天冬氨酸,从而使其蛋白酶功能失活,并促进和维持丝状伪足的生长和稳定。作为A型电压门控K通道的强大调节辅助亚基,通过增强Kv4.2通道电导,DPP6可防止神经元的过度兴奋以及动作电位的反向传播[4,6]。Lin等[7]利用多种实验技术发现,DPP6是丝状伪足正常发育并适当过渡到树突棘所必需的,在行为和大脑发育中发挥关键作用[8],且与神经退行性疾病和认知障碍(如肌萎缩侧索硬化症、痴呆、智力障碍等)相关[6, 9]。此外,Pedrosa等[10]表明,DPP6能够对奶牛的乳脂率产生影响,并且Li等[11]通过多态性检测筛选出了DPP6的重要多态性位点,通过关联分析发现其能够显著影响奶牛的产奶量、乳脂率、乳蛋白率以及体细胞评分等重要性状。PRKN基因即Parkin基因,也称PARK2(Parkinson’ s disease gene 2),是属于RBR(RING-in-Between-RING)家族的一种E3泛素连接酶,Parkin突变可导致异常蛋白累积,加速神经元细胞死亡,导致帕金森病和阿尔兹海默病等疾病的发生[12-13]。此外,PINK1-Parkin介导的线粒体自噬可调控线粒体质量控制系统,维持线粒体的正常形态及功能[14],据报道,这些细胞器特异性自噬能够通过消除受损细胞器和维持体内平衡从而对炎症性疾病产生影响[15],同时促进细胞的存活和增殖[16]。【本研究切入点】基于宁夏反刍动物分子细胞育种重点实验室前期工作基础与最新全基因组关联分析(Genome-Wide Association Studies,GWAS)研究报道[10,17],推测DPP6和PRKN基因能够对奶牛产奶发挥作用。然而,目前关于DPP6和PRKN基因的研究大多集中于人类癌症等方面(如癌症细胞的增殖和分化以及靶向治疗等)[8, 18],而对于牛生理功能方面的报道较少[10-11,17]。【拟解决的关键问题】本研究拟以DPP6和PRKN为目的基因,对其蛋白特性进行生物信息学分析,并利用qRT-PCR技术对2个基因在荷斯坦奶牛不同组织及乳腺上皮细胞(bMECs)的表达水平进行检测,为进一步探究荷斯坦奶牛DPP6和PRKN基因生物学功能提供数据支持,也为荷斯坦奶牛的分子标记辅助选择与遗传育种做提供理论基础。
1 材料与方法
1.1 试验样品
荷斯坦奶牛来自宁夏回族自治区灵武市某规模养殖奶牛场。选择3头具有相同父本且饲养管理条件相同的荷斯坦奶牛,取屠宰后奶牛组织(心脏、肝脏、脾脏、肺脏、肾脏、乳腺、卵巢、子宫、黄体和瘤胃),将表面血迹擦拭后,分装成黄豆粒大小置于2.0 mL冻存管,投入液氮保存送回实验室,-80 ℃保存备用。乳腺上皮细胞(bMECs)为宁夏回族自治区反刍动物分子细胞育种重点实验室前期经过鉴定并保存于液氮罐中的细胞[19]。
1.2 主要试剂与仪器
试验所用的主要试剂[19]:0.25%的胰酶消化液(Hyclone,美国)、DMEM高糖培养基(Hyclone,美国)、PBS缓冲液(Hyclone,美国)、胎牛血清(HyClone,美国)、脂多糖(Lipopolysaccharide, LPS, Sigma美国)、RT-qPCR试剂盒(Universal SYBR RT-RT-qPCR Master Mix)、逆转录试剂盒(TaKaRa,北京)、TriZol试剂(TaKaRa,北京)、RNase-free H2O(天根,北京)。
试验所用的主要仪器[19]:高压灭菌锅(普和希,日本)、普通 PCR 仪(Bio-Rad,美国)、电热恒温水浴锅(一恒,上海)、37 ℃ CO2培养箱(Thermo,美国)、CFX96实时荧光定量PCR 仪(Bio-Rad,美国)。
1.3 试验方法
1.3.1 生物信息学分析 利用生物信息学相关工具对DPP6和PRKN蛋白的生物学功能进行预测,预测工具见表1。

表1 生物信息学分析在线工具及软件[20-24]
1.3.2 总RNA的提取及cDNA的合成 采用TRIzol 法提取组织总RNA,后通过多功能全波长酶标仪检测所提取的总RNA样品浓度(ng/μL),计算OD260/OD280值同时通过1%琼脂糖凝胶电泳检测RNA质量[20]。
采用Takara公司反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)进行反转录:①去除基因组DNA反应:向无RNA酶离心管中加入5xg DNA Eraser Buffer 2 μL,gDNA Eraser 1 μL,Total RNA为1000 ng,最后加RNase Free ddH2O至10 μL,混匀,瞬时离心,反应条件为42 ℃ 2 min。②反转录反应:向步骤①中10 μL的反应液加入PrimeScript RT Enzyme Mix I 1 μL,RT Primer Mix 1 μL,5x PrimeScript Buffer 2 (for Real Time) 4 μL和RNase Free ddH2O 4 μL,混勾,瞬时离心,反应条件为37 ℃ 15 min,85 ℃ 5 s,4 ℃。反应结束后,得到cDNA,-80 ℃保存。
1.3.3 组织表达谱的构建 对DPP6和PRKN基因进行引物设计。根据NCBI中査找己知牛(Bostaurus)的2个基因[DPP6(NM_174040.2)、PRKN(NM_001199065.1)]以及GAPDH(NM_001034034.2)的序列。通过Primer 5.0设计特异性荧光定量引物(表2),由通用生物系统(安徽)有限公司对引物进行合成[19]。

表2 荧光定量PCR实验所需引物序列

表3 荷斯坦奶牛与其他8个物种DPP6蛋白序列相似性比对

表4 荷斯坦奶牛与其他5个物种PRKN蛋白序列相似性比对
1.3.4 bMECs的复苏与传代培养 于液氮罐中取出前期保存的bMECs,放入37 ℃水浴锅融化,后均匀接种在DMEM培养基(血清含量为10%),放入37 ℃、湿度100%的培养箱(5% CO2)中进行培养,待细胞生长密度为90%时进行细胞传代(用PBS漂洗bMECs细胞1~2遍,随后加入1 mL胰酶消化液吹打消化2~3 min,加入与胰酶等体积培养基终止消化;转移至15 mL离心管中,1000 r/min离心5 min后;弃上清,加入1 mL培养基吹打混匀后,接种到新培养皿中培养[19,25]。
1.3.5 bMECs炎症模型的建立 将细胞接种于6孔细胞培养板中培养24 h,待细胞密度达到70%~80%时,向每孔细胞中滴加LPS溶液(终浓度为50 ng/μL),诱导细胞产生炎症反应。待LPS诱导6 h,收集细胞,用于RNA提取。通过检测促炎细胞因子[白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8 (interleukin-8,IL-8) 、白介素-1β(interleukin-1β,IL-1β)]mRNA的表达量,判断炎性细胞模型是否构建成功[19,25]。
RT-qPCR反应总体系20 μL:ChamQ Universal SYBR RT-qPCR Master Mix 10 μL,上、下游引物各0.8 μL,cDNA模板2 μL,ddH2O 6.4 μL;反应程序:95 ℃ 3 min,95 ℃ 10 s,56 ℃ 30 s,72 ℃ 30 s,39个循环,每个样品设置3个生物学重复。以GAPDH为内参,利用2-△△Ct计算分析荧光定量结果,用SPSS 25进行单因素方差(One-way ANOVA)分析,通过Graph Pad Prism 9.5绘图,其中P<0.05表示差异显著,P<0.01表示差异极显著[20, 26]。
2 结果与分析
2.1 DPP6和PRKN的理化性质分析
2.1.1 DPP6的理化性质分析 在线工具 Prot Param预测发现DPP6蛋白编码863个氨基酸,其中Ser所占比例最大(8.1%),Met与Trp占比相同且最少(1.3%)(图1)。DPP6具有107个负电荷的氨基酸残基(Asp+Glu),93个正电荷的氨基酸残基(Arg+Lys);不稳定系数为44.53,属于不稳定蛋白;DPP6蛋白质的分子式为C4317H6676N1168O1303S24,相对分子质量为96 556.98;理论等电点(PI)为6.01,预估DPP6蛋白半衰期为30 h,脂溶系数为78.98,平均亲水系数为-0.408;在DPP6蛋白第100个氨基酸处疏水性最强(3.9),在第421个氨基酸处亲水性最强(-2.944),在负值区域有较多的氨基酸,故亲水氨基酸占比较大,整体属于亲水性蛋白(图2-a);DPP6编码的氨基酸包含丝氨酸磷酸化位点48个、酪氨酸磷酸化位点14个、苏氨酸磷酸化位点27个(图2-b);DPP6有9个N-糖基化位点,分别为Asn13、171、317、349、402、469、533、564、811(图2-c)。

图1 荷斯坦奶牛DPP6蛋白的氨基酸组成与比例Fig.1 Amino acid composition and ratio of DPP6 protein in Holstein dairy cows

a.蛋白亲疏水性预测;b.磷酸化位点分析;c.糖基化位点分析。下同。a.Protein hydrophilicity prediction; b.Phosphorylation site analysis; c.Glycosylation site analysis. The same as below.
2.1.2 PRKN的理化性质分析 使用在线工具 Prot Param 预测发现PRKN蛋白编码488个氨基酸,其中Gly占比最大(10.0%),Met占比最少(0.6%)(图3)。PRKN蛋白质的分子式为C2303H3650N680O708S32,相对分子质量为53 218.37,具有53个负电荷的氨基酸残基(Asp+Glu),54个正电荷的氨基酸残基(Arg+Lys),属不稳定蛋白(不稳定系数为49.01);预估PRKN的半衰期为30 h,脂溶系数为73.87,平均亲水系数为-0.362,理论等电点(PI)为7.42。在PRKN蛋白的第322与323个氨基酸处疏水性最强(2.000),第308个氨基酸处亲水性最强(-3.122),在负值区域有较多的氨基酸,故亲水氨基酸占比较大,整体属于亲水性蛋白(图4-a);此外,PRKN蛋白编码的氨基酸包含丝氨酸磷酸化位点28个、酪氨酸磷酸化位点3个,而苏氨酸磷酸化位点15个(图4-b);PRKN有1个N-糖基化位点,为Asn469(图4-c)。

图3 荷斯坦奶牛PRKN蛋白的氨基酸组成与比例Fig.3 Amino acid composition and proportion of PRKN protein in Holstein dairy cows

图4 荷斯坦奶牛PRKN蛋白理化性质分析Fig.4 Physicochemical properties analysis of PRKN protein in Holstein dairy cows
2.2 DPP6和PRKN蛋白跨膜结构、信号肽和结构域预测
2.2.1 DPP6蛋白跨膜结构、信号肽和结构域预测 TMHMM预测DPP6蛋白在第94~116氨基酸残基之间具有一个跨膜螺旋结构(TMHs),跨膜螺旋中氨基酸的预期数量大于18(22.584 72),因此预测DPP6蛋白可能为跨膜蛋白(图5-a);通过SignalP 5.0预测DPP6蛋白不属于分泌蛋白(不具有信号肽)(图5-b);利用NCBI在线工具预测DPP6蛋白的保守结构域,发现该蛋白具有2个匹配的超家族保守结构域(第193~559位氨基酸处的DPPIV_N super family和第639~845位氨基酸处的Abhydrolase super family),特定匹配在DPPIV_N,属于DPPIV_N超级家族(图5-c)。蛋白亚细胞定位预测表明,该蛋白定位于内质网比例占55.6%,细胞核、液泡、细胞质和线粒体均占11.1%,推测该基因主要在内质网内发挥转录调控作用。

a. 蛋白跨膜结构;b. 信号肽;c. 结构域预测。下同。a. Protein transmembrane structure; b. Signal peptide; c.Domain prediction. The same as below.图5 荷斯坦奶牛DPP6蛋白理化性质分析Fig.5 Physicochemical properties analysis of DPP6 protein in Holstein dairy cows
2.2.2 PRKN蛋白跨膜结构、信号肽和结构域预测 TMHMM预测PRKN蛋白不存在跨膜螺旋结构(TMHs)(图6-a)。通过SignalP 5.0预测PRKN蛋白也不属于分泌蛋白(图6-b);NCBI在线工具预测发现该蛋白具有5个保守结构域(第223~313位氨基酸处的zf-RING_14、第141~224位氨基酸处的RING0_parkin、第296~374位氨基酸处的BRcat_RBR_parkin、第3~76位氨基酸处的Ubl_parkin和第404~424位氨基酸处的BRcat_Rcat_RBR super family)(图6-c)。此外,PRKN蛋白亚细胞定位预测表明,该蛋白定位于细胞核比例占52.2%,细胞质占26.1%,线粒体占8.7%,细胞膜、过氧化物酶体和细胞骨架均占4.3%,推测PRKN主要在细胞核内发挥转录调控作用。

图6 荷斯坦奶牛PRKN蛋白理化性质分析Fig.6 Physicochemical properties analysis of PRKN protein in Holstein
2.3 DPP6和PRKN蛋白结构、互作蛋白预测及蛋白进化树分析
2.3.1 DPP6蛋白结构、互作蛋白预测及蛋白进化树分析 Prabi预测(图7-a、7-b)发现,DPP6蛋白二级结构中无规则卷曲(Random coil,紫色短竖线区)占比52.61%,延伸链(Extended strand,红色中竖线区)占比23.41%,而α-螺旋(Alpha helix,蓝色长竖线区)占比23.99%,由此推测,无规卷曲为荷斯坦奶牛DPP6最大量二级结构元件,α-螺旋和延伸链散布其中,无β-转角结构原件;通过SWISS-MODEL预测发现(图8-a),DPP6蛋白以无规卷曲为主,与二级结构预测结果一致。蛋白互作网络预测DPP6可能与PRNP、KCNIP3、KCNC4、IGLON5、GALNTL5等蛋白存在互作关系,并通过与上述蛋白的相互作用参与奶牛产奶等生物学功能(图8-b);将牛的DPP6蛋白序列与山羊、斑马、虎鲸、驴等的蛋白序列进行相似性比对,发现牛与上述物种DPP6蛋白的同源性较高,通过MEGA 11.0构建蛋白进化树可知,牛与山羊的序列相似性最高,这与同源性比对结果吻合,推测两个物种的DPP6蛋白可能具有相似的生物学功能(图8-c)。

a横向表示二级结构分布; b按顺序完整表示每个蛋白的二级结构。下同。a shows the secondary structure distribution horizontally; b shows the complete secondary structure of each protein in sequence. The same as below.
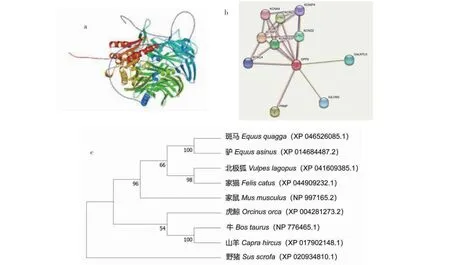
a.蛋白三级结构预测;b.互作蛋白预测;c.DPP6蛋白进化树。下同。a. Protein tertiary structure prediction; b. Interacting protein prediction; c. DPP6 protein evolutionary tree. The same as below.
2.3.2 PRKN蛋白结构、互作蛋白预测及蛋白进化树分析 Prabi预测(图9-a、9-b)发现,PRKN蛋白二级结构中无规则卷曲、延伸链和α-螺旋分别占比61.27%、 22.95%、15.78%,由此推测,无规卷曲为荷斯坦奶牛PRKN最大量二级结构元件,α-螺旋和延伸链散布其中,无β-转角结构原件。SWISS-MODEL预测结果与二级结构预测结果一致,均以无规卷曲为主(图10-a)。此外,预测发现该蛋白可能与PINK1、UBE2N、BECN1、SNCA、MFN1等蛋白存在互作关系,并通过与上述蛋白的相互作用调控线粒体自噬从而参与奶牛产奶等生物学功能(图10-b)。将牛的PRKN蛋白序列与马鹿、绵羊、虎鲸、山羊和宽吻海豚的蛋白序列进行相似性比对,发现牛与上述物种PRKN蛋白的同源性较高,通过MEGA 11.0构建蛋白进化树,可知牛与马鹿的PRKN蛋白序列相似性最高,这与同源性比对结果吻合,推测两个物种的PRKN蛋白可能具有相似的生物学功能(图10-c)。

图9 荷斯坦奶牛PRKN蛋白二级结构预测Fig.9 Prediction of PRKN protein secondary structure in Holstein dairy cows

图10 荷斯坦奶牛PRKN蛋白三级结构、互作蛋白预测与进化树Fig.10 Tertiary structure,prediction of interacting protein and evolutionary tree of PRKN protein in Holstein dairy cows
2.4 荷斯坦奶牛DPP6和PRKN基因组织表达分析
对DPP6和PRKN基因的组织表达谱进行探究,发现DPP6和PRKN基因在组织中普遍表达。其中,DPP6基因在肾脏和乳腺组织中表达量最高,其次是脾脏和肺脏,以心脏中DPP6基因表达量作为对照,荷斯坦奶牛DPP6基因在肾脏、乳腺、脾脏、肺脏的表达量均达到极显著水平(图11-a),而PRKN基因在乳腺中表达量最高,其次是瘤胃和肾脏,以肺脏中PRKN基因表达量为对照,荷斯坦奶牛PRKN基因在肾脏、瘤胃和乳腺的表达量均达到极显著水平(图11-b)。

*表示在P<0.05水平差异有统计学意义;**表示在P<0.01水平差异有统计学意义。* indicates that the difference has the statistical significance at the P<0.05 level; ** indicates a statistically significant difference at P<0.01.
2.5 DPP6和PRKN基因在LPS诱导的奶牛乳腺上皮细胞中的表达分析
采用RT-qPCR技术检测促炎细胞因子IL-6、IL-8和IL-1β在LPS诱导奶牛乳腺上皮细胞后的表达情况,从而鉴定炎症诱导bMECs是否成功。结果表明,与空白对照组相比,IL-8、IL-6和IL-1β在LPS诱导后的细胞中均显著上调表达(图12),其中IL-8(P<0. 0001)与IL-6(P<0. 01)的表达量达到极显著,表明LPS成功诱导了奶牛乳腺上皮细胞产生炎症反应[25]。

*表示差异显著(P<0.05);**表示差异极显著(P<0.01);****表示差异极显著(P<0.0001)。每组进行3个重复。下同。* indicates significant difference (P<0.05); ** indicates extremely significant difference (P<0.01); **** indicates extremely significant difference (P<0.0001). Each group performed three repetitions. The same as below.
进一步探究炎性状态下的bMECs中DPP6和PRKN基因的表达模式,结果发现,相比空白对照组,DPP6基因在LPS诱导的细胞中极显著下调,PRKN基因则在LPS诱导组极显著上调(P<0.01),表明DPP6与PRKN基因均可能在奶牛乳腺上皮细胞炎症反应中具有潜在作用(图13)[25]。

图13 DPP6和PRKN基因在LPS诱导的bMECs中的表达Fig.13 Expression of DPP6 and PRKN genes in LPS-induced bMECs
3 讨 论
荷斯坦奶牛体型大、产奶量高,且适应性强,在中国北方大部分地区均有养殖,饲养分布较广,是我国存栏量最多的奶牛品种。在过去几十年,研究者们为提高奶牛的产奶性能已采用多种方法来鉴定对产奶性状有重要意义的遗传标记,而通过分子生物学进行辅助育种的兴起,使得以某些与产奶性状相关的基因作为分子标记来判定奶牛的产奶性能成为可能,从而极大地提升了选种选育的效率。目前,已有部分基因被证实对产奶性状有显著的遗传效应[27]。
DPP6来源于一个普遍存在的丝氨酸肽酶家族,该家族对原核生物和真核生物的正常细胞功能至关重要。Lin等[7]发现丝状伪足需要DPP6才能正常发育并适当地转变为树突棘。DPP6在丝状伪足调节中的作用最终导致在行为和大脑发育中发挥关键作用[8],即DPP6与神经退行性疾病和认知障碍有关,例如肌萎缩侧索硬化症、痴呆、智力障碍、图雷特综合征、小头畸形和自闭症谱系障碍等[9]。DPP6还被报道可作为A型电压门控K+通道的强大调节辅助亚基,在神经元兴奋性中起重要作用,并且能够独立调节突触发育[9]。通过增加Kv4.2通道电导,DPP6防止神经元过度兴奋以及动作电位的反向传播,其家族成员DPP8和DPP9被报道都参与了细胞死亡的炎症形式[28],而DPP4因其在糖尿病和癌症治疗中的作用而被关注[29]。此外,Rout等[30]通过探究不同生态和放牧条件下饲养的10个品种的山羊奶低丰度和高丰度蛋白质,表明DPP-IV能够调节酪蛋白和非酪蛋白山羊奶蛋白的翻译后修饰;Pedrosa等[10]对加拿大荷斯坦奶牛表型性状进行全基因组关联分析,表明DPP6可作为奶牛产奶性状候选基因对奶牛产奶量产生影响。此外,Kaniyamattam等[31]通过试验发现,在奶牛中,钾能够通过渗透调节作用与乳糖密切相关,从而对产奶量产生影响。本研究对DPP6蛋白进行了生物信息学分析,发现该蛋白为不稳定亲水性蛋白,PRNP、KCNIP3、KCNC4、IGLON5、GALNTL5等蛋白与DPP6蛋白存在互作关系,多种蛋白相互作用从而参与奶牛产奶等生物学功能,并且作为钾通道加速因子,诱导产奶量发生变化从而对乳糖率性状造成影响[10],通过构建不同物种DPP6蛋白进化树,本研究发现牛与山羊的序列相似性最高,保守型较强,推测两个物种的DPP6蛋白可能具有相似的生物学功能。之后通过构建荷斯坦奶牛组织表达谱,进一步检测DPP6基因在荷斯坦奶牛乳腺组织中的表达,结果显示相比其他组织,DPP6基因在乳腺中具有较高相对表达量。这与之前的研究以及GWAS的筛选结果一致[10, 31]。此外,根据前人研究结果[9, 29-32],推测DPP6基因可能与奶牛乳房炎症的发生密切相关,因此本研究通过LPS诱导构建了荷斯坦奶牛的乳腺上皮细胞炎症模型,检测DPP6基因在炎症诱导的bMECs中的表达,结果显示,DPP6基因在LPS诱导的bMECs中极显著下调,因此推测DPP6基因可能在奶牛乳腺上皮细胞炎症反应中具有潜在的调节作用[25]。
有研究表明[33-34],Parkin能够泛素化大量的底物蛋白,在不同亚基上催化形成不同的泛素链,从而改变其蛋白质之间的相互作用以及亚细胞定位,并且促进泛素-蛋白酶体系统的蛋白质降解。Parkin的结构从N端至C端,由泛素样结构域(Ubiquitin-like domain,Ubl)、锌指结构域RING0、RING1、RING间区(In-between RING,IBR)、Parkin抑制元件(The repressor element of parkin,REP)和RING2组成[34],揭示了许多关于其调节和功能的信息。目前已鉴定出超过120个致病性PD相关突变散布在Parkin的整个结构域中[30],因此,Parkin所有的结构域在功能上都十分重要。研究表明,PINK1-Parkin介导的线粒体自噬可调控线粒体质量控制系统,维持线粒体的正常形态及功能,以应对损伤和感染[35]。在灵长目的一些物种中,PRKN主要在脑中集中表达,并广泛存于各类正常组织中,例如在人的心血管和骨骼肌,同时在脊椎动物与无脊椎动物例如秀丽线虫和黑腹果蝇中也高度保守,因此,PRKN可能具有潜在且重要的生物学功能。此外,Elswood等[36]通过研究发现,线粒体相关基因PRKN能够通过调节程序化的线粒体自噬进而影响乳腺上皮细胞的分化,而PINK1、UBE2N、BECN1、SNCA、MFN1等蛋白与PRKN存在互作关系,多种线粒体相关基因相互作用从而参与奶牛产奶等生物学功能。然而,有关PRKN基因的遗传变异对荷斯坦奶牛的产奶性状的影响,目前国内外的研究甚少。Liu等[37]通过金黄色葡萄球菌(Staphylococcusaureus)诱导奶牛乳腺上皮细胞产生炎性反应,发现PINK1/parkin介导的线粒体自噬促进了金黄色葡萄球菌的存活,并有助于金黄色葡萄球菌的持续感染。在本研究中,通过对PRKN蛋白进行生物信息学分析,发现该蛋白为不稳定的亲水性蛋白,具有5个保守结构域,无跨膜结构及信号肽,亚细胞定位于细胞核比例占65.2%,推测PRKN主要在细胞核内发挥转录调控作用。通过预测PRKN蛋白理化性质,发现甘氨酸含量最多,而甘氨酸被报道能够调节奶牛乳腺上皮细胞的增殖和凋亡,促进乳腺上皮细胞向DNA合成期转化,促进细胞分裂[38]。构建不同物种PRKN蛋白进化树,发现牛PRKN序列与马鹿的序列相似性最高,保守型较强,推测两个物种的PRKN蛋白可能具有相似的生物学功能。后采用RT-qPCR探究了PRKN在荷斯坦奶牛不同组织中的表达模式,结果显示PRKN基因在乳腺中亦具有较高相对表达量,提示同样可作为与奶牛产奶性状相关的候选基因。PINK1-Parkin介导的线粒体自噬可调控线粒体质量控制系统,维持线粒体的正常形态及功能,Harper等[15]发现这些细胞器特异性自噬能够通过消除受损细胞器和维持体内平衡从而对炎症性疾病产生影响,在此基础上,本研究检测了PRKN基因在空白对照组与LPS诱导组的bMECs中的表达,发现PRKN基因在LPS诱导的bMECs中极显著上调,这与Liu等[37]和Lin等[39]的研究相似。因此,推测PRKN基因也可能在奶牛乳腺上皮细胞炎症反应中具有潜在的调节作用[25]。
基于前期GWAS、生物信息学、不同组织与bMECs差异分析,本研究发现DPP6与PRKN基因均在乳腺组织中具有较高的相对表达量,且DPP6在LPS诱导的bMECs中极显著下调,PRKN基因极显著上调,2个基因均对乳腺上皮细胞的炎症反应具有潜在的调控作用。因此,结合其他学者研究[10-11,17],可推断荷斯坦奶牛DPP6与PRKN基因可能具有调控乳腺细胞生长作用,后期可对其在细胞水平开展功能验证,深入研究2个基因对奶牛产奶及乳腺上皮细胞炎症反应的具体影响。
4 结 论
本研究发现DPP6蛋白编码863个氨基酸残基,编码产物主要分布在内质网;PRKN蛋白编码488个氨基酸残基,编码产物主要分布在细胞核,2个蛋白均为不稳定亲水性蛋白。DPP6与PRKN2个基因在荷斯坦奶牛组织中普遍表达,且在乳腺组织中均具有较高相对表达量,此外,相对于空白对照组,DPP6基因在LPS诱导的bMECs中极显著下调,PRKN基因极显著上调,2个基因均对炎性乳腺上皮细胞具有潜在的调节作用,可能会影响奶牛的乳房炎症。本研究结果为荷斯坦奶牛DPP6与PRKN2个基因后续在奶牛乳房炎症相关调控机制研究提供理论依据。
