脑小血管病认知障碍患者脑电功率谱变化与中性粒细胞/淋巴细胞比值相关性及临床价值研究
2024-03-13郭晓敏魏爱芹刘宗伟袁维帅
郭晓敏,魏爱芹,刘宗伟,袁维帅,朱 娜
(1.陕西省人民医院,陕西 西安 710068;2.自然资源部第一海洋研究所,山东 青岛 266061)
脑小血管病(Cerebral small-vessel disease,CSVD)指一类累及脑部小血管及毛细血管微循环,导致白质及深部灰质损伤的一系列临床病理综合征的总称[1]。CSVD临床表现复杂,可表现为局灶性神经功能障碍、情绪改变、皮层下功能障碍及神经功能障碍等[2]。近年来,由于CSVD对认知功能的影响,神经心理学评估、生物学及影像学标志物等研究逐渐成为国内外的研究热点[3]。然而近年来多项研究[4-6]表明,结构成像参数缺乏敏感性,表型一致性差。而且,神经心理学测验具有很强的主观性,易受患者精神状态等影响。脑电图作为一种非侵入性方法,具有廉价、易获得、实时性强的特点,可用于检测认知功能障碍患者的脑皮层兴奋性、连通性和脑电活动的功能同步性变化,具有良好的敏感性和特异性[7-8]。定量脑电图(Quantitative electroencephalography,QEEG)是一种现代类型的脑电图分析技术,而功率谱密度(Power spectral density,PSD)是QEEG的核心部分,既能表现出脑电信号的强弱,又能表现出脑电信号的频率特征[9]。目前关于PSD与脑小血管病认知障碍(Cerebral small vessel disease cognitive impairment,CSVCI)的相关性,尚未见相关文献报道。近年来,炎症因子在CSVD的研究中逐渐得到重视,尤其是血中性粒细胞与淋巴细胞比值(Neutrophil/lymphocyte ratio,NLR)被发现可能为CSVD的重要危险因素[10-12],并可能与CSVCI相关[13]。但其与脑电指标间是否有相关仍不明确。因此,本研究探索CSVCI患者脑电功率谱变化与NLR的相关性,并分析其临床价值。
1 对象与方法
1.1 研究对象 选取2021年9月至2022年9月住院治疗的CSVD患者61例,依据蒙特利尔认知评估量表(MoCA)评分,将其分为伴有认知障碍组(CSVCI组,29例)和无认知功能障碍组(CSVD组, 32例)。病例纳入标准:年龄在50~80岁;检查符合我国2021版《中国脑小血管病诊治共识》相关诊断标准[14];临床资料完整,患者或家属愿意加入本研究。排除标准:大面积脑梗死、脑出血等大血管病变;脑炎、正常压力性脑积水、阿尔茨海默病、帕金森等导致认知功能障碍的其他神经系统疾病:其他引起认知功能改变的系统性疾病,如糖尿病、肥胖及代谢性性疾病等;色盲及色弱者。同时,收集同期体检健康者20例为对照组(HC组),其中男性8例,女性12例,平均年龄(61.30±1.08)岁。本研究通过了陕西省人民医院伦理委员会审批。
1.2 研究方法
1.2.1 认知功能评估:采用MOCA进行评估,≥26分为认知功能正常,<26分为认知功能障碍。若受教育年限<12年,加1分进行校正。
1.2.2 血液学指标收集:入组当天收集所有研究对象血液学指标检测结果,包括总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL-C)、同型半胱氨酸(Hcy)、尿酸(UA)水平、血中性粒细胞计数(NE)、淋巴细胞计数(Lym)及中性粒细胞/淋巴细胞比值(NLR)。
1.2.3 头颅核磁数据采集与分析:头颅核磁共振数据采集自3.0T GE/Philips MRI-Flair序列扫描,通过视检来评估脑深部白质、脑皮层下及总Fazekas评分。
1.2.4 脑电图采集与分析:使用北京太阳公司数字脑电图检测仪(SOLAR2848B),采用盘状电极采集头皮脑电图数据。按照国际10-20标准系统安放19个头皮盘状电极(FP1、FP2、F3、Fz、F4、C3、Cz、C4、P3、Pz、P4、O1、O2、F7、F8、T3、T4、T5、T6)、接地电极(Fpz)及双侧耳电极(A1、A2)。设置采样频率1000 Hz,阻抗低于5 kΩ。在安静、清醒的状态下进行检测。受试者均需配合指令完成睁闭眼试验。脑电数据采集完成后,先对数据预处理:在Matlab2021a软件中使用eeglab工具包操作,包括滤波(高通0.5 Hz,低通128 Hz,陷波50 Hz和100 Hz)、去除坏通道,ICA去除伪迹(眼电、肌电、心电等),插值坏通道,全脑平均参考。对预处理后的脑电数据,在Matlab2021a软件中使用pwelch函数求取每个脑电通道的PSD。计算时,每个事件下每个通道依据等步长原则选取8段数据(每段10 s),计算每段10 s数据的PSD后对8段数据的PSD进行平均,将平均PSD数据再分成4个频率段,包括α频率段(8~14 Hz)、β频率段(14~25 Hz)、θ频率段(4~8 Hz)、δ频率段(0.5~4 Hz),对每个频率段下的PSD进行平均,作为量化脑电的特征数据。

2 结 果
2.1 三组一般资料、血液学指标及影像学指标比较 见表1。CSVCI组年龄高于HC组,受教育年限低于CSVD组和HC组(均P<0.05)。CSVCI组和CSVD组高血压占比高于HC组(均P<0.05)。三组血液学指标比较差异无统计学意义(均P>0.05)。CSVCI组脑室旁及总脑白质Fazekas评分高于CSVD组和HC组,且CSVD组高于HC组(均P<0.05)。此外,CSVCI组和CSVD组深部脑白质Fazekas评分高于HC组(均P<0.05)。

表1 三组一般资料、血液学指标及影像学指标比较
2.2 三组脑电PSD结果比较 见图1、2。三组α、δ、θ频段全脑PSD值比较差异有统计学意义(均P<0.05),在β频段比较则差异无统计学意义(均P>0.05)。组间两两比较可见,CSVCI组δ频段PSD值在FP1、FP2、F3、Fz、C3、Cz、P3、Pz、P4、O1、O2、T5、T6高于CSVD组(均P<0.05);CSVCI组θ频段PSD值在O1、O2高于CSVD组(均P<0.05);CSVCI组α频段PSD值除T4外的几乎全脑区低于CSVD组(均P<0.05);CSVCI组α频段PSD值在FP1、FP2、F3、Fz、F8、C3、C4、Pz、P4、O1低于HC组(均P<0.05);CSVD组δ频段PSD值在T4、Pz低于HC组(均P<0.05)。
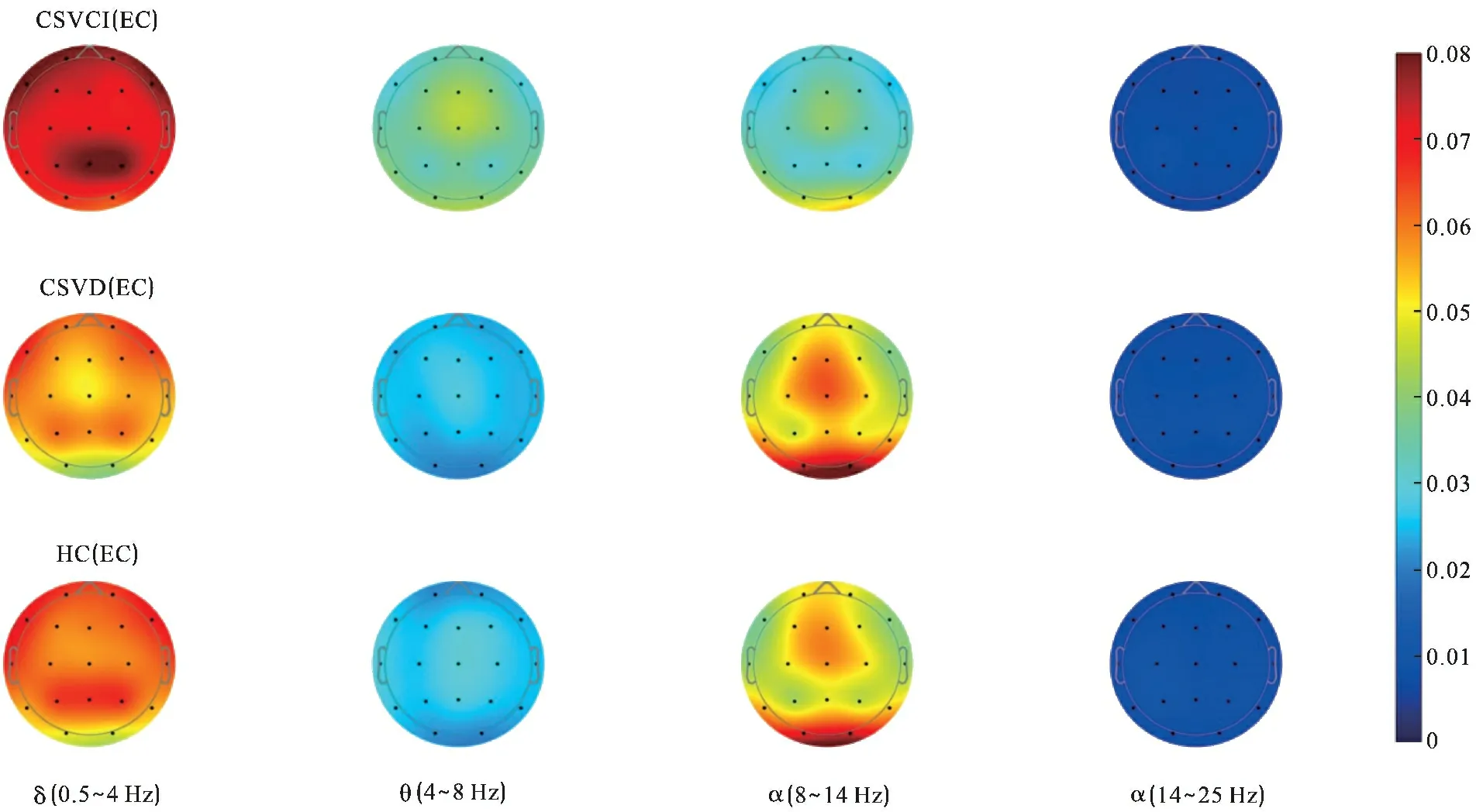
注:红色代表相应频段脑电功率(PSD)越高,蓝色代表相应频段脑电功率越低图1 三组全脑PSD拓扑图
2.3 CSVCI危险因素Logistic回归分析 见表2。以年龄(连续型变量)、性别(女性=1,男性=0)、高血压(有=1,无=0)、受教育年限(<10年=1,≥10年=0)、α频段PSD(<0.0432=1,≥0.0432=0)、δ频段PSD(<0.0074=1,≥0.0074=0)、脑室旁Fazekas评分、深部脑白质Fazekas评分和NLR(连续型变量)为自变量,以是否发生CSVCI(否=0,是=1)为因变量,进行Logistic回归分析。结果显示,受教育年限及α频段PSD减低与CSVCI发生呈正相关(均P<0.05)。

表2 CSVCI危险因素Logistic回归分析
2.4 不同频率段下全脑PSD值及影像学指标与MoCA评分相关性分析 见图3。α频段PSD值与MoCA评分呈正相关(r=0.363,P=0.004),而δ频段PSD值与MoCA评分呈负相关(r=-0.505,P<0.001);脑室旁Fazekas评分、深部脑白质Fazekas评分及总脑白质Fazekas评分与MoCA评分呈负相关(r=-0.331、-0.286、-0.319,P=0.009、0.026、0.012);NLR与θ频段全脑PSD呈正相关(r=0.475,P<0.001)。

注:图中两两指标交叉的单元格亮度越黄,表示相关性越强,*P<0.05图3 不同频率段下全脑PSD值及影像学指标与MoCA评分双变量相关性热图
3 讨 论
本研究旨在探讨CSVD患者发生认知功能障碍的PSD改变及其与NLR的关系。研究结果显示,CSVCI患者的PSD值主要表现为几乎全脑区δ活动增多,α活动减少,提示伴有认知功能障碍的CSVD患者脑电活动慢化。多因素Logistic回归结果表明,全脑α频段PSD值降低是CSVD患者发生认知障碍独立于脑白质高信号严重程度的危险因素。同时,相关性分析表明CSVD患者的MoCA评分与α频段PSD值呈正相关,而与δ频段PSD值呈负相关,且与脑白质高信号严重程度呈正相关,提示相关频段PSD值可能是潜在的辅助临床诊疗的客观指标。此外,相关性分析亦发现CSVD患者全脑θ频段PSD值与NLR呈正相关,提示NLR可能通过炎症机制引起脑电活动慢化并导致或加重认知障碍。
既往许多关于阿尔茨海默病(AD)患者和轻度认知功能障碍患者的研究中也发现慢频带(δ和θ)增加和快频带(α和β)振幅和功率的减少[15-16]。本研究结果与之一致。目前CSVD导致认知功能障碍的机制尚未完全阐明,推测可能是各种危险因素、遗传因素共同作用的结果。SRINIVASAN等[17]认为EEG可反映大脑皮质生理变化和功能改变,并能直接反映大脑皮质功能。α节律主要由丘脑皮层相互作用调节,促进或抑制感觉运动和认知信息在皮层下和皮层通路间的传递[18],因此CSVCI患者皮层节律的慢化可能与胆碱能通路受损有关,从而导致静息状态下皮层兴奋异常增加或去抑制。此外,MUSAEUS等研究[16]发现AD患者颞区δ频段功率与脑脊液总tau蛋白呈正相关,提示慢波增加可能与tau蛋白异常沉积相关。本研究发现的CSVCI患者δ频段PSD增高则可能提示CSVD患者发生认知障碍是由于某种原因导致tau蛋白异常沉积所致。而KIM等[19]的研究也支持这一假说,他们发现在皮层下血管性认知障碍的患者中CSVD评分和β-淀粉样蛋白与tau蛋白均独立相关。
本研究结果表明,Fazekas评分在CSVCI组更高,且在CSVD患者中Fazekas评分与MoCA评分呈负相关,提示CSVD严重程度本身会影响患者认知功能。然而值得注意的是,尽管F检验结果表明Fazekas评分在三组间比较差异有统计学意义,但多因素Logistic回归分析则表明只有α频段全脑PSD值减低与认知障碍发生呈正相关,而Fazekas评分与之无相关性,提示α频段全脑平均PSD值对CSVD患者发生认知障碍的影响独立于脑白质损害以外,在HC组中α及δ频段PSD值与Fazekas评分相关而在CSVD患者中两者无相关性,则从侧面提示了CSVD患者的脑功能改变可能独立于白质损伤,其机制可能与上述tau蛋白异常沉积相关。
RODRIGUEZ等[20]报道,简易智力状态检查量表(MMSE)评分与2.0~6.0 Hz的相对功率呈负相关,与6.5~12.0 Hz的双侧半球相对功率呈正相关。这与本研究结果基本一致,表明δ频段PSD增加和α频段PSD减少可能是早期神经功能衰退的一个临床标志。此外,应用经颅磁刺激干预AD患者的研究[21]表明,在干预半年后AD患者全脑α频段功率有轻度增加,且干预后α频段功率与MMSE评分呈正相关,提示神经调节治疗可能成为AD一个新的治疗手段,且α频段功率可能成为预测疗效的客观指标。与之类似,本研究发现CSVD患者α及β频段PSD值与MoCA评分的相关性亦提示其可能成为评价CSVD患者认知障碍严重程度的客观指标,且可能成为预测神经调节干预治疗疗效的客观指标。尤其是α频段全脑PSD值可能成为早期预测CSVD患者发生认知障碍的客观指标。
NLR为重要的炎症指标,近年来被证实与动脉粥样硬化性疾病及其危险因素关系密切[22-24]。近年亦有多项研究[10-13]表明NLR为CSVD的重要危险因素,并可能参与认知障碍发生的机制。此外,近年研究[25-26]证实,NLR与卒中后认知功能障碍的发生密切相关。这些证据表明NLR可能通过炎症机制影响脑血管病的严重程度及其认知障碍发生概率。本研究虽并未直接发现NLR与CSVD认知障碍间的关系,但相关性分析结果表明NLR与CSVD患者θ频段PSD有相关性,间接提示NLR可能通过炎症机制导致CSVD患者脑电慢化,并进一步导致或加重认知障碍。这提示对CSVD患者早期检测NLR并及时抗炎干预可能会改善其认知预后。
综上所述,CSVD患者脑电活动慢化可能是其发生认知障碍的早期标志,其机制可能与tau蛋白沉积及炎症反应相关,并且CSVD患者α及δ频段PSD值可能成为评估临床严重程度及预测干预治疗疗效的客观指标,尤其是α频段全脑PSD值可能成为CSVD患者独立于影像学指标外的认知障碍发生的早期预测因子。此外,NLR可能作为早期CSVD患者脑电慢化的预测指标,亦有预测认知障碍的潜力。然而,对本研究结果的解释必须考虑到以下局限性:首先,本研究仅为单中心、小样本的横断面预实验,且三组间基线资料并不完全匹配,虽然研究通过统计学方法进行了校正,但仍不能完全消除偏移,结果的推广性仍需大样本、多中心的前瞻性观察研究来进一步证实。其次,本研究中应用的脑电分析方法为较基础的功率谱分析,仅能体现局部某段时间内平均脑功能活动强度,对于不同脑区间的功能联系、不同时间脑功能动态变化不能准确体现,进一步的研究可以应用小波转换、非线性脑电分析、复杂度熵等方法来全面表征其脑功能改变。最后,影像学资料的不全导致研究并未将CSVD总负担作为协变量进行校正分析,研究结果可能受到CSVD除白质高信号外其他病变严重程度的不同影响,进一步的研究可以结合多模态神经影像方法,更深入地探讨其脑功能改变,提高CSVCI诊断的敏感度及特异度,以便实现CSVCI早发现、早诊断和早治疗。
