姜黄素对磨损颗粒诱导的体外破骨细胞的作用及机制实验研究
2024-03-13刘子歌王文鹏陈德胜
刘子歌,袁 昂,王文鹏,陈德胜
(1.广西医科大学临床医学院,广西 南宁 530020;2.宁夏回族自治区人民医院骨科,宁夏 银川 750002)
无菌性松动是人工全关节置换术后常见的长期并发症,也是手术翻修的主要原因之一[1]。研究[2-4]表明,无菌性松动主要源于人工关节接触面之间的相互移动摩擦,导致产生微小的磨损颗粒,磨损颗粒会被界面之间的巨噬细胞所吞噬,同时被激活释放大量的炎性介质,这些细胞因子能激发破骨细胞产生骨吸收,造成假体周围骨组织的溶解,即种植体周围骨溶解 (Peri-implant osteolysis,PIO),最终导致无菌性松动。研究[4]发现,无菌性松动患者的免疫系统在这一过程中发挥了重要作用,人工关节产生的磨损颗粒可引发免疫系统的免疫反应,从而加剧炎症。此过程包括T细胞和B细胞的激活,由此产生更多的炎症因子,如肿瘤坏死因子-α(Tumor necrosis factor-α,TNF-α)、白细胞介素(Interleukin,IL)-1β、IL-6、前列腺素E2 (Prostaglandin E2,PGE2)等。免疫系统的参与不仅加剧了炎症反应,还可能影响骨组织的局部免疫调节,导致骨组织损伤,导致PIO和无菌性松动[5]。
姜黄素(Curcumin,Cur)是一种天然的生物活性化合物,主要存在于姜、肉桂、胡椒等食物中[6]。研究表明Cur具有多种益处,包括抗氧化、抗炎和抗肿瘤作用。Cur被认为可以通过干预细胞信号通路,降低炎症反应。有研究指出,Cur可以促进成骨细胞的发育和功能,同时抑制破骨细胞的生成。这意味着Cur可能有助于保护骨骼和延缓骨关节疾病的进展[7]。基于这些发现,我们猜测Cur也可能对人工关节无菌性松动问题产生积极的影响。为了验证这一假设,本研究探索Cur对磨损颗粒诱导的破骨细胞生成及功能的影响,并通过检测核因子-κB(Nuclear factor-κB,NF-κB)信号通路来揭示其潜在的分子机制。
1 材料与方法
1.1 实验细胞与主要试剂 小鼠巨噬细胞株RAW264.7购自中国科学院上海细胞库。达尔伯克氏改良伊格尔氏培养基(DMEM)高糖培养基(货号:21331046)、胎牛血清(货号:10099141C)购自美国Gbico公司;商品纯化钛(Ti)颗粒(货号:7440-32-6)购自美国Alfa Aesar公司;Cur (货号:458-37-7)购自美国MCE公司;抗酒石酸酸性磷酸酶(TRAP)染色试剂盒(货号:42010102)购自美国Sigma公司;TNF-α(货号:bsk12002)、IL-1β(货号:bsk12015)、基质金属蛋白酶(MMP)-9(货号:bsk12013) ELISA试剂盒购自北京博奥森生物技术公司;细胞计数(CCK-8)试剂盒(货号:KGA317)购自江苏凯基生物技术公司;Prime Script RT reagent Kit Perfect Real Time RNA反转录试剂盒(货号:RR037Q)、Ultra SYBR One Step RNA PCR Kit荧光定量PCR试剂盒(货号:RR064A)购自日本Takara生物公司;β-actin抗体(货号:4967S)、p-p65(货号:3033S)、磷酸化NF-κB抑制蛋白α(p-IκBα)(货号:2859S)购自美国Cell Signaling公司;鬼笔环肽染色试剂(货号:G1248-100T)购自武汉塞维尔公司。
1.2 实验方法
1.2.1 钛颗粒准备:使用扫描电镜检查钛颗粒的尺寸和直径,以确保实验所需的钛颗粒符合要求。将钛颗粒在180 ℃下焙烤6 h,然后浸泡在75%乙醇中,在水平摇床上摇动48 h。随后离心处理,收集钛颗粒并加入磷酸盐缓冲液(PBS),进行高温、高压处理以再次确保无菌。使用PBS将高压灭菌后的钛颗粒重新悬浮。进行内毒素检测,确保内毒素含量低于0.1 EU/ml,使Ti颗粒适用于细胞实验。最终,实验所使用的Ti颗粒浓度为0.1 mg/ml[8]。
1.2.2 CCK-8细胞增殖实验:将RAW264.7细胞以5000个/孔的密度接种到96孔板中。加入不同浓度的Cur(0、1、5、10、15、20、30 μmol/L)进行干预。持续培养72 h后,加入10 μlCCK-8溶液,使用酶标仪在450 nm波长处测量吸光度值(A)。细胞增殖率(%)=[A(加药)-A(空白)]/[A(未加药)-A(空白)]×100%。以0 μmol/L浓度作为空白组,以确定RAW264.7细胞在没有Cur干预情况下的基础增殖率。后续选择对RAW264.7细胞正常增殖没有毒性效应的Cur浓度作为干预浓度。
1.2.3 细胞培养及分组:将RAW264.7细胞置于含有10%胎牛血清的DMEM培养基中,在5% CO2、37 ℃细胞培养箱中培养。将细胞分为空白组(完全培养基)、模型组(空白组+Ti 0.1 mg/ml)、低浓度Cur组(模型组+Cur 1 μmol/L)、中浓度Cur组(模型组+Cur 10 μmol/L)、高浓度Cur组(模型组+Cur 15 μmol/L)。
1.2.4 TRAP染色:将RAW264.7细胞以1×104个/孔接种于6孔板中,待细胞贴壁后按1.2.2方法分组处理,共培养5 d。然后用4%多聚甲醛固定细胞。加入TRAP染液在37 ℃生物培养箱中避光孵育1 h,碱性液冲洗干净并晾干,在光镜下观察并计数。TRAP染色阳性的破骨细胞通常为体积大、多核且胞浆中通常含有紫红色颗粒的细胞。
1.2.5 鬼笔环肽染色:固定前操作同1.2.4。0.1% Triton X-100穿膜5 min,加入鬼笔环肽染色液在37 ℃生物培养箱中避光孵育2 h。DAPI室温染色细胞核 5 min。冲洗干净后封片,在荧光显微镜下观察并计数。鬼笔环肽染色用于标记和可视化破骨细胞内的肌动蛋白纤维(F-actin)。F-actin是肌动蛋白的一种聚合物,在破骨细胞中具有关键的作用,阳染细胞通过荧光的强度与F-actin环的大小判断相关破骨细胞的骨吸收功能的强弱。
1.2.6 ELISA实验:将RAW264.7细胞以5×103个/孔接种于96孔板中,5 d后收集细胞培养上清,以160 r/min离心以去除Ti颗粒和细胞。按照ELISA试剂盒说明书步骤检测细胞培养上清液中TNF-α、IL-1β、MMP-9蛋白含量。
1.2.7 Western blot实验:各组细胞培养5 d后提取蛋白,使用BCA蛋白定量试剂进行蛋白定量。配置12%分离胶溶液,每孔添加50 μg蛋白样本。使用SDS-PAGE电泳技术进行蛋白分离,然后转移到硝酸纤维素膜(NC膜)上。NC膜上的蛋白质用5%牛血清白蛋白(BSA)封闭1 h。将p-p65(1∶1000稀释)和p-IκBα(1∶1500稀释)的一抗进行冷藏过夜处理。将二抗(1∶10000稀释)在室温下孵育2 h。采用Image J软件对图像进行分析。
1.2.8 PCR实验:各组细胞培养5 d后,按照TRIzol试剂说明书提取总RNA。用反转录试剂盒将总RNA反转录成cDNA,放入反转录仪中进行反转录反应,检测TRAP、TNF-α、活化 T 细胞核因子 1 (NFATc1)、IL-1β mRNA。以β-actin为内参,引物序列见表1。

表1 各基因引物序列

2 结 果
2.1 不同浓度Cur对小鼠RAW264.7巨噬细胞增殖活性的影响 见图1。CCK-8结果显示,Cur浓度小于15 μmol/L对RAW264.7巨噬细胞增殖活性的影响与空白组比较无统计学差异(均P>0.05),20、30 μmol/L Cur干预下RAW264.7细胞增殖率显著性下降(均P<0.05)。因此,采用不高于15 μmol/L Cur进行后续实验。
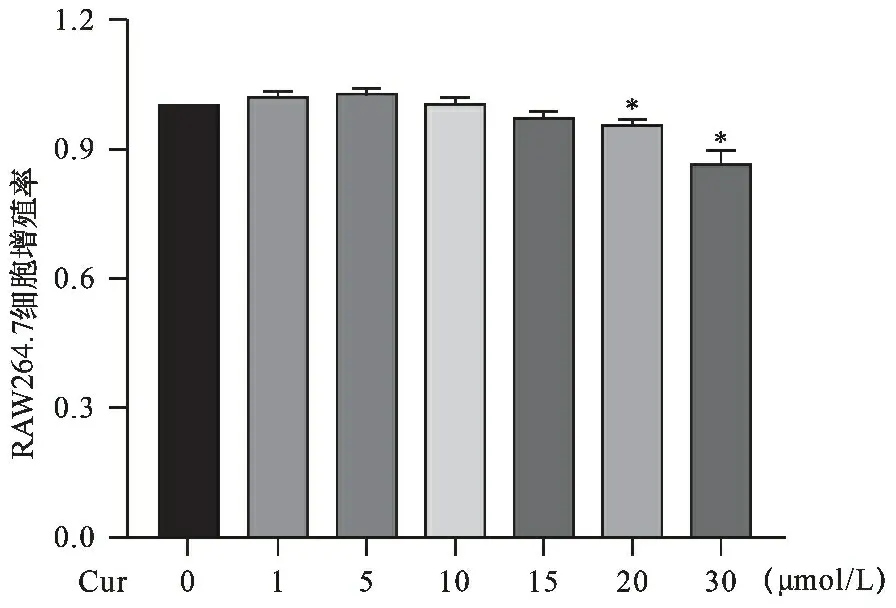
注:与空白组(0 μmol/L)比较,*P<0.05图1 不同浓度Cur对RAW264.7巨噬细胞增殖活性的影响
2.2 不同浓度Cur对小鼠RAW264.7细胞分化的破骨细胞数目的影响 见图2。TRAP染色结果显示,模型组可观察到许多体积较大、酒红色、内含多个细胞核的破骨细胞。给予不同浓度Cur干预后,染色呈阳性的破骨细胞数目随着药物浓度的增加而减少。进一步在显微镜下计数TRAP阳性细胞,空白组未检出,模型组成熟破骨细胞数量为(145.31±7.87)个,低、中、高浓度Cur组TRAP阳性细胞数量分别为(139.76±5.63) 个、(87.63±4.12)个和(45.51±3.65)个。中、高浓度Cur组TRAP阳性细胞数量低于模型组(均P<0.05) 。

图2 不同浓度Cur干预5 d后各组破骨细胞TRAP染色结果(×200)
2.3 不同浓度Cur对破骨细胞环形成的抑制效应 见图3。在模型组中观察到了少量较大且呈绿色的F-actin环包围着多核细胞,而细胞核则被DAPI染成蓝色。此外,在细胞膜上观察到一些伪足。在低、中浓度Cur组中,肌动蛋白骨架的环相对于模型组有所减少,且细胞核数量减少。而在高浓度Cur组中,多核细胞数量明显减少。

图3 不同浓度Cur对破骨细胞环形成的抑制效应(鬼笔环肽染色,×200)
2.4 不同浓度Cur对破骨细胞TNF-α、IL-1β和MMP-9表达的影响 见图4。与模型组比较,不同浓度Cur组TNF-α、IL-1β和MMP-9表达降低(均P<0.05)。

注:与模型组比较,*P<0.05图4 不同浓度Cur对破骨细胞RAW264.7细胞TNF-α、IL-1β和MMP-9表达的影响
2.5 不同浓度Cur对破骨细胞p-IκBα和p-p65蛋白表达的影响 见图5。与模型组比较,低浓度Cur组、中浓度Cur组、高浓度Cur组p-IκBα和p-p65蛋白表达降低(均P<0.05)。

注:与模型组比较,*P<0.05图5 不同浓度Cur对p-IκBα和p-p65蛋白表达的影响
2.6 不同浓度Cur对破骨细胞TRAP、TNF-α、IL-1β和NFATc1 mRNA表达的影响 见图6。与模型组比较,不同浓度Cur组TRAP、TNF-α、IL-1β和NFATc1 mRNA表达降低(均P<0.05) 。
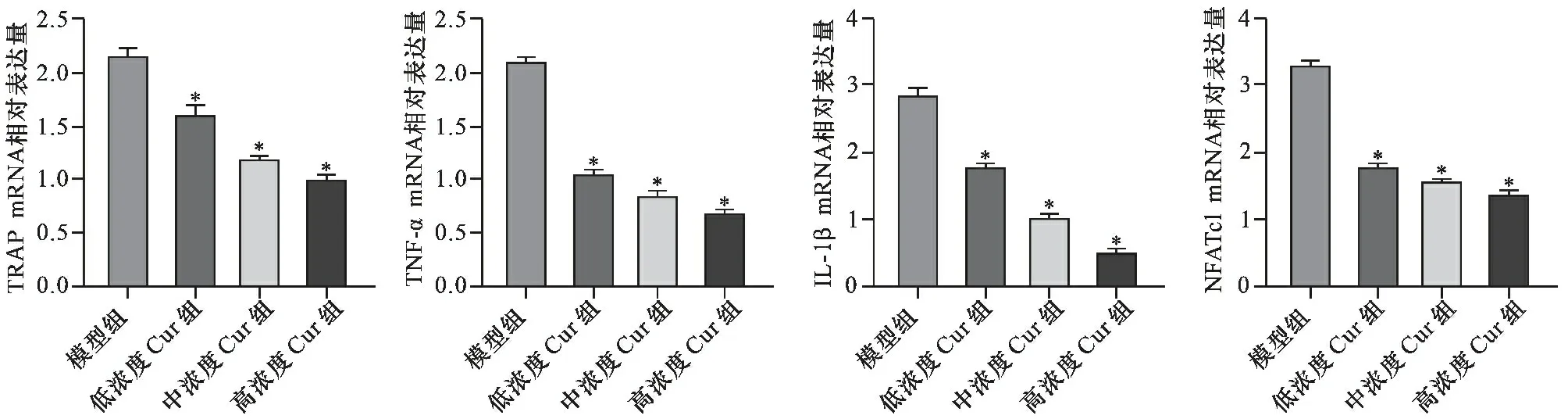
注:与模型组比较,*P<0.05图6 不同浓度Cur对破骨细胞TRAP、TNF-α、IL-1β和NFATc1 mRNA表达的影响
3 讨 论
研究[9]表明,骨溶解与过度活跃的破骨细胞和骨吸收密切相关。目前的研究发现,磨损颗粒的摩擦通常引发炎症反应,破坏了机体内部骨吸收和骨形成之间的平衡,这是PIO的典型特征。虽然多种细胞类型参与这一病理过程,但破骨细胞是引起骨丢失和导致假体松动的主要骨降解细胞。一般来说,磨损颗粒主要由假体表面互相摩擦产生,在人工关节中这些磨损颗粒通常是金属碎片或超高分子量聚乙烯颗粒。这些颗粒会引起免疫细胞(包括巨噬细胞和T淋巴细胞)聚集到骨-种植体界面,触发一系列促炎细胞因子的释放,从而加速周围炎性微环境的形成[10]。在这些炎症介质中,巨噬细胞集落刺激因子(M-CSF)和NF-κB受体活化因子配体(RANKL)在激活破骨细胞过程中起着关键作用。M-CSF促进单核/巨噬细胞生长和分化成破骨细胞前体细胞。一旦RANKL与破骨细胞前体细胞表面RANKL结合,就会激活下游信号传导通路,主要包括NF-κB信号通路,导致成熟的破骨细胞分化和随后的骨吸收活动[11]。因此,干预破骨细胞的主要信号通路有望成为治疗PIO的有效策略。
本研究使用的RAW264.7细胞是一种常用于炎症和免疫相关研究的小鼠巨噬细胞系,通常用于研究巨噬细胞的生物学特性、免疫反应以及与疾病相关的机制。这些细胞可在体外模拟炎症反应,特别是与炎症相关的细胞因子产生和巨噬细胞活性。在骨科研究中通常使用RAW264.7细胞来诱导它们分化为破骨细胞,然后研究破骨细胞的分化、功能以及它们与骨骼健康和疾病之间的关系。这些研究有助于深入了解骨骼代谢、骨质疏松症、骨折愈合等方面的生物学过程,从而为骨科研究和治疗提供了重要的信息。Cur是一种存在于多种植物中的天然化合物。近期研究表明Cur具有多种有益的潜在作用,包括心血管健康和癌症预防。尽管如此,这些保护机制尚未得到详尽的探讨。有研究[12-13]表明,其中一个可能的保护机制是通过下调炎症反应。这种下调包括抑制促炎介质的合成和释放,影响二十烷类化合物的产生从而抑制某些免疫细胞的激活,也可通过Cur对NF-κB或激活蛋白1等转录因子的抑制作用减少促炎介质的合成[14]。这一机制可能有助于解释Cur在多种疾病中的潜在益处,但仍需要进一步的研究来阐明其细节和潜在应用。
本研究采用磨损颗粒诱导的体外破骨细胞形成模型,以验证Cur在PIO中的作用。为了排除Cur通过对RAW264.7细胞产生毒性作用来影响破骨细胞形成的可能性,我们首先对RAW264.7细胞进行了不同浓度Cur的处理,持续72 h,以评估Cur的细胞毒性水平。实验结果表明,小于等于15 μmol/L Cur对RAW264.7细胞的增殖没有影响,因此我们选择了不高于15 μmol/L Cur作为后续实验的干预浓度。
骨吸收标志酶TRAP通常被用来鉴定成熟的破骨细胞,具有3个或以上细胞核并且TRAP染色呈阳性(酒红色)的细胞被识别为破骨细胞[15]。本研究通过TRAP染色实验证实了不同浓度Cur对RAW264.7细胞向破骨细胞的分化产生了影响。随着Cur浓度的增加,染色呈阳性的破骨细胞数量减少,这表明Cur可以抑制了体外破骨细胞的成熟。此外,F-actin环的形成被认为是破骨细胞发挥骨吸收功能的前提条件[16]。因此,本研究进行了鬼笔环肽染色实验,以评估Cur对F-actin环形成的影响,结果与TRAP染色结果一致,模型组显示出大且清晰的F-actin环。然而,在Cur干预后,F-actin环的大小随着Cur浓度的增加而减小。综合TRAP的结果,我们认为Cur在体外能够抑制破骨细胞的功能和成熟度,并且这种抑制与Cur浓度呈正相关。
炎性骨溶解所诱导的炎性反应主要是通过磨损颗粒自身刺激巨噬细胞、成纤维细胞、成骨细胞及T淋巴细胞等分泌大量的TNF-α、IL-1β和IL-6炎性因子引起[17]。本研究用ELISA实验检测了模型中第5天上清培养液中TNF-α、IL-1β和MMP-9的表达量,显示Cur能够显著抑制上述炎症因子的表达,进一步证实Cur具有良好的抗炎效果。以前的研究已经证明活化NFATc1和TRAP,对破骨细胞的形成和激活至关重要[18]。NFATc1是RANKL诱导的破骨细胞分化的主要调节剂,并且通过上调负责破骨细胞黏附、迁移、酸化以及无机和有机骨基质降解的各种基因。RANKL与RANK的结合导致肿瘤坏死因子受体相关因子6(TRAF6)的募集,并导致下游分子如NF-κB和c-Jun的活化。NFATc2和NF-κB的协同作用激活了NFATc1,c-Jun信号与核因子相关的T细胞(NFAT)协同作用对RANKL调控的破骨细胞分化起到重要作用[19]。NFATc1转录因子常以高度磷酸化形式存在于细胞质中,当受到Ca2+刺激后,去磷酸化的NFATc1可以导致一系列破骨细胞特异性基因如MMP-9、TRAP、组织蛋白酶 K等的表达[20-23]。本研究PCR结果表明,Cur可显著降低 NFATc1、TRAP mRNA的表达,表明Cur不仅可以影响 NFATc1 的表达,也可以影响其下游因子的表达。IκBα作为IκB家族中最重要的成员之一,调控NF-κB细胞通路中关于机体免疫与炎症的途径,其与p65/p50二聚体结合后活性将受到抑制[24-26]。本研究最后检测了Cur处理后IκBα和p65磷酸化蛋白的表达,显示Cur可能通过影响IκBα和p65磷酸化抑制了Ti颗粒诱导的小鼠RAW264.7巨噬细胞中NF-κB通路的活化。
综上所述,磨损颗粒可能通过NF-κB的激活参与PIO和人工关节无菌性松动。Cur对体外磨损颗粒诱导的破骨细胞生成和破骨细胞功能有抑制作用,其抑制作用的机制可能是抑制NF-κB信号通路。因此,Cur可能是治疗假体磨损颗粒引起的骨溶解的一种潜在治疗药物。
