LncRNA GNAS-AS1通过调节miR-449a/Notch1轴参与胃癌细胞的增殖和迁移
2024-03-13徐俐胡珊珊赵海明
徐俐 胡珊珊 赵海明
四川省医学科学院·四川省人民医院(电子科技大学附属医院)消化内科 (成都 610000)
胃癌(gastric cancer,GC)致死率较高,在全球因癌死亡主要原因中排第2位,其中约有40%的GC患者在中国,严重威胁人们的身体健康和生存质量[1-2]。由于早期GC几乎没有任何症状,约70%以上的患者在诊断时病程已进入晚期,这给后续治疗造成了巨大挑战[3]。GC的发病机制复杂,涉及因素较多,因此,探索GC的病理机制和新的治疗靶点对提高治疗效果、抑制肿瘤进展具有重要意义。长链非编码RNA(long non-coding RNA,LncRNA)是多种癌症的潜在生物标志物和治疗靶点,能参与癌细胞增殖、凋亡、血管生成等多种生物学过程[4-5]。GNAS反义RNA1(GNAS antisense RNA 1,GNASAS1)是GNAS的基因转录本之一,位于人类染色体20q13.3,研究发现GNAS-AS1能够促进乳腺癌、卵巢癌、肺癌等肿瘤的发展进程[6-7]。miR-449a在含GC在内的多种癌症中出现异常低表达,且具有治疗潜能,发挥着肿瘤抑制作用[8]。缺刻基因1(Notch1)属于跨膜受体家族Notch,Notch信号通路中蛋白的异常表达与多种癌症如非小细胞肺癌、GC的发展密切相关[9]。但GNAS-AS1与GC中miR-449a/Notch1轴之间的关系仍有待进一步研究。本研究探究GNAS-AS1对GC细胞AGS增殖、迁移的影响。
1 材料与方法
1.1 一般资料收集四川省人民医院2013年9月至2017年9月30例GC患者肿瘤组织及癌旁组织标本。所有参与患者均需排除同时患有其他癌症的可能性。所获取全部人体标本均事先经患者或其委托人签署知情同意书,并获得四川省人民医院伦理委员会的批准。
1.2 细胞GC细胞株AGS购自于中国科学院上海生命科学研究院。
1.3 主要试剂与仪器胰蛋白酶、Lipofectamine 2000购自美国Thermo Fisher公司;MTT试剂盒购自碧云天生物技术有限公司;Trizol试剂、RIPA裂解液购自美国Invitrogen公司;Transwell小室,美国Corning公司;Notch1、E-cadherin、Vimentin、Ncadherin、GAPDH一抗和相应二抗购自Affinity公司;si-GNAS-AS1、si-NC、miR-449a inhibitor、inhibi⁃tor NC,上海吉玛制药技术有限公司;双荧光素酶报告基因检测试剂盒,上海钰博生物科技有限公司。RT-qPCR仪购自美国Applied Biosystems公司;酶标仪(美国BioTek公司)。
1.4 细胞培养在37 ℃加5% CO2的湿空气中,AGS细胞在RPMI-1640中培养。培养基中添加10%胎牛血清和抗生素(青霉素100 U/mL、链霉素100 mg/mL)。
1.5 细胞分组与处理AGS细胞接种到6孔板(3 × 105个/孔),贴壁后分为si-GNAS-AS1组(转染si-GNAS-AS1)、si-NC组(转染si-NC)、si-GNASAS1+miR-449a inhibitor组(共转染si-GNAS-AS1与miR-449a inhibitor)、si-GNAS-AS1+inhibitor NC组(共转染si-GNAS-AS1与inhibitor NC)、对照组(Control组,不转染)。转染过程按照Lipofectamine 2000转染试剂盒的制造商说明进行,共转染48 h。
1.6 RT⁃qPCR测定GNAS⁃AS1、miR⁃449a和Notch1 mRNA表达用Trizol试剂从组织或培养AGS细胞中提取总RNA,程序按照提供的指南执行。然后通过逆转录试剂盒将分离的总RNA逆转录成cDNA。使用RT-qPCR仪,结合TransStart Top Green qPCR Super Mix进行PCR扩增。使用2-ΔΔCt法进行数据量化,以GAPDH为内参,分析GNAS-AS1和Notch1 mRNA表达水平;以U6为内参,分析miR-449a表达水平。RT-qPCR确切的引物序列见表1。

表1 引物设计序列Tab.1 Primers design sequence
1.7 MTT法检测细胞增殖能力取对数期AGS细胞以密度5 × 103个/孔接种在96孔板中,按1.5方法进行分组与处理。孵育48 h,弃去上层培养基,每孔加入20 μL MTT溶液,37 ℃孵育4 h。吸取上清液,每孔添加150 μL甲臜增溶溶液,于振荡器上振荡10 min,使甲臜全部溶解。在490 nm处测定各样品吸光度(OD490)。
1.8 平板克隆形成实验测量细胞增殖将AGS细胞(1 × 103/孔)接种于6孔板,培养2周,固定后用结晶紫染色。人工计数>30个细胞形成的菌落。
1.9 wound healing法测定细胞迁移AGS细胞接种在6孔板(1 × 105个/孔)。当细胞融合约80%时,用200 μL移液枪尖端进行划痕,分别在0 h和48 h观察记录细胞迁移情况,并用Image J计算划痕愈合率。以0 h和48 h划痕宽的差值与0 h划痕宽的百分比表示划痕愈合率。
1.10 Transwell法测定细胞侵袭Transwell小室的基底膜预涂Matrigel,37 ℃过夜。将AGS细胞重悬(1 × 105个/mL),并添加到Transwell上腔,添加10%胎牛血清的RPMI-1640培养基接种于下腔。孵育1 d后,用棉签轻轻清洁上腔过滤器上表面的细胞。然后,将滤光片固定在4%多聚甲醛中,并用0.1%结晶紫染色。PBS洗涤3次后,对穿过滤光片的细胞进行成像,在显微镜下随机计数5次,计算浸润细胞的数量。
1.11 Western Blot测定蛋白Notch1、Vimentin、E⁃cadherin、N⁃cadherin表达在RIPA裂解液中冰孵育AGS细胞30 min后,细胞在4 ℃下离心15 min(10 000 ×g)。用BCA试剂盒测定蛋白浓度。然后用SDS-PAGE分离蛋白,转移到聚偏二氟乙烯膜上1 h。用5%脱脂奶粉在室温阻断1 h。加入1∶1 000稀释的Notch1、E-cadherin、Vimentin、N-cadherin、GAPDH一抗,在4 ℃下保存过夜。在3次洗膜后,用各自的二抗(1∶5 000)室温孵育2 h。膜用ECL试剂孵育以观察蛋白质。使用Image Lab™进行免疫印迹定量。
1.12 双荧光素酶报告基因实验TargetScan预测miR-449a与GNAS-AS1和Notch1的位点结合。通过将含有预测miR-449a结合位点的GNAS-AS1 cDNA克隆到pmirGLO双荧光素酶miRNA靶表达载体中,构建GNAS-AS1-WT荧光素酶报告载体。通过在miR-449a结合位点插入含有点突变的突变体GNAS-AS1,生成GNAS-AS1-MUT载体。同样,将野生型和突变型Notch1 3′-UTR片段克隆到pmirGLO载体中,构建Notch1-WT和Notch1-MUT荧光素酶报告载体。用Lipofectamine 2000在AGS细胞中转染miR-449a mimic或miR-NC与报告载体48 h,使用荧光测定仪测量荧光素酶活性。
1.13 统计学方法Graphpad Prism 7.0用于统计分析,计量数据以均数±标准差()表示。采用单因素方差分析(3组及以上)、t检验(两组)确定统计学显著性,LSD-t用于单因素方差分析后的两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 GNAS⁃AS1、miR⁃449a和Notch1 mRNA在GC组织中的表达比较肿瘤组织与癌旁组织相比,GNAS-AS1、Notch1 mRNA表达升高(P<0.05),miR-449a表达降低(P<0.05)。见表2。
表2 肿瘤组织与癌旁组织中GNAS-AS1、miR-449a和Notch1 mRNA的表达比较Tab.2 Comparison of GNAS-AS1,miR-449a and Notch1 mRNA expression in tumor tissues and adjacent tissues ±s,n = 30
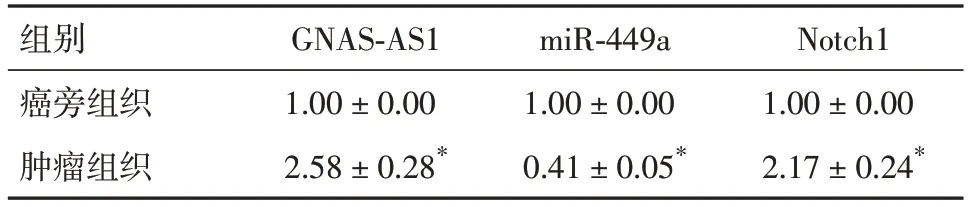
表2 肿瘤组织与癌旁组织中GNAS-AS1、miR-449a和Notch1 mRNA的表达比较Tab.2 Comparison of GNAS-AS1,miR-449a and Notch1 mRNA expression in tumor tissues and adjacent tissues ±s,n = 30
注:与癌旁组织相比,*P<0.05
组别癌旁组织肿瘤组织Notch1 1.00±0.00 2.17±0.24*GNAS-AS1 1.00±0.00 2.58±0.28*miR-449a 1.00±0.00 0.41±0.05*
2.2 GNAS⁃AS1、miR⁃449a和Notch1 mRNA在AGS细胞中的表达比较si-GNAS-AS1组相较于si-NC组、Control组,GNAS-AS1和Notch1 mRNA下调表达,miR-449a上调表达(P<0.05)。si-GNASAS1+miR-449a inhibitor组相较于si-GNAS-AS1+in⁃hibitor NC组、si-GNAS-AS1组,Notch1 mRNA表达升高,miR-449a表达降低(P<0.05),GNAS-AS1表达没有明显变化(P>0.05)。见表3。
表3 各组AGS细胞中GNAS-AS1、miR-449a和Notch1 mRNA的表达比较Tab.3 Comparison of mRNA expression of GNAS-AS1,miR-449a and Notch1 in AGS cells of each group ±s,n = 6

表3 各组AGS细胞中GNAS-AS1、miR-449a和Notch1 mRNA的表达比较Tab.3 Comparison of mRNA expression of GNAS-AS1,miR-449a and Notch1 in AGS cells of each group ±s,n = 6
注:*P<0.05 vs.Control组;#P<0.05 vs.si-NC组;&P<0.05 vs.si-GNAS-AS1组;^P<0.05 vs.si-GNAS-AS1+inhibitor NC组
组别Control组si-NC组si-GNAS-AS1组si-GNAS-AS1+inhibitor NC组si-GNAS-AS1+miR-449a inhibitor组Notch1 1.00±0.00 1.02±0.12 0.45±0.05*#0.43±0.04 0.86±0.09&^GNAS-AS1 1.00±0.00 1.01±0.12 0.36±0.04*#0.34±0.04 0.35±0.04 miR-449a 1.00±0.00 1.02±0.11 2.25±0.24*#2.23±0.24 1.62±0.18&^
2.3 各组细胞活力(OD490)的比较si-GNAS-AS1组OD490值低于Control组、si-NC组(P<0.05);si-GNAS-AS1+miR-449a inhibitor组OD490值高于si-GNAS-AS1组、si-GNAS-AS1+inhibitor NC组(P<0.05)。见表4。
表4 各组细胞OD490、划痕愈合率、克隆形成数和细胞侵袭数目的比较Tab.4 Comparison of OD490,scratch healing rate,number of clone formation and number of cell invasion in each group ±s,n=6
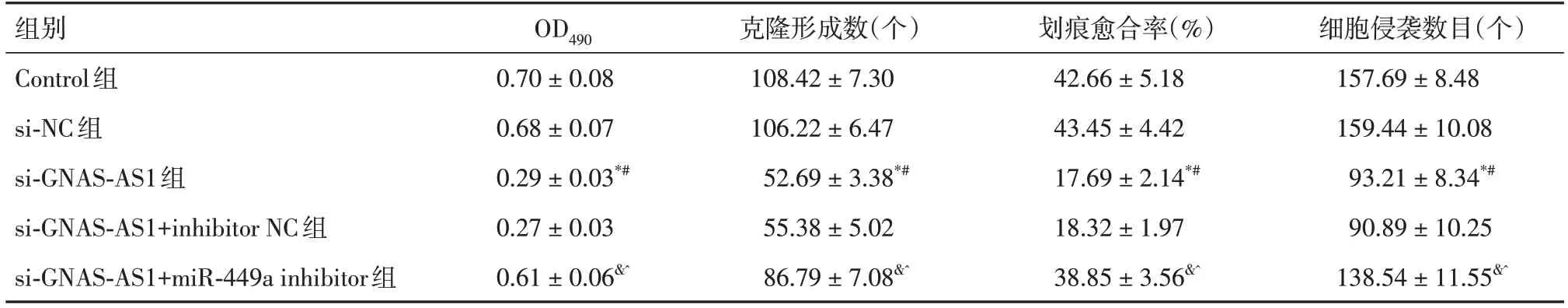
表4 各组细胞OD490、划痕愈合率、克隆形成数和细胞侵袭数目的比较Tab.4 Comparison of OD490,scratch healing rate,number of clone formation and number of cell invasion in each group ±s,n=6
注:*P<0.05 vs.Control组;#P<0.05 vs.si-NC组;&P<0.05 vs.si-GNAS-AS1组;^P<0.05 vs.si-GNAS-AS1+inhibitor NC组
组别Control组si-NC组si-GNAS-AS1组si-GNAS-AS1+inhibitor NC组si-GNAS-AS1+miR-449a inhibitor组细胞侵袭数目(个)157.69±8.48 159.44±10.08 93.21±8.34*#90.89±10.25 138.54±11.55&^OD490 0.70±0.08 0.68±0.07 0.29±0.03*#0.27±0.03 0.61±0.06&^克隆形成数(个)108.42±7.30 106.22±6.47 52.69±3.38*#55.38±5.02 86.79±7.08&^划痕愈合率(%)42.66±5.18 43.45±4.42 17.69±2.14*#18.32±1.97 38.85±3.56&^
2.4 各组细胞克隆形成数比较si-GNAS-AS1组的克隆形成数低于Control组、si-NC组(P<0.05);si-GNAS-AS1+miR-449a inhibitor组的克隆形成数高于si-GNAS-AS1组、si-GNAS-AS1+inhibitor NC组(P<0.05)。见表4、图1。
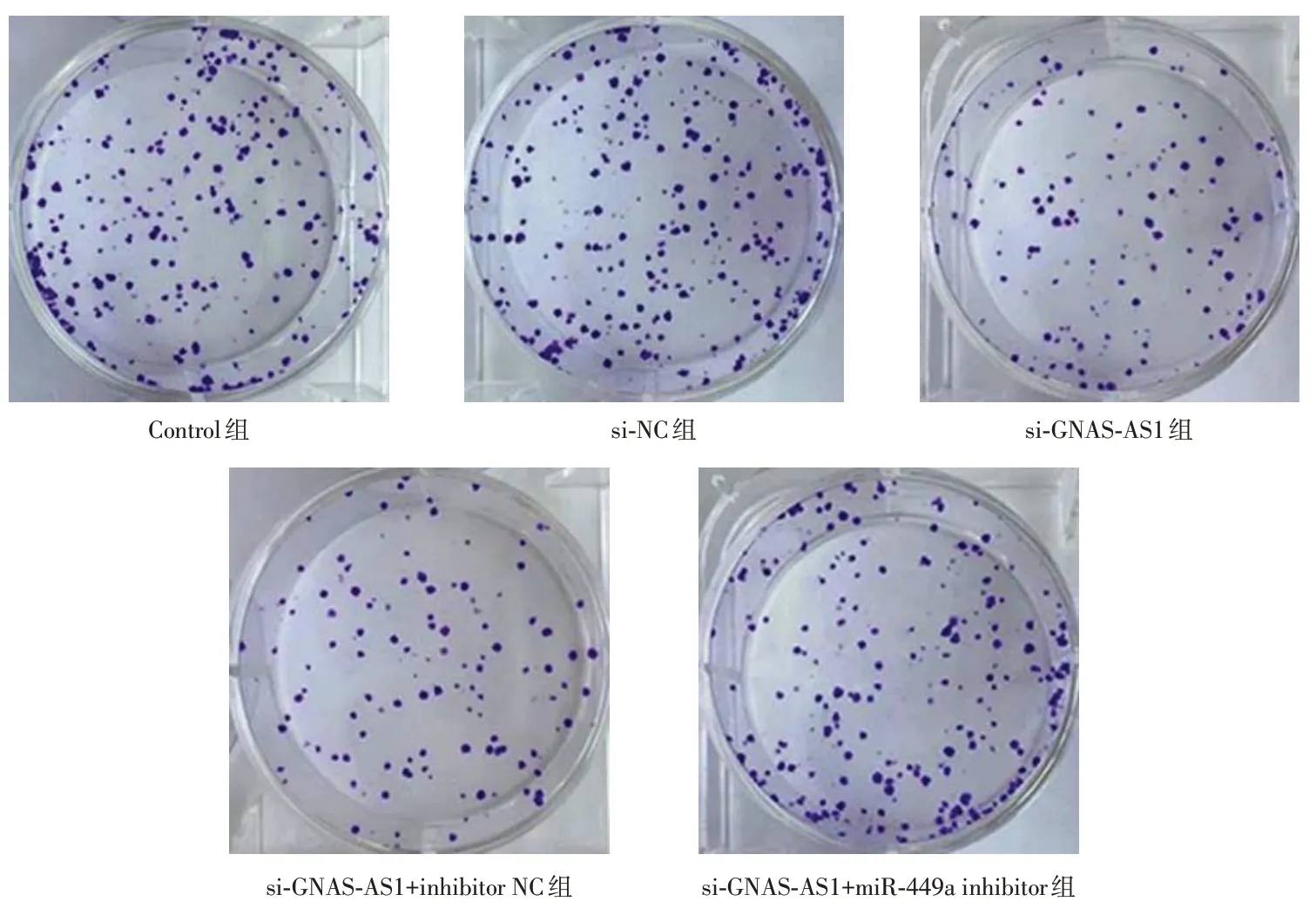
图1 细胞克隆形成观察Fig.1 Observation of cell clonal formation
2.5 各组划痕愈合率比较si-GNAS-AS1组划痕愈合率低于si-NC组、Control组(P<0.05);si-GNAS-AS1+miR-449a inhibitor组划痕愈合率高于si-GNAS-AS1+inhibitor NC组、si-GNAS-AS1组(P<0.05)。见表4和图2。

图2 wound healing实验检测AGS细胞迁移能力Fig.2 Migration ability of AGS cells was detected by wound healing experiment
2.6 各组细胞侵袭能力的比较si-GNAS-AS1组细胞侵袭数目少于si-NC组、Control组(P<0.05);si-GNAS-AS1+miR-449a inhibitor组的侵袭数目多于si-GNAS-AS1+inhibitor NC组、si-GNAS-AS1组(P<0.05)。见表4和图3。
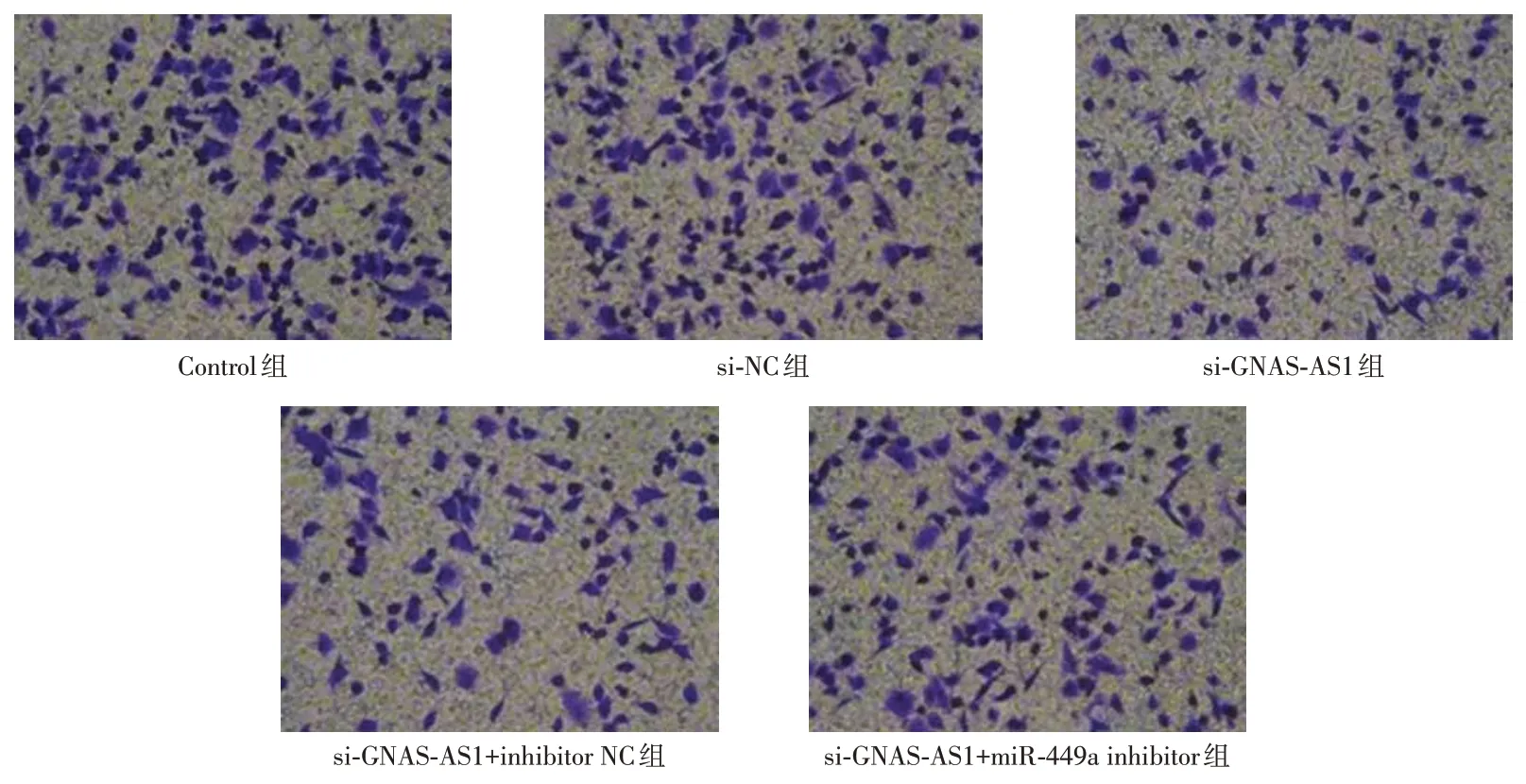
图3 Transwell实验检测AGS细胞侵袭能力Fig.3 The invasion ability of AGS cells was detected by Transwell test
2.7 各组细胞Notch1、E⁃cadherin、Vimentin、N⁃cadherin蛋白表达比较si-GNAS-AS1组与si-NC组、Control组比较,Vimentin、Notch1、N-cadherin蛋白下调表达,E-cadherin蛋白上调表达(P<0.05)。si-GNAS-AS1+miR-449a inhibitor组与si-GNAS-AS1+inhibitor NC组、si-GNAS-AS1组比较,Notch1、Vi⁃mentin、N-cadherin蛋白表达升高,E-cadherin蛋白表达降低(P<0.05)。见表5和图4。

图4 Western Blot检测AGS细胞Notch1、E-cadherin、Vimentin、N-cadherin蛋白的表达Fig.4 Western Blot analysis of Notch1,E-cadherin,Vimentin,N-cadherin protein expression in AGS cells
表5 各组细胞Notch1、E-cadherin、Vimentin、N-cadherin蛋白的表达比较Tab.5 Comparison of protein expression of Notch1,E-cadherin,Vimentin and n-cadherin in each group ±s,n = 6
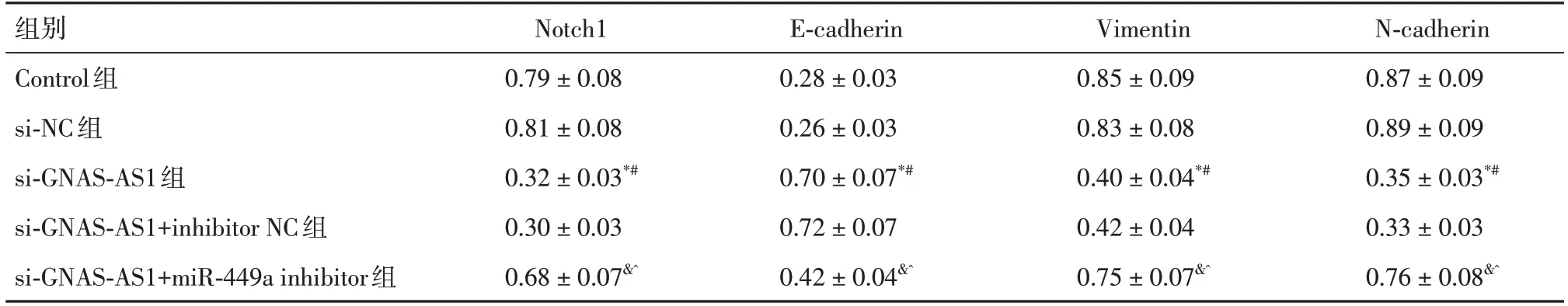
表5 各组细胞Notch1、E-cadherin、Vimentin、N-cadherin蛋白的表达比较Tab.5 Comparison of protein expression of Notch1,E-cadherin,Vimentin and n-cadherin in each group ±s,n = 6
注:*P<0.05 vs.Control组;#P<0.05 vs.si-NC组;&P<0.05 vs.si-GNAS-AS1组;^P<0.05 vs.si-GNAS-AS1+inhibitor NC组
组别Control组si-NC组si-GNAS-AS1组si-GNAS-AS1+inhibitor NC组si-GNAS-AS1+miR-449a inhibitor组N-cadherin 0.87±0.09 0.89±0.09 0.35±0.03*#0.33±0.03 0.76±0.08&^Notch1 0.79±0.08 0.81±0.08 0.32±0.03*#0.30±0.03 0.68±0.07&^E-cadherin 0.28±0.03 0.26±0.03 0.70±0.07*#0.72±0.07 0.42±0.04&^Vimentin 0.85±0.09 0.83±0.08 0.40±0.04*#0.42±0.04 0.75±0.07&^
2.8 GNAS⁃AS1通过miR⁃449a调控Notch1的表达图5、图6显示,miR-449a和GNAS-AS1、Notch1之间具有的结合位点。miR-449a mimic与GNASAS1-WT共转染组的荧光素酶活性低于miR-NC与GNAS-AS1-WT共转染组(P<0.05,表6)。miR-449a mimic与Notch1-WT共转染组的荧光素酶活性低于miR-NC与Notch1-WT共转染组(P<0.05,表7)。

图5 GNAS-AS1和miR-449a的结合位点预测Fig.5 Prediction of binding sites of GNAS-AS1 and miR-449a
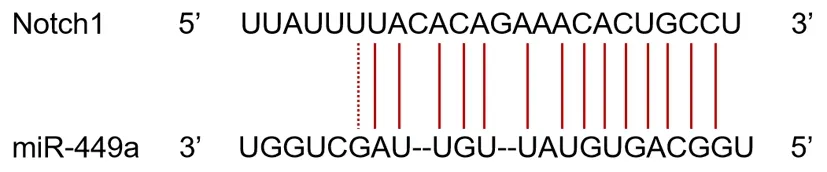
图6 miR-449a和Notch1间的结合位点预测Fig.6 Prediction of binding sites between miR-449a and Notch1
表6 各组荧光素酶活性比较Tab.6 Comparison of luciferase activities in each group ±s,n = 6

表6 各组荧光素酶活性比较Tab.6 Comparison of luciferase activities in each group ±s,n = 6
注:与miR-NC与GNAS-AS1-WT共转染组相比,*P<0.05
组别miR-NC与GNAS-AS1-WT共转染组miR-NC与GNAS-AS1-MUT共转染组miR-449a mimic与GNAS-AS1-WT共转染组miR-449a mimic与GNAS-AS1-MUT共转染组荧光素酶活性1.07±0.13 1.04±0.13 0.34±0.04*1.06±0.13
表7 荧光素酶活性比较Tab.7 Comparison of luciferase activities ±s,n = 6
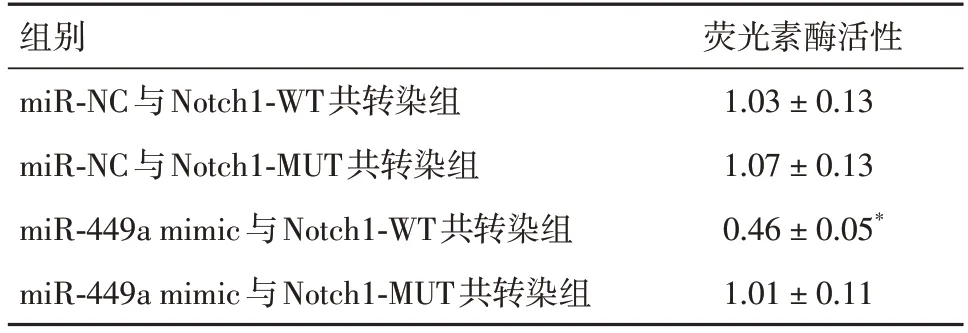
表7 荧光素酶活性比较Tab.7 Comparison of luciferase activities ±s,n = 6
注:与miR-NC与Notch1-WT共转染组相比,*P<0.05
组别miR-NC与Notch1-WT共转染组miR-NC与Notch1-MUT共转染组miR-449a mimic与Notch1-WT共转染组miR-449a mimic与Notch1-MUT共转染组荧光素酶活性1.03±0.13 1.07±0.13 0.46±0.05*1.01±0.11
3 讨论
GNAS-AS1作为一种LncRNA,在多种肿瘤组织和细胞中呈现异常表达。马虹飞等[10]研究发现GNAS-AS1在肺鳞癌组织中高表达,且与肿瘤分期相关;GNAS-AS1能通过调节MAPK信号通路的活性影响肺鳞癌的进展,可能是肺鳞癌的治疗靶点之一。宋芷霜等[11]研究发现GNAS-AS1在卵巢癌细胞中表达升高,下调其表达可以降低卵巢癌细胞的增殖、迁移、侵袭等能力,这可能是通过负调控miR-2116-3p的表达实现的。提示GNAS-AS1是癌症治疗的可能靶点。本实验中,GC肿瘤组织中GNAS-AS1上调表达,敲低GNAS-AS1抑制了AGS细胞的迁移、侵袭和增殖能力。揭示GNAS-AS1在GC进展中发挥促癌功能。
miRNA已被众多研究证明在癌症的进展中起着重要的作用。我们通过生物信息学分析显示,miR-449a具有与GNAS-AS1相互补的序列。目前已有广泛的报道表明miR-449a在多种癌症中出现异常表达,黄洁等[12]研究发现miR-449a在肺癌细胞A549中的表达低于肺正常细胞,且miR-449a能够通过靶向HDAC1的表达,抑制肺癌的增殖、侵袭和迁移。LAN等[13]研究发现miR-449a在结直肠癌细胞中低表达,通过提高miR-449a的表达可以提高自噬能力,抑制结直肠癌细胞的增殖、集落形成、迁移和侵袭等。杜晨旭等[14]研究发现miR-449a在人宫颈癌细胞中呈低表达,沉默LINC01123可以通过上调miR-449a表达,抑制HGF/c-MET信号通路,进而阻碍宫颈癌细胞的转移和生长。本实验发现,沉默GNAS-AS1升高miR-449a表达。在沉默sGNAS-AS1基础上下调miR-449a表达后,细胞增殖、侵袭、迁移被抑制。提示GNASAS1敲低可能通过促进miR-449a表达阻滞AGS细胞的迁移、侵袭和增殖过程。
通过查询targetscan数据库,我们发现miR-449a潜在的靶基因包括Notch1。Notch信号通路高度保守,其在细胞分化、增殖、组织发育、稳态等过程中发挥重要的调节作用,也与癌症的发生发展密切相关[15-16]。ZHANG等[17]研究发现激活Notch信号通路可通过调节上皮间质转化通路和HES-1表达加速乳腺癌细胞迁移和增殖过程。贾晓琼等[18]研究发现miR-449a可以诱导非小细胞肺癌NCIH1975细胞凋亡和增殖抑制,其作用机制可能与抑制Notch1信号有关。本实验发现,敲低GNASAS1使Notch1下调表达,而抑制miR-449a可增高Notch1蛋白表达,提示沉默GNAS-AS1对AGS细胞迁移、侵袭、增殖的抑制作用可能与提高miR-449a来下调Notch1表达有关。
综上,我们在GC中发现了miR-449a及其直接靶点Notch1对GNAS-AS1的一种新的调控机制。GNAS-AS1的表达减少通过影响GC的增殖、侵袭和转移而阻碍GC的进展。因此,LncRNA GNASAS1可能在GC中发挥促瘤作用,提示GNAS-AS1作为GC治疗的新靶点的潜力。本研究的主要局限性是临床受试者较少,并且由于现有实验室和设备的限制,缺乏体内实验。为了更全面地了解这种LncRNA作为潜在生物标志物的适用性,在后续的临床试验中纳入更大的患者群体将是谨慎的。
