长双歧杆菌蔗糖磷酸化酶的异源表达及其酶学性质
2024-03-13项蓉杨金山娄婷婷吴子健张宏宇赵彦巧王丹芸张得光马兴
项蓉,杨金山,娄婷婷,吴子健,张宏宇 ,赵彦巧,王丹芸,张得光,马兴
(1.天津商业大学 生物技术与食品科学学院 天津市食品生物技术重点实验室,天津 300134;2.天津科技大学 生物工程学院,天津 300457;3.天津海关动植物与食品检测中心,天津 300461)
蔗糖磷酸化酶是一种碳水化合物活性酶,属于糖苷水解酶GH13 家族[1-2],能够催化蔗糖和磷酸盐可逆转化,生成α-D-吡喃葡萄糖磷酸和D-果糖。在反应过程中遵循双重置换机制,并能够与绝大多数糖基受体发生磷酸化、转糖基化和水解三种类型的反应[3-4]。作为一种高效的转糖基化酶,蔗糖磷酸化酶因其广泛的底物专一性,在食品、化妆品、医药等领域极具应用潜力[5-7]。其主要有3 个方面的应用,分别为1)功能低聚糖的制备:蔗糖磷酸化酶可以以某些单糖或糖醇类作为受体,催化合成相应的多一个葡萄糖基团的低聚糖,例如将葡萄糖和蔗糖为底物转化生成益生元曲二糖[8];2)糖苷类化合物的制备:蔗糖磷酸化酶还可以作用于含醇羟基、酚羟基及羧基的化合物,如催化对苯二酚合成具有美白功效的α-熊果苷[9],催化甘油合成保湿剂α-D-葡萄糖甘油[10],以及催化抗坏血酸合成稳定性高且水溶性好的抗氧化剂2-O-α-D-吡喃葡糖基-L-抗坏血酸(2-Oα-D-glucopyranosyl-L-ascorbic acid,AA-2G)[11]等;3)植物多酚类化合物制备:蔗糖磷酸化酶可以作用于某些植物多酚提高其稳定性和水溶性,例如蔗糖磷酸化酶可催化白藜芦醇生成白藜芦醇3-α-葡萄糖苷[12-13],以及催化儿茶素生成儿茶素-3-O-D-葡萄糖苷[14-15]等。
蔗糖磷酸化酶(sucrose phosphorylase,SPase)主要来源于微生物,但其在野生型菌株中的合成途径复杂,酶产量较低,难以满足工业需求[9]。近年来,已通过异源表达实现了不同来源的蔗糖磷酸化酶的高效表达。例如来源于青春双歧杆菌[16](Bifidobacteriumadolescentis)、短双歧杆菌[11](Bifidobacteriumbreve)、长双歧杆菌[17](Bifidobacteriumlongum)、肠膜明串珠菌[18](Leuconostocmesenteroides)、罗伊氏乳杆菌[19](Lactobacillusreuteri)、嗜热杆菌[20](Thermobacillussp.)和变异链球菌[21](Streptococcusmutans)等的蔗糖磷酸化酶已在大肠杆菌中实现了高效的异源表达。其中,Kwon 等[22]成功构建了来源于长双歧杆菌的蔗糖磷酸化酶(Bifidobacteriumlongumsucrose phosphorylase, BloSPase)的重组菌株并表达了蔗糖磷酸化酶,首次利用蔗糖磷酸化酶合成了AA-2G。Gudiminchi 等[17]也利用异源表达的BloSPase 成功合成了AA-2G,并且发现该酶表现出特殊的pH 依赖性优势,在pH 值为5.2 时,具有较高的效率和较好的位点选择性,且杂质AA-6G 的产量较少。Zhou 等[11]比较了8 个不同来源的蔗糖磷酸化酶合成AA-2G 时的转糖基化活力,其中BloSPase 表现出了较高的转糖基化活力。因此,BloSPase 在合成AA-2G 方面极具应用潜力。
本研究选择pET-28a 和大肠杆菌BL21(DE3)作为表达载体和表达宿主,对BloSPase 进行异源表达,为提高其可溶性表达的产量,考察诱导时间、诱导温度和异丙基-β-D-硫代半乳糖苷(isopropylthio-β-D-galactoside,IPTG)浓度对BloSPase 表达的影响,确定BloSPase 的最佳表达条件;采用镍离子柱亲和层析纯化BloSPase,并对BloSPase 的转糖基化活力及其酶学参数进行表征,以期为BloSPase 的进一步应用及分子改造提供理论参考。
1 材料与方法
1.1 材料与试剂
大肠杆菌BL21(DE3)由天津商业大学生物技术与食品科学学院实验室保存。LB 培养基(固体培养基添加2% 琼脂粉)、琼脂粉、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂:北京索莱宝科技有限公司;蛋白分子量Marker:上海百赛生物技术股份有限公司;蛋白上样缓冲液、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)缓冲液、Ni-NTA 亲和层析填料:金斯瑞生物科技股份有限公司;质粒小提试剂盒、卡那霉素、咪唑、磷酸盐缓冲液、高效感受态细胞制备试剂盒、改良型二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、IPTG、DNA Marker(300~2 500 bp):生工生物工程(上海)股份有限公司;超滤管(截留10 kDa):美国Millipore 公司。以上化学试剂均为分析纯。
1.2 仪器与设备
PCR 仪(Mastercycler nexus gradient)、高速冷冻离心机(Centrifuge 5430):德国Eppendorf 公司;超微量分光光度计(NanoPhotometer®N60):德国Implen GmbH公司;超声波细胞粉碎机(SCIENTZ-IID 型):宁波新芝生物科技股份有限公司;恒温培养箱(SPX-100B-D):上海博迅实业有限公司医疗设备厂;恒温摇床(ZQTY-70):上海知楚仪器有限公司;蛋白电泳仪(PowerPac Universal):美国BIO - RAD 公司;高效液相色谱仪(ECLassical 3100):大连依利特分析仪器有限公司。
1.3 试验方法
1.3.1 重组质粒pET-28a/BloSPase 的构建
在NCBI 数据库中查找到BloSPase 的基因序列(GenBank 编号:AAO84039),按照大肠杆菌的密码子偏好性进行优化,并将NdeI 和BamH I 两个酶切位点分别加到序列的5'端和3'端,选择pET-28a 为载体,由生工生物工程(上海)股份有限公司合成得到含BloSPase 基因的重组质粒pET-28a/BloSPase。将合成得到的重组质粒转化进入大肠杆菌BL21(DE3)感受态细胞中,并涂布于LB 固体培养基(含50 μg/mL 卡那霉素),挑取单菌落转接到LB 液体培养基(50 μg/mL卡那霉素)中,37 ℃、200 r/min 恒温摇床培养,设计扩增BloSPase 基因的引物(上游引物F:5'-GGCAGCCATATGAAAAACAAAGTTCAG-3',下游引物R:5'-CGGAGCTCGAATTCGGATCCTTAAT-3'),通过菌液聚合酶链式反应(polymerase chain reaction,PCR)验证阳性后提取质粒进行测序验证。
1.3.2 重组菌的诱导表达
将重组菌的单菌落接种到LB 液体培养基(含50 μg/mL 卡那霉素)中,于37 ℃、200 r/min 恒温摇床培养,将过夜培养物按1% 接种量转接至50 mL 的LB 液体培养基(含50 μg/mL 卡那霉素)中,于37 ℃、200 r/min恒温摇床培养,直至OD600值约0.6 时,加入IPTG 诱导蛋白表达,于恒温摇床孵育。将菌液离心收集细胞(10 000×g,4 ℃,10 min),再重悬浮于50 mmol/L 磷酸盐缓冲液(pH7.4)中,于冰上超声破碎细胞(95 W,超声2.5 s,间歇3 s,总共10 min)。将裂解液离心(10 000×g,4 ℃,10 min),保留上清液,即为粗酶液。
1.3.3 重组BloSPase 诱导表达条件的优化
1.3.3.1 单因素试验
通过单因素试验优化BloSPase 的表达条件,以IPTG 浓度、诱导时间、诱导温度为变量,以粗酶液水解蔗糖的酶活力为指标评价BloSPase 表达量。加入浓度分别为0.10、0.25、0.50、0.75、1.00 mmol/L 的IPTG,24 ℃诱导8 h,考察IPTG 浓度对BloSPase 表达量的影响;加入浓度为0.50 mmol/L 的IPTG,分别于16、20、24、28、32 ℃,诱导8 h,考察诱导温度对BloSPase 表达量的影响;加入浓度为0.50 mmol/L 的IPTG,于24 ℃下,分别诱导6、8、10、12、18、24 h,考察诱导时间对BloSPase表达量的影响。每个试验重复3 次取平均值。
1.3.3.2 响应面试验
在单因素试验的基础上,使用Design Expert 8.0.6.1 软件,设计以诱导温度、诱导时间、IPTG 浓度为变量,以BloSPase 的水解酶活力为响应值的三因素三水平响应面试验,确定重组BloSPase 表达的最佳条件。试验设计编码见表1。
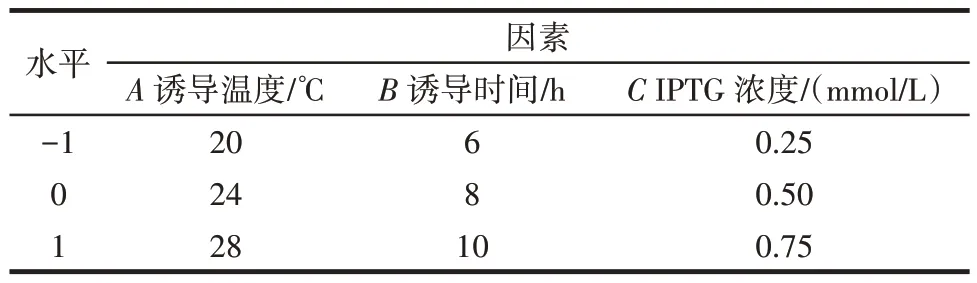
表1 响应面试验因素与水平编码Table 1 Factors and levels for response surface experiment
1.3.4 重组BloSPase 的纯化
使用0.22 μm 的微孔滤膜过滤粗酶液后将其与结合缓冲液(300 mmol/L 氯化钠,50 mmol/L 磷酸二氢钠,20 mmol/L 咪唑,pH7.4)按体积比1∶1 混合均匀。用结合缓冲液以1 mL/min 的流速平衡镍柱后,再将混合液上样到镍柱中,以0.5 mL/min 流速流穿。待样品与镍柱结合孵育1 h 后,用洗涤缓冲液(300 mmol/L 氯化钠,50 mmol/L 磷酸二氢钠,100 mmol/L 咪唑,pH7.4)洗去杂蛋白,再用洗脱缓冲液(300 mmol/L 氯化钠,50 mmol/L 磷酸二氢钠,250 mmol/L 咪唑,pH7.4)洗脱并收集目的蛋白。收集到的蛋白洗脱液于去离子水中进行透析后,再用超滤管进行离心(4 500×g,4 ℃,30 min)浓缩得到纯蛋白,并通过SDS-PAGE 分析检测。
1.3.5 重组BloSPase 的蛋白含量及水解酶活力测定
BloSPase 的蛋白浓度测定采用二喹啉甲酸法,使用改良型BCA 蛋白浓度测定试剂盒,在波长562 nm下测定吸光值计算蛋白浓度。以牛血清蛋白为标准蛋白,并且以其蛋白浓度为横坐标(x),紫外吸光系数为纵坐标(y),在562 nm 波长下测得标准曲线为y=0.000 4x- 0.006 8(R2=0.999 7)。
BloSPase 水解酶活力的测定采用DNS 还原糖测定法[23-24]。反应体系包括5% 蔗糖溶液250 μL,50 mmol/L磷酸盐缓冲液(pH7.4)225 μL,稀释适当倍数的酶液25 μL,37 ℃水浴10 min 后,立即加入375 μL DNS 试剂沸水浴10 min,冷却至室温后测定540 nm 下的吸光值。配制不同浓度的果糖溶液,同样条件下与DNS 试剂反应,绘制标准曲线为y= 0.793 3x- 0.059 9(R2=0.999 9)。蔗糖磷酸化酶的一个酶活力单位(U)定义为每分钟水解蔗糖生成1 mmol 的果糖所需的酶量。
1.3.6 重组BloSPase 的转糖基化活力的测定
BloSPase 的转糖基化活力测定参考文献[11]的方法并稍作修改,反应体系设为500 μL,其中含有1.2 mol/L 的L-抗坏血酸、0.8 mol/L 蔗糖、100 mmol/L柠檬酸钠缓冲液和250 μg/mL 纯化酶,于40 ℃孵育72 h,反应结束后将反应混合物取出加入0.05 mol/L 的盐酸溶液终止反应。采用配有紫外检测器的高效液相色谱仪和COSMOSIL PBr 色谱柱(4.6 mm × 250 mm,5 μm),以1% 甲醇(磷酸调至pH2.5)为流动相,并设置流动相流速为0.8 mL/min,在检测波长238 nm 下,对L-抗坏血酸及AA-2G 进行检测。
一个单位(U)的转糖基化活力是指在给定条件下每分钟形成1 μmol 的AA-2G 的酶的量。
1.3.6.1 pH 值对重组BloSPase 转糖基活力和稳定性的影响
按照1.3.6 的方法,在不同pH 值(4.0~7.0)的100 mmol/L 柠檬酸钠缓冲液中,测定BloSPase 转糖基化活力的最适pH 值。将纯化酶置于不同pH 值的100 mmol/L 柠檬酸钠缓冲液(4.0~7.0)中于4 ℃保存12 h 后,测定其残余酶活力,考察BloSPase 的pH 值稳定性。以最高的转糖基化活力为100%,计算相对酶活力。上述每个试验重复3 次。
1.3.6.2 温度对重组BloSPase 转糖基活力和稳定性的影响
在最适pH 值下,将纯化酶置于不同温度(30~65 ℃)下反应,测定BloSPase 的转糖基化活力的最适温度。将纯化酶分别在40、50、60 ℃下孵育0、12、24、36、48、60、72 h 后,测定其残余酶活力,考察BloSPase的热稳定性。以最高的转糖基化活力为100%,计算相对酶活力。上述每个试验重复3 次。
1.3.6.3 重组BloSPase 的酶促反应动力学测定
在40 ℃和最适pH 值条件下,测定以不同浓度(50~500 mmol/L)的L-抗坏血酸为底物时的酶活力。根据AA-2G 产物的量评估最初1 h 的反应速度。使用Origin 2021 软件通过米氏方程对不同L-抗坏血酸浓度下的初始速率进行非线性拟合,计算动力学参数(Km和Vmax)。上述每个试验重复3 次。
1.4 数据处理
每组试验重复3 次求平均值,使用Microsoft Excel 2019 软件、Origin 2021 软件对单因素试验结果进行分析和制图,并使用Design Expert 8.0.6.1 软件设计响应面试验和分析试验数据。
2 结果与分析
2.1 重组质粒pET-28a/BloSPase 的表达
将重组质粒pET-28a/BloSPase 转化进入大肠杆菌BL21(DE3)感受态细胞,以重组菌的单克隆菌液为模板,进行菌液PCR 扩增验证,扩增产物见图1。
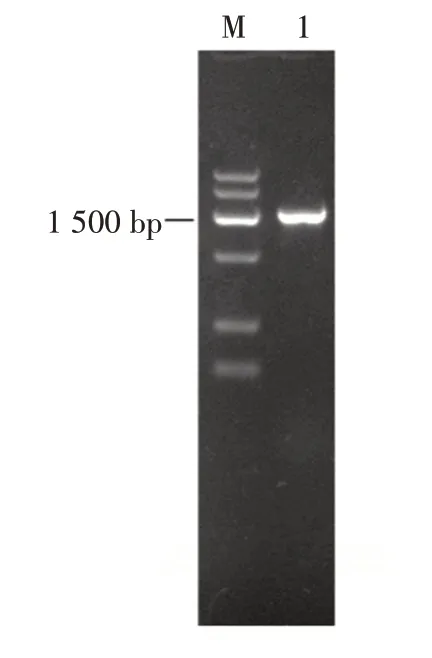
图1 重组大肠杆菌BL21(DE3)/pET-28a/BloSPase 菌液PCR 鉴定结果Fig. 1 Results of PCR identification of recombinant Escherichia coli BL21(DE3)/pET-28a/BloSPase
由图1 可知,扩增产物大小约为1 500 bp,与目的基因大小一致。并且质粒测序结果显示序列正确,表明重组大肠杆菌BL21(DE3)/pET-28a/BloSPase 构建成功。对重组菌诱导表达后,通过超声破碎后离心取上清液,通过SDS-PAGE 电泳分析BloSPase 表达情况,结果见图2。
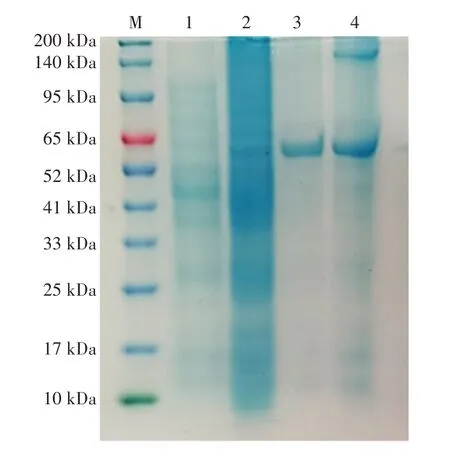
图2 重组大肠杆菌BL21(DE3)/pET-28a/BloSPase 表达的SDSPAGE 分析Fig. 2 SDS-PAGE analysis of recombinant Escherichia coli BL21(DE3)/pET-28a/BloSPase expression
由图2 可知,重组菌菌液加入IPTG 诱导后,在约56 kDa 出现了明显的目的条带,与目的蛋白质分子量大小一致,表明了BloSPase 能够在大肠杆菌BL21(DE3)中成功表达。而重组菌未诱导表达时,在约56 kDa 处有浅显的目的条带,可能是因为在T7 强启动子下重组菌也会表达微量目的蛋白。
2.2 单因素试验结果
2.2.1 IPTG 浓度对重组BloSPase 表达的影响
按1.3.2 方法接种得到菌液,在OD 值约0.6 时,分别添加浓度为0.10、0.25、0.50、0.75、1.00 mmol/L 的IPTG,在24 ℃下,诱导8 h 后,将菌液超声破碎后离心取上清液,对其水解酶活力进行测定,结果见图3。
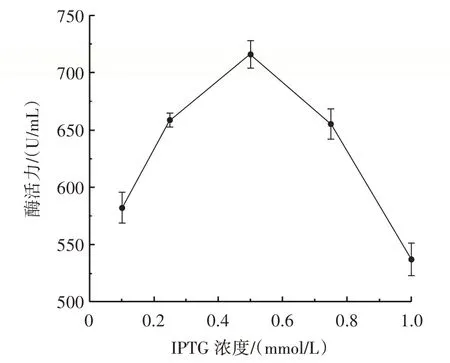
图3 IPTG 浓度对重组BloSPase 表达的影响Fig.3 Effect of IPTG concentration on the expression of recombinant BloSPase
由图3 可知,当IPTG 浓度在0.10~0.50 mmol/L 时水解酶活力逐渐增加,在IPTG 浓度为0.50 mmol/L 时水解酶活力达到最大,当IPTG 浓度大于0.50 mmol/L后水解酶活力开始下降。这主要是因为IPTG 浓度会影响蛋白的表达速率、溶解度及活性,而过高浓度不利于蛋白的表达和细胞活性,会导致蛋白质在表达过程中形成包涵体并抑制大肠杆菌的生长。但加入适量的IPTG,则能降低大肠杆菌细胞的代谢负荷,提高表达水平[25-27]。因此,IPTG 浓度选择0.50 mmol/L 左右进行后续响应面优化试验。
2.2.2 诱导温度对重组BloSPase 表达的影响
为探究不同诱导温度对重组BloSPase 表达的影响,将菌液分别于16、20、24、28、32 ℃下诱导,制备粗酶液,对其水解酶活力进行测定,结果见图4。

图4 诱导温度对重组BloSPase 表达的影响Fig.4 Effect of induction temperature on the expression of recombinant BloSPase
由图4 可知,当诱导温度为24 ℃时,BloSPase 的水解酶活力最高;当温度小于或大于24 ℃时,水解酶活力均较低。因为诱导温度不仅影响细菌的生长,还影响重组蛋白的表达和蛋白的溶解性[28]。一般来说,细菌细胞在低温下生长缓慢,低温使细胞内代谢酶的活性降低,导致重组蛋白质的合成速度降低。在更高的温度下,蛋白质的合成可以加速,但过高的温度可能会阻止酶蛋白质的正确折叠,从而使蛋白质没有达到足够的溶解度,导致形成不活跃的包涵体[29]。因此,诱导温度选择24 ℃左右进行后续的响应面优化试验。
2.2.3 诱导时间对重组BloSPase 表达的影响
为探究诱导时间对重组BloSPase 表达的影响,将菌液分别诱导6、8、10、12、18、24 h,制备粗酶液,对其水解酶活力进行测定,结果见图5。
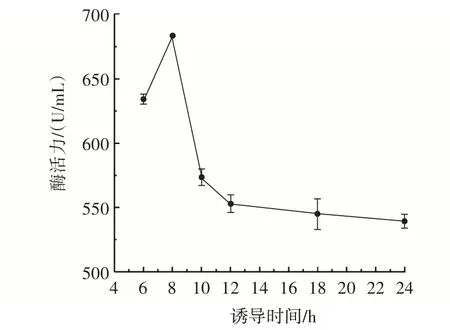
图5 诱导时间对重组BloSPase 表达的影响Fig.5 Effect of induction time on the expression of recombinant BloSPase
由图5 可知,当诱导时间在6~8 h 内,水解酶活力呈升高趋势,在8 h 时水解酶活力达到峰值。随着诱导时间的延长,水解酶活力逐渐降低,可能是由于环境发生变化以及培养基中营养物质的限制,目的蛋白在表达的同时被大量降解,同时诱导时间过长也会对细胞活性产生消极影响,出现菌体老化从而使表达量降低[30-31]。因此,诱导时间选择8 h 左右进行后续的响应面优化试验。
2.3 响应面试验结果
2.3.1 响应面试验设计及结果
单因素试验显示重组BloSPase 的最佳诱导条件为诱导时间8 h、IPTG 浓度0.5 mmol/L、诱导温度24 ℃,在此基础上确定响应面试验的因素水平进行优化。以诱导温度(A)、诱导时间(B)、IPTG 浓度(C)为自变量,BloSPase 的水解酶活力为响应值,响应面试验设计见表2。
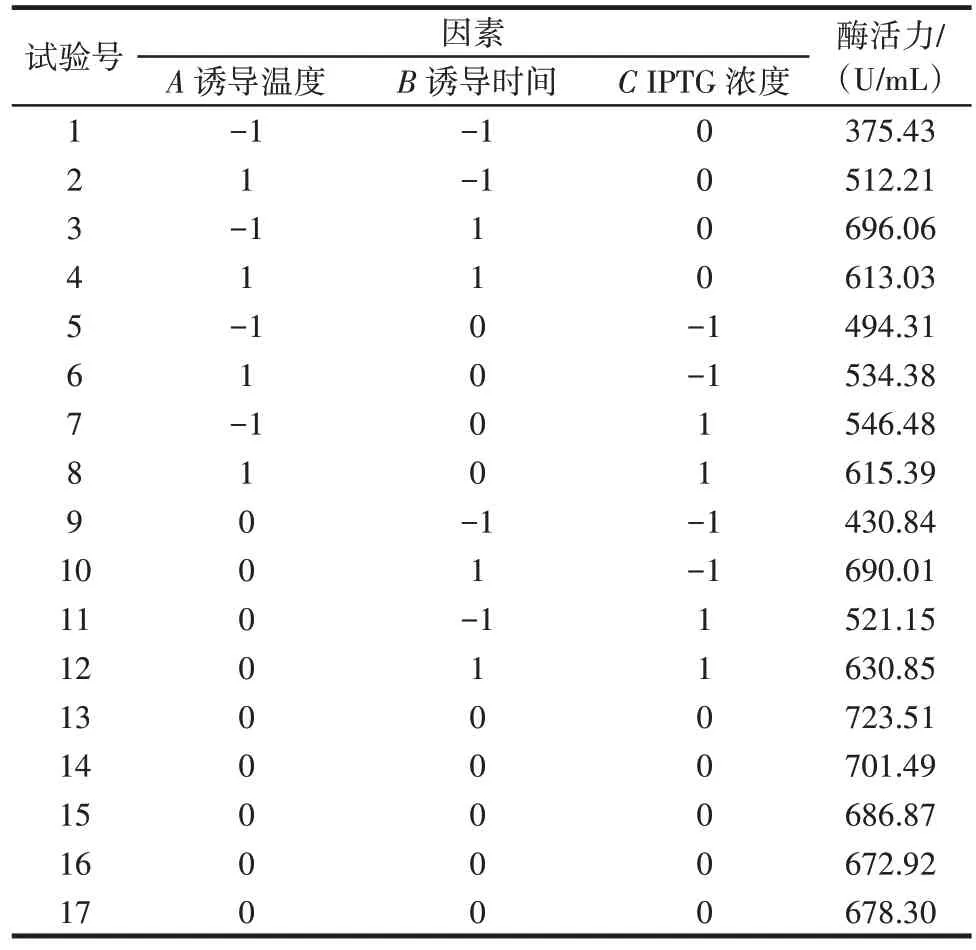
表2 响应面试验设计与结果Table 2 Design and results of the response surface experiment
2.3.2 响应面回归模型的构建与方差分析
使用Design Expert 8.0.6.1 软件对表2 结果进行分析,建立二次多项回归方程:Y= 692.62+20.34A+98.79B+20.54C-54.95AB+7.21AC-37.37BC-82.00A2-61.43B2-62.98C2,并对回归模型进行方差分析,结果见表3。
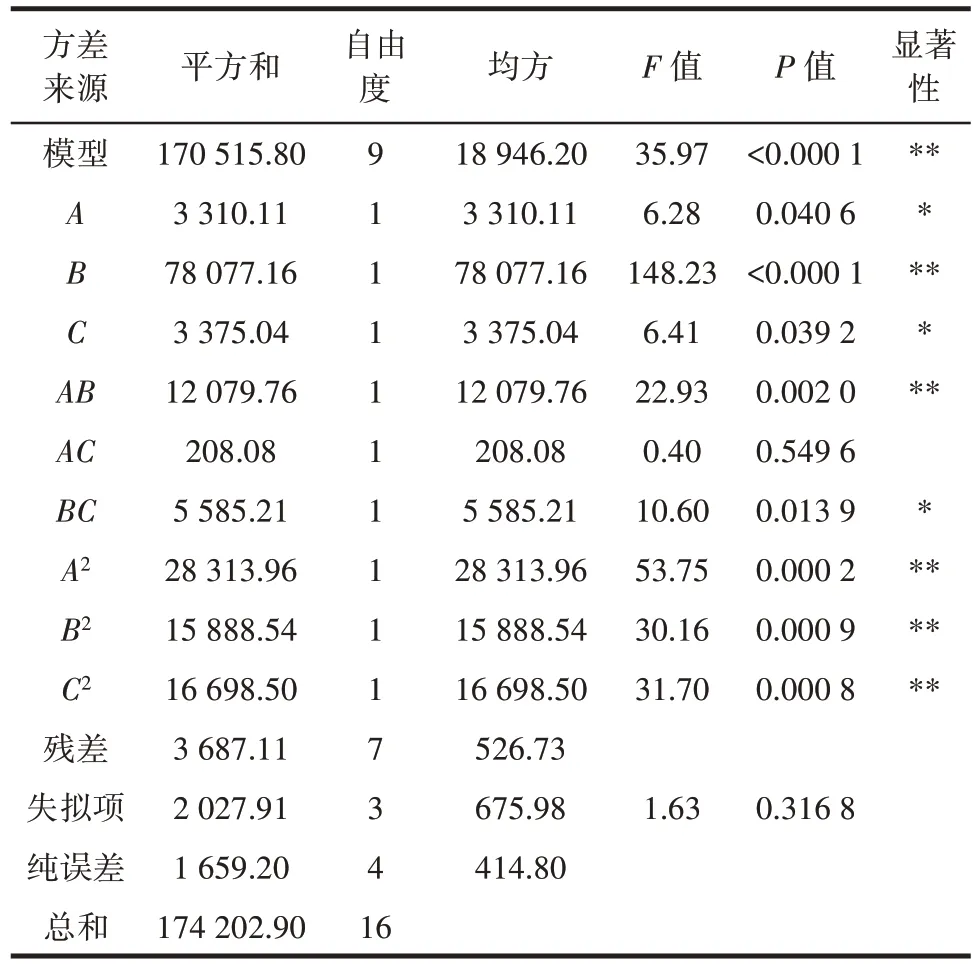
表3 回归模型方差分析Table 3 Analysis of variance of the regression model
由表3 可知,该模型的失拟项P=0.316 8>0.05,模型P<0.000 1,表明该模型与实际试验的拟合程度好;回归模型的决定系数R2=0.978 8,校正决定系数R2Adj=0.951 6,说明模型拟合程度好,误差小,可用于预测BloSPase 酶活力。B、AB对结果影响极显著(P<0.01),A、C、BC对结果影响显著(P<0.05),二次项A2、B2和C2对结果影响极显著(P<0.01)。通过F值大小判断3 个因素对BloSPase 酶活力的影响的大小为B(诱导时间)>C(IPTG 浓度)>A(诱导温度)。
通过Design Expert 8.0.6.1 绘制出各因素之间交互作用的响应曲面和等高线见图6。
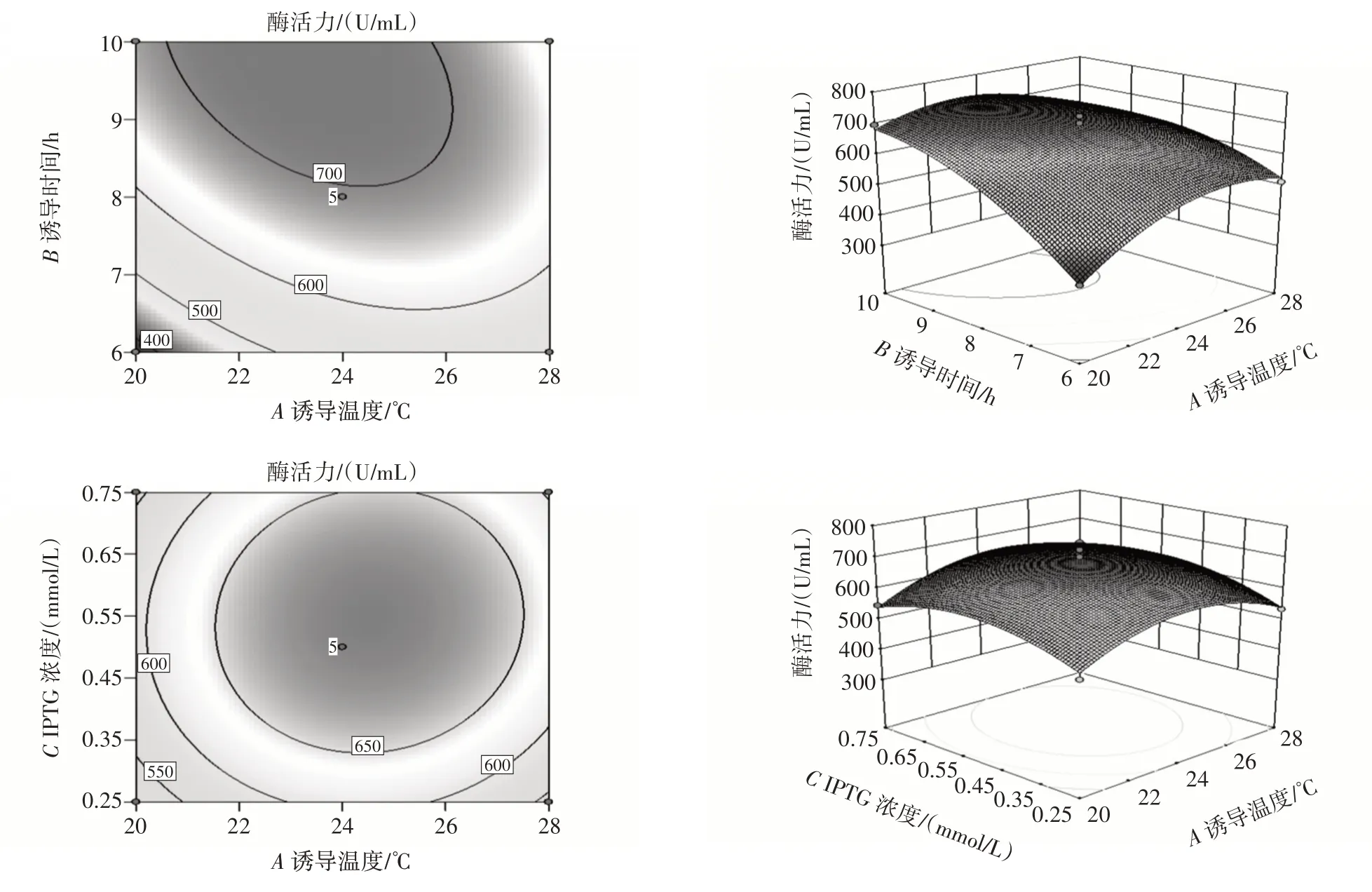
图6 各因素相互作用的响应曲面及等高线Fig.6 Response surfaces and contour lines of the interaction of various factors
由图6 可知,诱导温度与诱导时间的相互作用的等高线呈椭圆形,且响应面曲面坡度陡峭,说明诱导温度和诱导时间交互作用对BloSPase 水解酶活力的影响极显著(P<0.01);诱导温度和IPTG 浓度相互作用等高线呈圆形,且响应面曲面坡度不陡峭,则两者之间的相互作用不显著(P>0.05);诱导时间和IPTG 浓度相互作用的等高线呈椭圆形,且响应面曲面坡度相对陡峭,表明诱导时间和IPTG 浓度之间的交互作用显著(P<0.05)。这与方差分析结果一致。
2.3.3 验证试验结果
通过Design Expert 8.0.6.1 软件建立的回归模型,预测的最佳诱导条件是诱导时间为9.86 h、IPTG 浓度为0.47 mmol/L、诱导温度为23.23 ℃,此条件下BloSPase的水解酶活力可以达到735.213 U/mL。结合实际情况,诱导条件设为IPTG 浓度0.47 mmol/L、诱导温度23 ℃、诱导时间10 h。在此条件下进行验证,水解酶活力达到(730.35 ±0.58)U/mL,与模型预测值较接近,拟合性较好,验证了该模型的有效性。Zhang 等[30]也对来源于长双歧杆菌JCM1217 的蔗糖磷酸化酶的表达条件进行优化,但所得到的最佳表达条件与该试验优化的最佳表达条件不同,可能因为蔗糖磷酸化酶基因来源于不同菌株,且表达载体不同,从而导致其所需的表达条件不同。并且将粗酶液用镍柱纯化后比酶活达到(95.22±2.45)U/mg。
2.4 重组BloSPase 的转糖基化酶学性质分析
pH 值和温度对酶的转糖基化活力和稳定性的影响见图7。
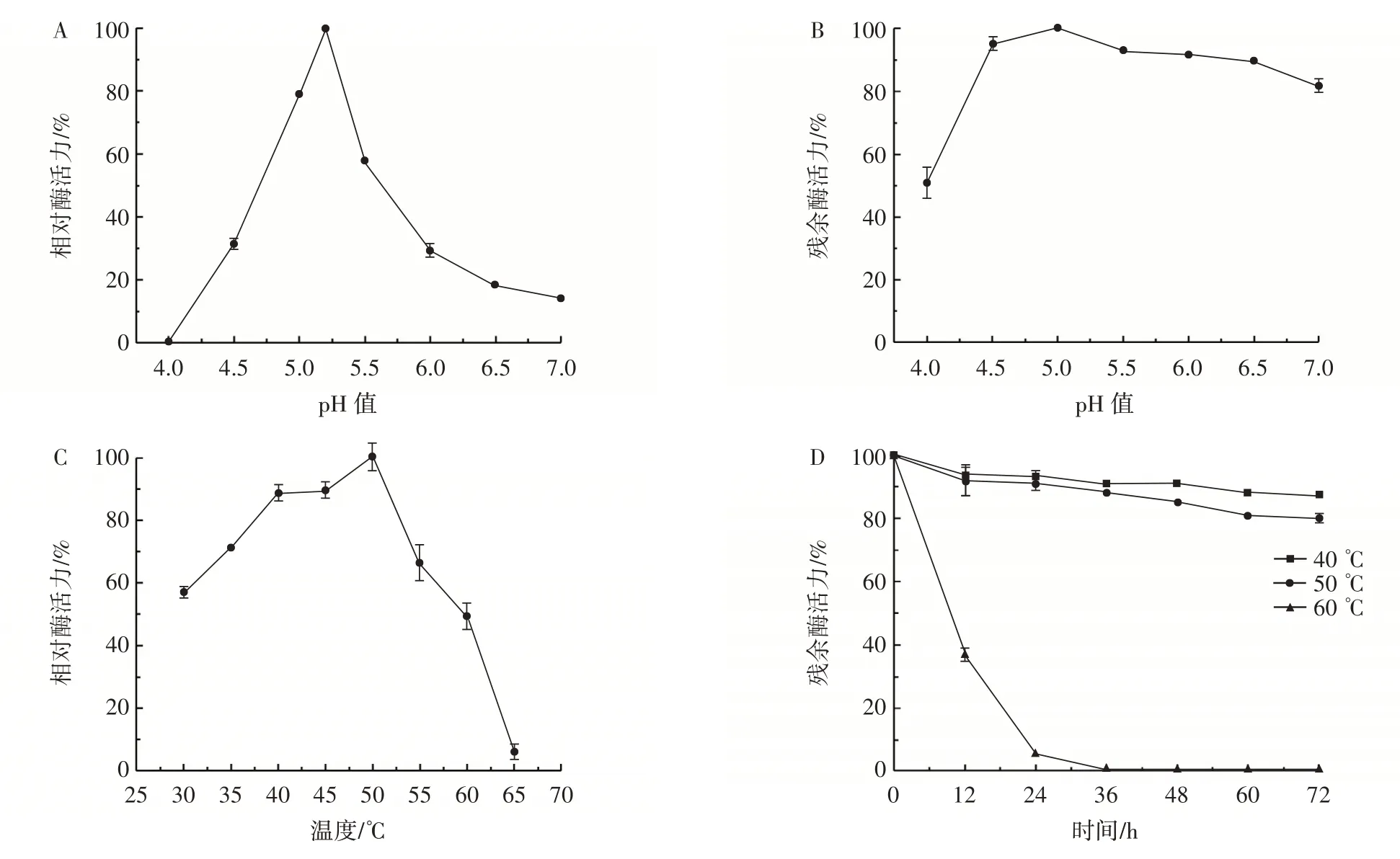
图7 pH 值和温度对重组BloSPase 转糖基化活力及稳定性的影响Fig. 7 Effect of pH and temperature on transglycosylation activity and stability of recombinant BloSPase
由图7A 可知,BloSPase 的最适pH 值为5.2,与Gudiminchi 等[17]所报道的一致,BloSPase 的糖基化活力具有严格的pH 依赖性,只在很窄的pH 范围内起作用;当pH 值为4 时,BloSPase 的糖基化活力几乎检测不到;此外,当pH>5.2 时,转糖基化活力迅速下降。如图7B 所示,BloSPase 在pH4.5~7.0 的柠檬酸钠缓冲液中4 ℃保存24 h 后,残余酶活力在80% 以上,说明在此范围内BloSPase 的酸碱稳定性较好。如图7C 所示,转糖基化反应的最适温度为50 ℃,但当孵育温度高于50 ℃时,其活性迅速下降;在30~60 ℃范围内反应,能保持约50% 以上的酶活力;当温度上升至65 ℃时,只残余约8% 的酶活力。如图7D 所示,BloSPase在40 ℃和50 ℃下孵育72 h 后,其残余酶活力仍保持在80% 以上,证明BloSPase 的热稳定性表现优异。
2.5 重组BloSPase 的Km 和Vmax
测定重组BloSPase 以不同浓度L-抗坏血酸为底物的转糖基化活力,得到BloSPase 动力学参数Km为(266.80±23.76)mmol/L,Vmax为(0.235 0±0.009 9)mmol/(L·min)。与来源于短双歧杆菌[11]的蔗糖磷酸酶的Km(388.0±24.2)mmol/L 相比,本研究中的BloSPase 的Km值相对更低,表明该酶与底物L-抗坏血酸的亲和力更大。
3 结论
本研究成功构建了BloSPase 的重组表达菌,实现了BloSPase 在大肠杆菌中的异源表达。通过单因素及响应面法优化了重组BloSPase 的表达条件,在最优的诱导条件(IPTG 浓度0.47 mmol/L、诱导温度23 ℃、诱导时间10 h)下,重组BloSPase 的水解酶活力达到(730.35±0.58)U/mL,通过镍离子亲和层析柱纯化后,BloSPase 的水解比酶活达到(95.22±2.45) U/mg。BloSPase 的转糖基化活力研究表明,最适反应温度为50 ℃,且在40 ℃和50 ℃下,该酶的相对酶活力仍保持80% 以上,该酶具有良好的热稳定性;最适pH 值为5.2,并且在pH 值为4.5~7.0 时,相对酶活力仍保持80% 以上,酶具有较好的pH 值稳定性。以抗坏血酸作为反应底物时,BloSPase 的动力学反应参数Km值为(266.80±23.76)mmol/L,Vmax值为(0.235 0±0.009 9)mmol/(L·min)。本研究通过对来源于长双歧杆菌的BloSPase 的异源表达条件的优化及其转糖基化相关的酶学性质的测定,为其后续的转糖基化应用以及基于蛋白质工程的改造提供了重要的参考价值。
