基于混菌发酵改善火龙果酒品质
2024-03-13胡陆军陈晓蝶曹雨澜赵长青王佐军赵志峰
胡陆军 ,陈晓蝶,曹雨澜,赵长青,王佐军,赵志峰
(1.四川轻化工大学 生物工程学院,四川 宜宾 644005;2.四川轻化工大学 酿酒生物技术及应用四川省重点实验室,四川 宜宾 644005;3.四川大学轻工科学与工程学院,四川 成都 610000)
火龙果(HylocereusundulatusBritt)又名仙人果,一般基于果皮和果肉的颜色分为红皮红心、红皮白心、黄皮白心3 种,以红皮白心和红皮红心为上品[1]。红心火龙果含有多种生物活性物质,如酚类化合物、多糖和萜类化合物,这些化合物的抗氧化活性可保护身体免受氧化损伤,具有重要的功能特性[2]。火龙果香气独特,颜色鲜艳,营养价值丰富,这些特点使得火龙果成为一种优良的酿酒原料。但是,目前火龙果酒多采用市售商业酵母[3],菌种相对单一,发酵产生的有机酸、酯类等香气成分含量偏低,导致其风味单调,难以充分反映火龙果酒的复杂性和典型性。
近年来,报道证明非酿酒酵母在果酒发酵过程中可以产生多种风味物质,这在很大程度上有助于改善火龙果酒品质。非酿酒酵母能产生果胶酶、β-葡萄糖苷酶等多种胞外酶,这为火龙果酒独特香气成分的形成提供了可能[4]。此外,基于菌种之间互补作用,酿酒酵母(Saccharomycescerevisiae)和非酿酒酵母组合发酵对改善火龙果酒的感官特性具有重要作用[5]。Lin 等[6]利用巴氏酵母(S.bayanus)和梅奇酵母(Metschnikowiaagaves)共同发酵红心火龙果酒,发现混菌发酵可以增加火龙果酒风味物质的种类。有研究证明库德里阿兹威毕赤酵母(Pichiakudriavzevii)能够产生更多的甘油、琥珀酸或一些杂醇及其相应的酯[7],能丰富果酒的香气,但关于库德里阿兹威毕赤酵母在火龙果酒发酵中的应用研究鲜见。
从一定意义上来说,消费者对果酒的喜爱程度受酸度影响较大。研究表明乳酸菌在果酒发酵过程中能够通过苹果酸-乳酸发酵(malolactic fermentation,MLF)将苹果酸转化为乳酸,为果酒带来顺滑、饱满的口感[8]。不仅如此,MLF 在一定程度上也能够增加发酵果酒中微生物稳定性[9]。酒酒球菌(Oenococcusoeni)和植物乳植杆菌(Lactiplantibacillusplantarum)常被作为降酸发酵剂用于果酒发酵的研究[10-11],但目前较少用于火龙果酒降酸的研究。
基于此,本研究以红心火龙果为原料,利用酿酒酵母、库德里阿兹威毕赤酵母和植物乳植杆菌混合发酵火龙果酒,通过探究混菌发酵对发酵火龙果酒理化性质、抗氧化性、风味物质、感官特性等影响的研究,以期为提高火龙果酒品质及产品开发提供参考。
1 材料与方法
1.1 材料与试剂
红心火龙果:市售;酿酒酵母SCFF201、库德里阿兹威毕赤酵母SCFF163、植物乳植杆菌SCFF195:四川轻化工大学发酵食品实验室;果酒酿酒酵母:安琪酵母股份有限公司。
食用小苏打、焦亚硫酸钾、果胶酶(30 000 U/mL)、白砂糖、无水柠檬酸:日照金禾博源生化有限公司;氢氧化钠、磷酸氢二钾、无水乙酸钠:国药集团化学试剂有限公司;酵母膏、蛋白胨:北京奥博星生物技术有限责任公司;超氧阴离子检测试剂盒、羟自由基清除能力检测试剂盒:生工生物工程(上海)股份有限公司。以上化学试剂均为分析纯。
1.2 仪器与设备
GI54DWS 立式自动压力蒸汽灭菌锅:厦门致微仪器有限公司;BSP-250 生化培养箱:上海博迅实业有限公司医疗设备厂;MITR-50ATC 糖度计、MITR-80ATC酒精计:长沙米琪仪器设备有限公司;PhS-10 酸度计:成都世纪方舟科技有限公司;UV-1900I 紫外可见分光光度计:苏州乌津仪器有限公司;TSQ 8000 气相色谱-质谱联用仪:美国赛默飞世尔科技公司;LC1100 高效液相色谱仪:美国安捷伦科技有限公司。
1.3 试验方法
1.3.1 试验组合
本研究试验分组如表1 所示,酵母菌接种量为6%,酿酒酵母和非酿酒酵母的菌种数量按照1∶1 的比例进行接种,酵母菌和植物乳植杆菌的菌种数量按照2∶1 的比例进行接种。

表1 发酵火龙果酒混菌组合Table 1 Mixed strains combination for the fermentation of pitaya wine
1.3.2 火龙果酒发酵条件
1.3.2.1 工艺流程
火龙果酒发酵工艺流程如图1 所示。
图1 火龙果酒发酵工艺流程Fig.1 Technological process for the fermentation of pitaya wine
1.3.2.2 操作要点
新鲜火龙果去皮打成浆,在果浆中添加60 mg/kg焦亚硫酸钾和3 g/100 kg 果胶酶,于20 ℃条件下酶解24 h,然后再用白砂糖调节糖度至23˚Bx。首先,将植物乳植杆菌接种于MRS 固体培养基中培养24 h(37 ℃),然后再将其接种于MRS 液体培养基中进行活化,制成发酵种子液。采用同样的方式活化并制备酿酒酵母和库德里阿兹威毕赤酵母种子液(YPD 培养基)。本研究中火龙果酒发酵温度保持在20 ℃,每间隔2 d 对发酵样品理化指标进行测定,当还原糖含量不再发生变化或变化不明显时认为火龙果酒发酵结束。发酵完成后对其过滤,并于4 ℃条件下陈酿。
1.3.3 火龙果酒理化指标的测定
1.3.3.1 常规理化指标测定
发酵火龙果酒总酸、还原糖含量、酒精度等指标根据GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定[12]。采用pH 计测定样品pH 值。每个指标重复测定3 次。
1.3.3.2 甜菜红素含量测定
参照肖默艳等[13]的方法,按以下公式以甜菜苷计算出甜菜红素的含量(H,mg/L)。
式中:D为稀释倍数;A536为波长在536 nm 处的吸光度;L为比色皿的光路长度,1 cm;M为甜菜苷摩尔分子质量,550.46 g/mol;ε 为标准甜菜苷摩尔消光系数,60 600 L/(mol∙cm)。
1.3.3.3 总酚含量测定
总酚含量根据Khalili 等[14]的方法进行测定,并稍作修改。从0~0.8 mL 每间隔0.1 mL 吸取没食子酸标准溶液(0.1 mg/mL)到不同的容量瓶中,分别加入2.0 mL福林酚试剂和8.0 mL 的碳酸钠溶液(60 g/L),加蒸馏水定容至25 mL,测量其吸光度(OD760)。以没食子酸浓度作为横坐标,以样品吸光度作为纵坐标,绘制标准曲线,求出回归方程和相关系数。精确量取待测样品1.0 mL,定容至10.0 mL,按上述方法测定发酵样品吸光度(OD760),发酵样品总酚含量根据标准曲线回归方程y=12.699x+0.082(R2=0.999 2)进行计算。
1.3.4 火龙果酒抗氧化性检测
1.3.4.1 羟自由基清除率检测
按照试剂盒说明书步骤测定发酵火龙果酒样品的羟自由基清除率。依据下列公式对羟自由基清除率(D,%)进行计算。
式中:A0为空白管吸光度;A1为对照管吸光度;A2为测定管吸光度。
1.3.4.2 超氧阴离子含量测定
按照超氧阴离子检测试剂盒比色法说明书步骤测定超氧阴离子含量。
1.3.5 火龙果酒风味物质测定
1.3.5.1 有机酸测定
有机酸参考Peng 等[15]的方法测定,采用95% 磷酸二氢钾(pH2.4)为流动相A 溶液,5% 甲醇为流动相B溶液。使用Agilent ZORBAX SB-Aq 色谱柱(4.6 mm×250 mm,5 μm),紫外检测器检测波长设定为210 nm。待测样品进样量设定为15 μL,流速设定为0.4 mL/min,柱温设定为25 ℃。
1.3.5.2 挥发性风味物质检测
风味物质鉴定和定量主要参照Mustafa 等[16]的方法。该方法进样口温度设定为250 ℃,离子源温度设定为200 ℃,接口温度设定为250 ℃。采用的色谱柱为SH-Rxi-5Sil MS(30 m×0.25 mm×0.25 μm)。载气选择氦气,流速设定为1.5 mL/min,进样量设定为1 μL,进样方式选择不分流进样。升温方式:首先保持在50 ℃条件下保留1 min;随后以25 ℃/min 的速度升温至125 ℃;其次以10 ℃/min 速度升温至300 ℃,最后在300 ℃条件下保留10 min。
1.3.6 感官评价
遴选10 名食品科学与工程专业学生并做感官评价培训,根据刘琨毅等[17]的评价方法对不同发酵样品的色泽、口感、香气和典型性进行评价,具体评价标准如表2 所示。

表2 火龙果酒感官评价标准Table 2 Sensory evaluation criteria of pitaya wine
1.4 数据分析
本研究数据分析采用IBM SPSS Statistics 26.0 软件,结果差异分析利用单因素方差分析和Duncan 法,绘图利用GraphPad Prism 6.0 软件。
2 结果与分析
2.1 不同发酵火龙果酒基本理化指标
2.1.1 pH 值和总酸含量
pH 值和总酸含量的变化是有机酸、无机酸等多种酸类物质分解和合成交替进行的结果,是体现发酵火龙果酒品质的关键参数,对发酵过程中微生物的代谢以及火龙果酒的口感和色泽等感官品质影响较大[18]。火龙果酒发酵样品pH 值和总酸含量变化如图2 所示。
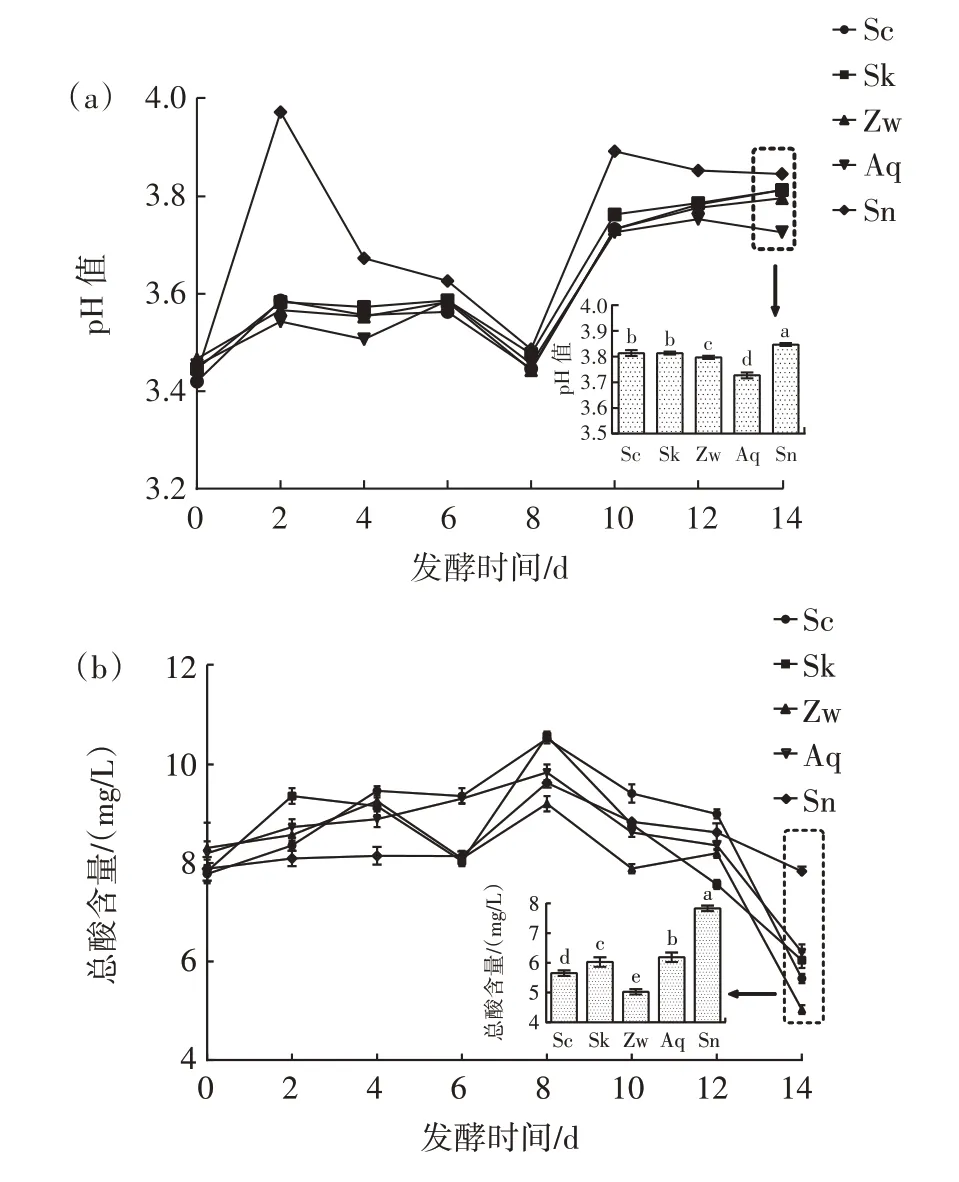
图2 不同火龙果酒发酵组pH 值和总酸含量变化Fig.2 Changes in pH and total acid contents in different fermentation groups of pitaya wine
在发酵前期pH 值呈上升趋势,可能是微生物在早期利用火龙果汁中的有机酸、氨基酸等营养物质[19];发酵14 d 时,Aq 组pH 值最低(P<0.05),可能是因为非酿酒酵母生长代谢的能力较弱,无法利用火龙果酒中的大分子酸类物质,导致酸度过高,这可能导致火龙果酒感官的下降[20]。各发酵组的总酸含量均呈现出先上升后降低的趋势,并在第8 天达到最大值,除了火龙果中的酸性成分,还可能含有酵母菌自身代谢而产生的酸类物质[19],以及微生物在高浓度糖的刺激下,发生了对糖的应激效应而形成的酸[21]。在发酵过程中,Zw组总酸含量变化波动大于Sk 组和Aq 组,可能是因为酵母的体积和质量更大,酵母菌比植物乳植杆菌更快地吸收营养物质,产生了菌种之间对营养物质(如有机酸、糖等)的竞争,因此Zw 组的总酸含量变化波动较大[20]。但在发酵后期Zw 组相比于其他组,总酸含量一直处于最低水平(P<0.05),可能是因为后期酵母代谢产生了一部分营养物质,刺激了植物乳植杆菌的生长代谢,从而降低了火龙果酒的酸度[22]。
2.1.2 糖度、还原糖含量和酒精度
酵母菌等微生物可借助糖酵解方式分解糖类物质形成乙醇及其他产物,酵母菌等微生物对糖的发酵效率是衡量其发酵特性的关键参数[23]。不同发酵样品糖度、还原糖含量的变化如图3 所示,酒精度变化如图4 所示。
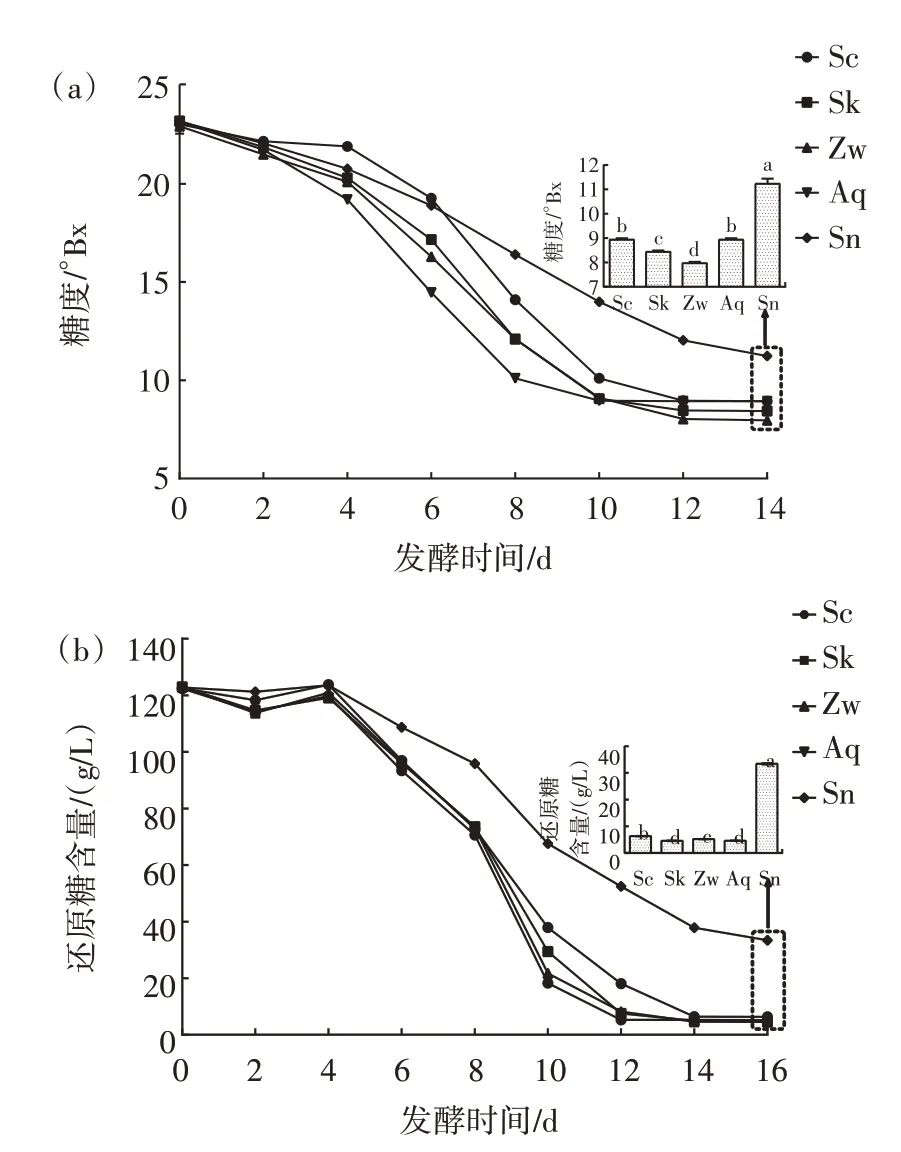
图3 不同火龙果酒发酵组糖度、还原糖含量的变化Fig.3 Changes in sugar and reducing sugar contents in different fermentation groups of pitaya wine

图4 不同火龙果酒发酵组的酒精度Fig.4 Alcohol contents in different fermentation groups of pitaya wine
不同菌种在单独发酵和混合发酵过程中,由于微生物的利用,糖度和还原糖含量总体上一直呈下降趋势。在第4 天时各发酵样品的糖度下降幅度较小,同时各火龙果酒发酵样品还原糖有一定程度的升高,其原因可能是由于火龙果肉的浸渍作用或分泌的果胶酶分解了火龙果中的果胶类物质[24]。在火龙果酒发酵中后期,相较于其他火龙果酒发酵组,Sn 组对糖的利用效率最低(P<0.05),最终的还原糖浓度高达(37.84±0.09)g/L,而Zw 组对糖的利用效率相对较高(P<0.05),最终含量仅为(5.27±0.02)g/L,其原因可能是因为酵母菌释放了维生素、氨基酸等营养物质,这些物质在一定程度上加速了植物乳植杆菌的生长繁殖,从而在整体上促进了混菌发酵组(Zw 组)对糖的利用程度[25]。
由图3 和图4 可知,火龙果发酵产生的酒精度的高低与微生物对糖的利用率有非常紧密的联系。Zw组发酵体系对糖度的利用程度最高,其酒精度最高为(12.47±0.06)% vol(P<0.05);而Sn 组在火龙果酒发酵过程中对糖的利用率最差,产酒精能力也最差,酒精度最低为(6.7±0.1)% vol(P<0.05)。这表明混菌发酵相对于单菌发酵在糖利用方面的效率得到明显提升。
2.2 甜菜红素
甜菜红素是存在于火龙果中的一种天然色素,其含量会对火龙果酒的颜色等感官造成较大影响,其稳定性较低,较易受到氧气、光照、酶等多种因素的影响[26]。不同发酵组中甜菜红素含量的变化如图5 所示。
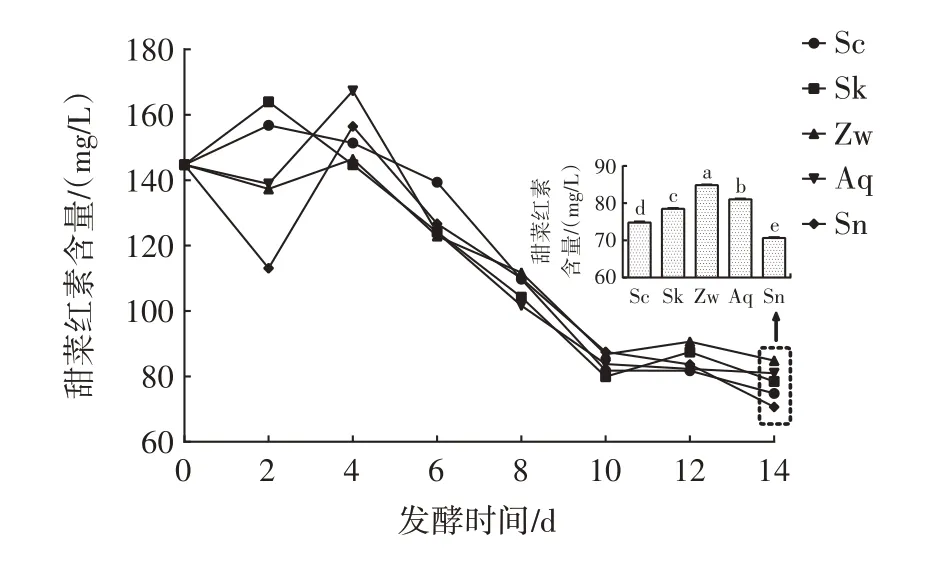
图5 不同火龙果酒发酵组甜菜红素含量的变化Fig.5 Changes of betacyanin contents in different fermentation groups of pitaya wine
在发酵过程中,甜菜红素含量整体上呈降低趋势,主要原因可能是火龙果酒中的多种降解酶(如β-葡萄糖苷酶、多酚氧化酶等)和微生物之间的相互作用造成的[27]。而在发酵前期和末期,甜菜红素含量都有一定的增加,在发酵前期火龙果肉通过浸渍的作用将果肉中一部分甜菜红素释放出来[24],而后期可能是因为微生物通过细胞自溶释放出细胞壁吸附的一小部分甜菜红素[23]。从整体上来看,发酵后Zw 组的甜菜红素含量最高,为(84.84±0.18)mg/L,Sn 组最低,为(70.67±0.18)mg/L,各组间存在显著差异(P<0.05),说明在火龙果酒的发酵中添加植物乳植杆菌,可以有效减少甜菜红素的损失。
2.3 抗氧化性
总酚是决定发酵果酒品质的重要参数,在一定程度上对果酒的颜色、苦涩味等感官特性有较大影响[28]。不同火龙果酒发酵样品的总酚含量、超氧阴离子含量和羟自由基清除率如图6 所示。

图6 不同火龙果酒发酵组的总酚含量、超氧阴离子含量和羟自由基清除率Fig.6 Total Phenol content,superoxide anion content and hydroxyl radical scavenging rate in different fermentation groups of pitaya wine
由图6(a)可知,在发酵过程中,微生物通过自身新陈代谢会产生多种次级代谢产物,这些物质可与酚类物质发生氧化、聚合和沉淀等多种反应,从而降低各发酵样品中的总酚含量[29]。由图6(b)可知,与对照组(JP 组)相比,其他火龙果酒发酵组超氧阴离子含量和羟自由基清除率明显下降,其原因可能是因为火龙果的细胞壁在微生物酶催化下分解形成蛋白质、糖苷等物质[30]。不同发酵样品中,Aq 组多酚含量最高,为(570.67±4.16)mg/L,而三菌发酵火龙果酒组(Zw 组)超氧阴离子含量最高,为(44.36±0.24)μmol/mL,而羟自由基清除率略低于Aq 组。综合来看,Zw 组的抗氧化能力最优(P<0.05),其原因可能是由于植物乳植杆菌代谢改善了混菌发酵体系的抗氧化性[10]。
2.4 不同发酵体系风味物质分析
2.4.1 不同发酵火龙果酒样品有机酸比较
有机酸也在很大程度上对火龙果酒品质有较大影响,它不仅影响火龙果酒的酸度和苦涩味等口感,而且对火龙果酒的色泽、化学稳定性和保存品质等因素也有显著影响[31]。不同微生物菌种代谢有机酸的能力有较大差异,有机酸的变化对某些酯类、挥发性脂肪酸等风味物质的变化会产生重要影响[32]。不同发酵体系有机酸含量对比结果如图7 所示。

图7 不同发酵体系有机酸含量Fig.7 Organic acid contents in different fermentation systems of pitaya wine
由图7 可知,在所有火龙果酒发酵样品中,酒石酸和柠檬酸含量较低,其原因可能是由于发酵过程中酒石酸被微生物降解或形成了酒石酸氢钾沉淀[32];而柠檬酸被微生物分解产生乙酸等其他物质[33]。火龙果酒中主要的有机酸是乳酸和乙酸,一般认为,过高的乙酸浓度会导致火龙果酒产生难闻的气味[34]。Sc 组乙酸相对含量最高,为8.99%,这可能会影响火龙果酒的口感。而三菌发酵火龙果酒组(Zw 组)的乙酸相对含量最低,为1.66%,其原因可能是因为植物乳植杆菌分解己糖,规范了火龙果酒发酵,减少了乙酸的产生[35]。因此,三菌混合发酵的方式可以在一定程度上减少火龙果酒难闻气味的形成,同时植物乳植杆菌表现出明显的降低酸度的作用。
苹果酸可经由丙酮酸的固定和草酰乙酸的还原生成[36]。低含量的苹果酸具有青苹果的香味,若含量高会带来刺鼻的气味。Sk 组和Aq 组苹果酸相对含量较高,分别为1.83% 和1.82%,可能会对火龙果酒的香气带来负面影响。并且在相同条件下,Sk 组的苹果酸相对含量高于Zw 组,这可能是发生了植物乳植杆菌主导的苹果酸-乳酸发酵。
相对于苹果酸来说,乳酸在口感上更加柔和,在果酒发酵过程中可通过丙酮酸的还原或苹果酸的分解产生[36-37]。由图7 可知,所有火龙果发酵样品的乳酸相对含量均较高,与低含量的苹果酸具有一定对应关系。与两菌发酵火龙果酒组(Sk 组)相比,含有植物乳植杆菌的三菌发酵火龙果酒组(Zw 组)乳酸相对含量较低,从而使发酵产生的火龙果酒酸度较低,口感更加柔和。
综上来看,三菌混合发酵火龙果酒组(Zw 组)总有机酸含量显著低于其他发酵组,这与前文总酸分析结果相对应,表明含有植物乳植杆菌的混菌发酵有利于降低火龙果酒的酸度,改善了口感。
2.4.2 不同发酵火龙果酒样品挥发性风味物质比较
果酒挥发性风味物质形成受发酵菌种影响较大。不同火龙果酒发酵样品挥发性风味物质如表3 所示。

表3 不同火龙果酒发酵组挥发性风味物质Table 3 Volatile flavor substances in different fermentation groups of pitaya wine
由表3 可以看出,5 组发酵火龙果酒样品中共鉴定出63 种香气化合物,醇类化合物27 种,酯类化合物20 种,酸类化合物有8 种,酮类化合物有8 种。
挥发性酸类物质是形成酯类物质不可缺少的前提物质,适应浓度的酸类物质可使果酒口感清爽,当酸类物质浓度过高时则会导致果酒产生尖酸难闻的气味[38]。Aq 组挥发性酸种类较多、相对含量较高,Sn 组相对含量较低,这可能是果酒酿酒酵母与库德里阿兹威毕赤酵母代谢能力差异造成的。相对于其他发酵组,三菌发酵火龙果酒组(Zw 组)的酸类物质的含量较低,其原因可能是植物乳植杆菌分泌的脂肪酶在火龙果酒的发酵过程中分解了挥发性脂肪酸[39]。
高级醇对火龙果酒中的风味贡献较大,乙醇、2,3丁二醇、异戊醇、苯乙醇等是火龙果酒的主要醇类物质。乙醇在各发酵组中的相对含量最高,可为火龙果酒提供柔和、愉快的玫瑰香气[40]。此外,Zw 组和Sn 组苯乙醇和异戊醇相对含量较高,苯乙醇可以赋予火龙果酒良好的花果香,异戊醇可以赋予其酒香,有助于增加酒体的复杂性[41]。但是,相对于其他发酵组,三菌发酵火龙果酒组(Zw 组)高级醇相对含量较高,说明多菌株联合发酵有助于改善火龙果酒香味物质,而产生这种现象的原因可能是由于菌株的代谢不同造成的。研究发现2,3-丁二醇在酿酒酵母SCFF201 发酵组(Sc组)和三菌发酵火龙果酒组(Zw 组)的相对含量最高。2,3-丁二醇作为食用香料乙偶姻的还原产物,在果酒中会带来青香味,而它的含量在很大程度上受火龙果酒的氧化还原电位以及依赖还原型辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)的双乙酰还原酶和丙酮还原酶的活性影响[42-43]。
酯类化合物大多具有怡人的挥发性气味,有助于改善火龙果酒的感官价值。本试验各发酵组酯类分布各不相同,与Gong 等[44]的研究结果差异较大,可能是因为检测方法存在差异。乙酸乙酯在各组中占比最多,主要为火龙果酒带来甜香;乳酸乙酯、己酸乙酯等具有果香和奶油香气[45],在混菌发酵体系Sk 组有一定占比,而在Sn 组、Sc 组和Zw 组中未检测出该物质,但Sn 组的酯种类最多,说明库德里阿兹威毕赤酵母在一定程度上能促进这些酯的产生,有利于提升火龙果酒的感官特征。
2.5 不同发酵火龙果酒样品的感官评价
火龙果酒的品质与其颜色、香味、口感等因素有关,而这些指标与菌种、甜菜红素含量、pH 值、总酸含量等密切相关。在pH 值为4~7 时,甜菜红素呈现紫红色,稳定性好[26],火龙果酒感官评价结果如表4 所示。
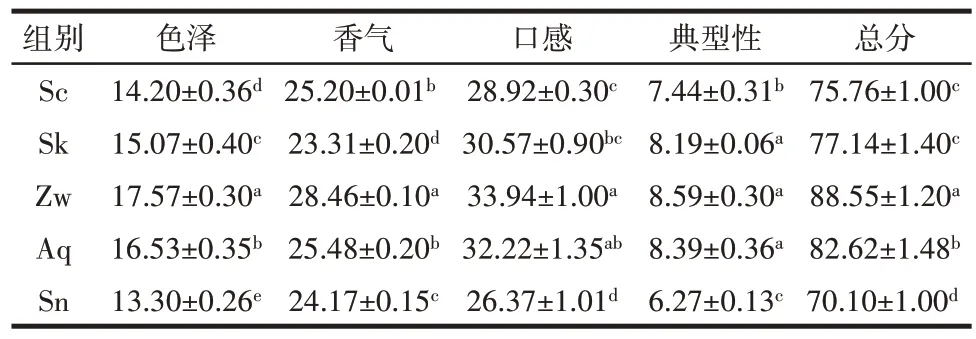
表4 火龙果酒感官评价结果Table 4 Sensory evaluation results of pitaya wine
由表4 可知,Sn 组的色泽与其他组有显著差异,Zw 组得分最高,Sn 组得分最低,与前文pH 值和甜菜红素含量变化相对应;Zw 组的口感得分最高,酸味较柔,有明显的花香、果香味,与苯乙醇、异丁醇、2,3-丁二醇相对含量较高有关。总体上Zw 组混菌发酵的火龙果酒降酸优势明显,颜色鲜艳,风格独特,口感更加柔和,更受欢迎。
3 结论
本研究以酿酒酵母、库德里阿兹威毕赤酵母和植物乳植杆菌单菌或联合发酵火龙果酒为基础,分析不同发酵火龙果酒的发酵特性及产生的风味物质的差异。与单菌发酵相比,酿酒酵母、库德里阿兹威毕赤酵母和植物乳植杆菌三菌组合发酵提高了糖的利用率,在一定程度上减少了甜菜红素损失和抗氧化能力降低的程度。在总酸、有机酸方面,三菌发酵的总酸、有机酸含量明显低于其他组,说明植物乳植杆菌在降酸方面有显著优势。结合风味物质种类及相对含量来看,三菌发酵产高级醇的种类和相对含量优于其他组。感官评价显示,三菌发酵的火龙果酒颜色鲜艳,香气浓郁,口感酸甜适中。因此,利用酿酒酵母、库德里阿兹威毕赤酵母和植物乳植杆菌联合发酵的方式明显改善了火龙果酒品质,为火龙果酒品质调控和产品开发提供科学依据。
