端粒酶、γ-干扰素、腺苷酸脱氨酶及结核感染T 细胞斑点试验在诊断结核性和恶性胸腔积液中的作用分析
2024-03-13由振华黄锦宏赵云根顾宇平程易凌春华
由振华,黄锦宏,赵云根,顾宇平,程易,凌春华
胸腔积液是胸膜疾病常见的临床表现,而结核性胸膜炎和肿瘤均可引起胸腔积液[1]。这2 种疾病的治疗方式截然不同,因此胸腔积液的病因诊断对疾病的治疗至关重要[2]。胸腔积液中是否有结核分枝杆菌是诊断的金标准,但是由于其不易检出,需反复抽取胸腔积液测定,患者依从性差[3]。近20 年来,随着分子生物学的迅速发展,细胞因子被越来越多地应用于各种疾病的诊断,如感染性疾病、肿瘤及免疫性疾病等。端粒酶是一种备受关注的肿瘤标志物,其在恶性肿瘤组织中的表达活性明显增强[4];γ-干扰素(interferon-γ, IFN-γ)是诊断结核性疾病的重要细胞因子之一,其可通过增强巨噬细胞的吞噬活性而在结核性疾病的免疫调节中发挥重要作用[5];腺苷酸脱氨酶(adenosine deaminase, ADA)是一种催化腺苷酸脱氨基生成鸟苷的酶,已经被用于结核性胸膜炎的诊断[6];T 细胞斑点试验(T cell spot test, T-SPOT.TB)对于各种结核性疾病的诊断有着极高的敏感度和特异度,已被广泛应用于临床,是结核性胸膜炎主要的诊断措施之一[7]。本研究拟选取端粒酶、IFN-γ、ADA 及结核T-SPOT.TB 4 个诊断指标,探索联合应用的诊断价值,以期为胸腔积液的鉴别诊断提供帮助。
1 对象与方法
1.1 研究对象 选择2017 年1 月至2020 年12 月在常熟市第二人民医院治疗的80 例胸腔积液患者作为研究对象。其中结核性胸腔积液患者40 例,男性患者17 例,女性患者23 例;年龄30~68 岁[(51.29 ± 6.80)岁];恶性胸腔积液40 例,男性18 例,女性22 例;年龄33~65 岁[(53.04 ± 6.48)岁]。2 组患者的性别、年龄比较差异无统计学意义(P>0.05),具有可比性。见表1。

表1 结核组与肿瘤组患者一般资料比较
1.2 诊断、纳入与排除标准 结核性胸膜炎诊断依据中华医学会《临床诊疗指南·结核病分册》[8]中的相关诊断标准。其中合并肺结核4 例,其他均为单纯结核性胸膜炎。恶性胸腔积液诊断标准:经胸腔穿刺、内科胸腔镜、纤维支气管镜等检查,取得病理组织(包括胸水),送检病理科,病理组织见癌细胞,恶性胸腔积液诊断明确,否认结核病史和结核病接触史。其中肺腺癌24 例,肺小细胞癌7 例,肺鳞状细胞癌5 例,其他类型肺癌4 例 。排除病毒感染者、免疫性疾病患者、严重肝肾功能损害者和孕妇。
1.3 标本采集 患者入院24 h 内查体和影像学检查胸腔积液,治疗前空腹抽取患者血液5 ml 和采用胸腔穿刺针抽取积液15 ml,随后以3 000 r/min 离心10 min,离心半径为30 cm,取上清液置于-80 °C中备用。并应用Ficoll 分离法分离外周血单个核细胞,备用。
1.4 检测方法及结果判定 应用酶联免疫吸附分析法分别检测端粒酶的含量和IFN-γ 的浓度,应用比色分析法检测ADA 的活性,使用北京百奥莱博科技有限公司提供的试剂盒;应用T-SPOT.TB 试剂盒检测T-SPOT.TB 阳性率,T-SPOT.TB 检测原理是检测外周血中单个核细胞中的效应T 细胞,其判断标准:当阴性对照孔斑点数为0~5 个时,任意1 个试验孔的斑点数减去阴性对照孔斑点数大于等于6,判为阳性;当阴性对照孔斑点数为6~10 个时,任意1 个试验孔的斑点数大于等于阴性对照孔斑点数的2 倍,判为阳性。
1.5 统计学处理 使用SPSS 17.0 统计软件进行数据分析。计量数据均行正态分布和方差齐性检验,以±s 表示,采用t检验;计数资料以例数和百分比(%)表示,采用χ2检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 结核组与肿瘤组患者胸腔积液中端粒酶、IFNγ、ADA 比较 结核组和肿瘤组的端粒酶含量分别为(1.46 ± 0.73)×10-3nmol/L 和(3.34 ± 1.72)×10-3nmol/L,差异有统计学意义(P<0.01);结核组和肿瘤组的IFN-γ 含量分别为(137.44 ± 38.93) U/L和(27.94 ± 8.46) U/L,差异有统计学意义(P<0.01)。结核组和肿瘤组的ADA 含量分别为(68.42 ± 9.58) U/L 和(15.39 ± 4.43) U/L,差异有统计学意义(P<0.01)。见表2。
表2 结核组与肿瘤组胸腔积液中端粒酶、IFN-γ、ADA 比较(±s)

表2 结核组与肿瘤组胸腔积液中端粒酶、IFN-γ、ADA 比较(±s)
注:IFN-γ 为γ-干扰素,ADA 为腺苷酸脱氨酶
组别结核组肿瘤组t 值P 值IFN-γ(ng/L)137.44 ± 38.93 27.94 ± 8.46 17.384<0.001 ADA(U/L)68.42 ± 9.58 15.39 ± 4.43 31.777<0.001例数40 40端粒酶(nmol/L)(1.46 ± 0.73)×10-3(3.34 ± 1.72)×10-3 6.363<0.001
2.2 肿瘤组与结核组端粒酶、IFN-γ、ADA 和TSPOT.TB 阳性率比较 根据试剂盒说明书,端粒酶浓度小于2.0×10-3nmol/L 则判断为阴性,结核组中端粒酶的阴性率(36 例,90.00%)高于肿瘤组(4 例,10.00%),差异有统计学意义(P<0.01);根据试剂盒说明书,IFN-γ 高于100 ng/L 判断为阳性,结核组中IFN-γ 的阳性率(34 例,85.00%)高于肿瘤组(6 例,15.00%),差异有统计学意义(P<0.01);根据试剂盒说明书,ADA 高于45 U/L 判断为阳性,结核组中ADA 的阳性率(36 例,90.00%)高于肿瘤组(5 例,12.50%),差异有统计学意义(P<0.01);结核组中T-SPOT.TB 阳性35 例,阴性5 例,阳性率为87.50%;肿瘤组中T-SPOT.TB 阳性3 例,阴性37 例,阳性率为7.50%。结核组T-SPOT.TB 的阳性率高于肿瘤组,差异有统计学意义(P<0.01)。见表3。
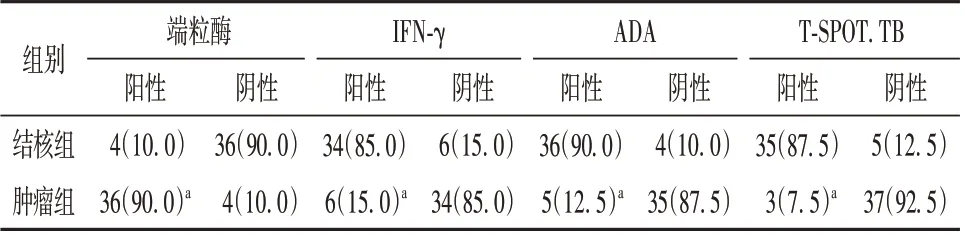
表3 结核组与肿瘤组端粒酶、IFN-γ、ADA 和T-SPOT.TB 阳性率比较[例(%), n=40]
2.3 端粒酶、IFN-γ、ADA 和T-SPOT.TB 单项与联合检测的敏感度、特异度和准确度分析 端粒酶、IFN-γ、ADA 和T-SPOT.TB 联合检测鉴别结核性胸腔积液与恶性胸腔积液的敏感度、特异度和准确度均高于4 项指标单项检测。见表4。

表4 端粒酶、IFN-γ、ADA 和T-SPOT.TB 单项与联合应用诊断的敏感度、特异度和准确度(%)
3 讨论
胸腔积液是临床上常见病、多发病,如今胸腔积液的鉴别主要是针对结核性和恶性胸腔积液[8-9]。结核性和恶性胸腔积液的治疗方案及预后均有着极大的差别。因此,对于两者的鉴别诊断具有重要的临床意义。目前,细菌学检查是诊断结核性胸腔积液的金标准,而病理学检查是诊断恶性胸腔积液的金标准,但是细菌学检查和病理学检查均存在阳性率低以及检测耗时长等不足[10]。因此,本研究联合应用端粒酶、IFN-γ、ADA、T-SPOT.TB 4 种诊断指标来鉴别2 种胸腔积液,探索联合应用以上4 种诊断指标的诊断试验在鉴别结核性胸腔积液和恶性胸腔积液中的价值,以期为临床工作中胸腔积液的鉴别诊断提供帮助。
端粒酶作为一种核糖核酸蛋白酶,可以自身RNA 为模板合成端粒DNA,使得端粒延伸并维持其稳定性[11]。端粒酶可将端粒DNA 加至真核细胞染色体末端,填补因DNA 复制而损失的端粒,使端粒修复延长,可以让端粒不会因细胞分裂而有所损耗,使得细胞分裂的次数增加。端粒在不同物种细胞中对于保持染色体稳定性和细胞活性有重要作用,端粒酶能延长缩短的端粒(缩短的端粒其细胞复制能力受限),从而增强体外细胞的增殖能力。端粒酶在保持端粒稳定、细胞长期的活性、基因组完整和潜在的继续增殖能力等方面有重要作用。目前研究发现,端粒酶在正常人体组织中的活性被抑制,其长度随着细胞分裂的进行而缩短。然而,端粒酶的活性在肿瘤细胞中被重新激活,使得肿瘤细胞可以逃避衰老[12],从而参与恶性肿瘤的发生发展。参与肿瘤恶性转化的端粒酶成为目前最常用的肿瘤分子标志物之一。本研究结果显示,结核组胸腔积液中的端粒酶含量低于肿瘤组,差异有统计学意义;当端粒酶低于2.0×10-3nmol/L 时结果判断为阴性,根据此标准,结核组和肿瘤组中端粒酶的阴性患者分别为36 例和4 例,结核组中端粒酶的阴性率高于肿瘤组。刘然等[13]和程江涛等[14]研究均发现结核性胸腔积液中端粒酶的含量和阳性率低于恶性胸腔积液,与本研究结果一致。
IFN-γ 属于一种分泌蛋白,具有调节免疫系统的作用[15-16]。IFN-γ 主要通过促进巨噬细胞对抗原呈递及增强巨噬细胞的胞内杀菌能力而起到抗结核免疫调节的作用。结核性胸腔积液中IFN-γ 的水平高于非结核性的胸腔积液。陈林[17]研究发现,结核性胸腔积液中的IFN-γ 水平高于恶性胸腔积液,IFN-γ 水平对于结核性胸膜炎诊断的敏感度为90.3%、特异度为79.5%;孙冰等[18]研究发现,与包括白细胞介素6(interleukin-6, IL-6)、IL-4 在内的其他6 种细胞因子相比,IFN-γ 对结核性胸腔积液的敏感度、特异度和准确度均最高。本研究结果显示,结核组的IFN-γ 水平高于肿瘤组,差异有统计学意义;结核组IFN-γ 的阳性率为85.00%,而肿瘤组的阳性率为15.00%,结核组IFN-γ 的阳性率高于肿瘤组,与既往的研究结果相一致[17]。当发生结核性胸膜炎时,结核抗原的刺激会引起胸腔积液中CD4+T 细胞反应明显增加。CD4+T 细胞是细胞因子IFN-γ 的直接来源,因此,胸腔积液中的IFN-γ 水平明显增高。
ADA 是一种嘌呤核苷分解代谢中的重要酶类,较早应用在临床上诊断结核性胸膜炎,其在淋巴细胞尤其是T 淋巴细胞中含量高于其他细胞组织[19]。临床上胸腔积液中ADA 大于40 U/L 提示为结核性胸腔积液的可能性较高。结核性胸膜炎的细胞免疫反应以T 淋巴细胞为主,因此,胸腔积液中ADA的含量可被用于结核性胸膜炎的诊断[20]。黄晓磊等[21]研究发现,结核性胸腔积液组患者中ADA 含量高于恶性胸腔积液组,ADA 含量对结核性胸膜炎诊断的敏感度和特异度均达到了75% 以上。本研究中结核组患者胸腔积液中的ADA 含量高于肿瘤组,结核组和肿瘤组胸腔积液中ADA 的阳性率分别为90.00% 和12.50%,ADA 在结核组中的阳性率高于肿瘤组。T-SPOT.TB 是一种运用IGRA 技术,检测被结核分支杆菌特异的早期分泌靶抗原6和培养滤液蛋白10 分别刺激后释放IFN-γ 的效应T 淋巴细胞,以辅助诊断结核感染的一种实验室检测技术。该技术从单个细胞水平上检测分泌抗体细胞的数量,且不受细胞因子代谢的干扰。因此,该检测方法可以准确地反映体内细胞因子的水平。试验结果用每25 万个外周血单个核细胞中斑点形成细胞的数目来判定阴阳性结果。通过对斑点形成细胞的计数来评估机体是否存在结核杆菌感染,已成为诊断结核性疾病的重要方法之一。大量研究发现T-SPOT.TB 对于肺外结核的诊断具有高度敏感性,在临床上具有重要的诊断和鉴别诊断价值[22-26]。本研究结果显示,结核组中患者T-SPOT.T的阳性率高于肿瘤组(87.50%vs.7.50%),且差异有统计学意义。
4 结论
端粒酶、IFN-γ、ADA、T-SPOT.TB 的单独检测在结核性胸腔积液和恶性胸腔积液的诊断及鉴别诊断方面具有重要的临床参考价值,同时发现4 项指标联合检测的准确度、特异度和敏感度均达到了97.50%,均高于任何一项单独检测的敏感度、特异度和准确度。说明四者在鉴别结核性和恶性胸腔积液中具有互补性,4 项联合检测在结核性和恶性胸腔积液鉴别诊断中具有重要价值,值得临床推广。本研究不足之处在于没有将其他疾病如心力衰竭、感染、结缔组织病等疾病引起的胸腔积液及其相关指标纳入研究检测范围,有待于进一步对其他病因的胸腔积液共同分析,为临床对胸腔积液的诊断提供更全面的参考。
