微小核糖核酸-155 对肝癌细胞增殖、侵袭迁移和凋亡的影响
2024-03-13秦焕蓉吴祥锴江哲宇林丽云王黎洲
秦焕蓉,吴祥锴,江哲宇,张 赟,林丽云,王黎洲,周 石
在肝细胞癌(hepatocellular carcinoma,HCC)进展过程中有多种基因改变,其中微小核糖核酸(miRNA)参与细胞分化、代谢和发育等各种生物过程,在肿瘤组织中异常表达,与肿瘤发生密切相关[1-5]。研究发现,乳腺癌患者miR-155 水平升高有利于抗肿瘤免疫特征且与更好的预后相关[6];而宫颈癌患者miR-155 水平升高与不良预后相关[7]。miR-155 在肝癌中表达上调,通过PI3K-AKT 通路抑制磷酸酶和紧张素同源物(PTEN)进而促进肝癌的进展[8]。然而miR-155 是否存在其他下游靶点影响肝癌的进展仍不清楚。本研究通过构建miR-155 沉默稳转株以探讨miR-155 对肝癌细胞增殖、侵袭、迁移和凋亡影响的机制。
1 材料与方法
1.1 细胞培养
用含10%FBS,1%青、 链霉素的完全培养基培养Huh7 人肝癌细胞(中国科学院细胞库),当细胞融合度达到85%以上时进行传代培养,3 次传代后待细胞状态稳定后进行检测。
1.2 稳转株构建
取对数增长期的Huh7 肝癌细胞1×105个接种于6 孔板,待细胞生长至30%~40%,根据慢病毒说明书中推荐的复感染指数=5,换算最佳接种病毒滴度进行转染操作,分别转染shNC、sh-miR-155慢病毒,转染16 h 后进行细胞换液。待细胞长至85%左右将细胞传代至T25 培养瓶,3~4 d 基因表达稳定后,将细胞用胰酶消化离心传代,细胞贴壁后用含2 μg/mL 嘌呤霉素的完全培养基进行稳转细胞株的筛选,反复药筛。待无细胞死亡时,实时荧光定量聚合酶链反应(RT-qPCR)检测病毒转染效果,转染成功后传代冻存10 管稳转株,以备后续实验使用,在此过程中用含1 μg/mL 嘌呤霉素的完全培养基维持。阴性对照组为转染空载病毒细胞(shNC),转染抑制基因病毒(sh-miR-155)为沉默组。
1.3 RT-qPCR
将Blank、shNC、sh-miR-155 三组细胞分别取2×104个接种于6 孔板,待细胞长至90%左右,采用RNA 快速提取试剂盒(上海奕杉生物科技有限公司)分别提取各组RNA,反转录试剂盒(日本TaKaRa)将RNA 反转录为cDNA,RT-qPCR 得到各组Ct 值。U6 作为内参,根据公式:①ΔCt=各组Ct1(miR-155)-Ct2(U6);②ΔΔCt=各组ΔCt 值-Blank 组的ΔCt 均值;③miR-155 表达=2-ΔΔCt;④miR-155 相对表达=各组2-ΔΔCt/Blank 组2-ΔΔCt。
1.4 MTT 实验
将Blank、shNC、sh- miR- 155、sh- miR- 155+Recilisib、shNC+Recilisib 等5 组细胞分别用胰酶消化后用完全培养基重悬,调整细胞数量为1×104个/mL。以每孔100 μL 接种于96 孔板,每组设置三个复孔,待细胞贴壁生长后,每孔加入MTT 溶液(5 mg/mL,即0.5%MTT)10 μL ,继续培养4 h,加入结晶紫溶液,放入酶标仪A490 nm 和A630 nm 处测量各孔的吸光度值。按照公式计算细胞增殖率=[A experimental group(630 nm-490 nm)/A blank group(630 nm-490 nm)] × 100%。
1.5 Transwell 实验
①迁移: 取各组对数生长期细胞,将细胞消化、离心后,细胞计数,每室铺2×104个细胞,向小室下室加入含20%FBS 的高糖培养基,再轻轻向小室上室加入细胞悬液,避免出现气泡,将培养板置于培养箱48 h 后收样,上室细胞用棉签擦拭,接着使用4%多聚甲醛固定30 min,0.1%结晶紫染色20 min,用水清洗后晾干,使用倒置显微镜于200 倍视野下拍5 个视野。②侵袭:提前将枪头和小室放入-20°冰箱预冷,向小室上室加入基质胶使其均匀地铺在小室,第2 天提前半小时将小室置于无血清的培养基中水化,取各组对数生长期细胞,按每室铺5×104个细胞计算细胞悬液量,接着向小室下室加入含20%FBS 培养基。然后将小室置于24 孔板内,每孔加入无血清细胞悬液到小室上室中,细胞生长48 h 后,弃去培养基,用棉签轻轻擦拭干净上室中的基质胶,下室加入1 mL 多聚甲醛固定约30 min,然后用0.1%结晶紫浸泡20 min,PBS 涮洗3 遍,晾干后将24 孔板置于200 倍显微镜下选取5 个视野拍照并计数。
1.6 流式细胞术
将各组细胞消化、离心后,计数并调整细胞为2×105个/mL,培养体系为2 mL 接种于6 孔板,培养箱培养24 h,离心收取细胞沉淀,按照试剂盒说明书依次加入Annexin V-APC/PI 结合液,Annexin V-APC 和PI 染液混匀,轻轻吹打重悬细胞,室温孵育10~15 min,加入预冷PBS 混匀,上机检测各组细胞凋亡情况。
1.7 双荧光素酶实验
为了检测PTPN21 与miR-155 结合,取对数生长期293T 细胞,将其随机分为转染miR-155模拟物组(mimicNC 组)和转染miR-155 抑制剂组(miR-155-3p mimic 组),细胞计数,计算细胞密度为5×104个/mL 所需细胞悬液量,分别接种至48 孔细胞培养板,每个浓度梯度3 个复孔。制备转染复合物,转染后48 h,收集细胞检测各组荧光素酶活性,取样品20 μL,加入100 μL 荧光素酶检测试剂测得相对光单位1(RLU1),完成后,加入100 μL 海肾荧光素酶检测试剂测得相对光单位2(RLU2)。目的基因的激活程度=RLU1/RLU2。
1.8 蛋白质印迹实验
胰酶消化细胞获得细胞沉淀,向Western 及IP裂解液中加入蛋白酶抑制剂和磷酸酶抑制剂(Western 及IP 裂解液∶酶抑制剂=100∶1)。在冰上充分裂解30 min,每5 min 震荡1 次,超声破碎后通过高速离心机(12 000 r,15 min)获得蛋白上清液,并使用BCA 试剂盒(索莱宝)配合酶标仪在562 nm 波长条件下测量细胞的蛋白浓度。在60 V(30 min)和110 V (1 h)下,采用一步法聚丙烯酰胺凝胶快速制备试剂盒(10%)(上海雅酶生物医药科技有限公司)凝胶电泳分离蛋白。电泳后,在4℃冷室中用湿电转移法将蛋白转移到聚偏二氟乙烯(PVDF)膜(德国Amersham 公司)上。然后,将PVDF 膜用5%脱脂牛奶密封,室温孵育2 h,一抗在4℃孵育过夜。次日用含0.1%Tween-20 的Tris 缓冲盐溶液(TBST)洗涤3 次,加入羊抗兔IgG 二抗,室温孵育2 h,再次用TBST 洗涤3 次,将膜用ECL 曝光液浸泡在暗盒里孵育30 s左右放入凝胶成像系统中,最后再将条带导入Image J 软件进行各组蛋白表达水平灰度分析。
1.9 统计学分析
采用SPSS 26.0 统计软件分析实验数据。正态分布的计量资料以表示,多组资料比较采用单因素方差分析,组间两两比较用LSD-t检验,P<0.05为差异有统计学意义。折线图及柱状图通过GraphPad 8.0 软件制作。
2 结果
2.1 shNC 和sh-miR-155 转染Huh7 人肝癌细胞
RT-qPCR 检验转染效果,sh-miR-155 组中miR-155 的表达水平显著低于Blank 组及shNC 组(P<0.000 1),miR-155 在Blank 组及shNC 组表达水平差异无统计学意义(P>0.05),见图1。
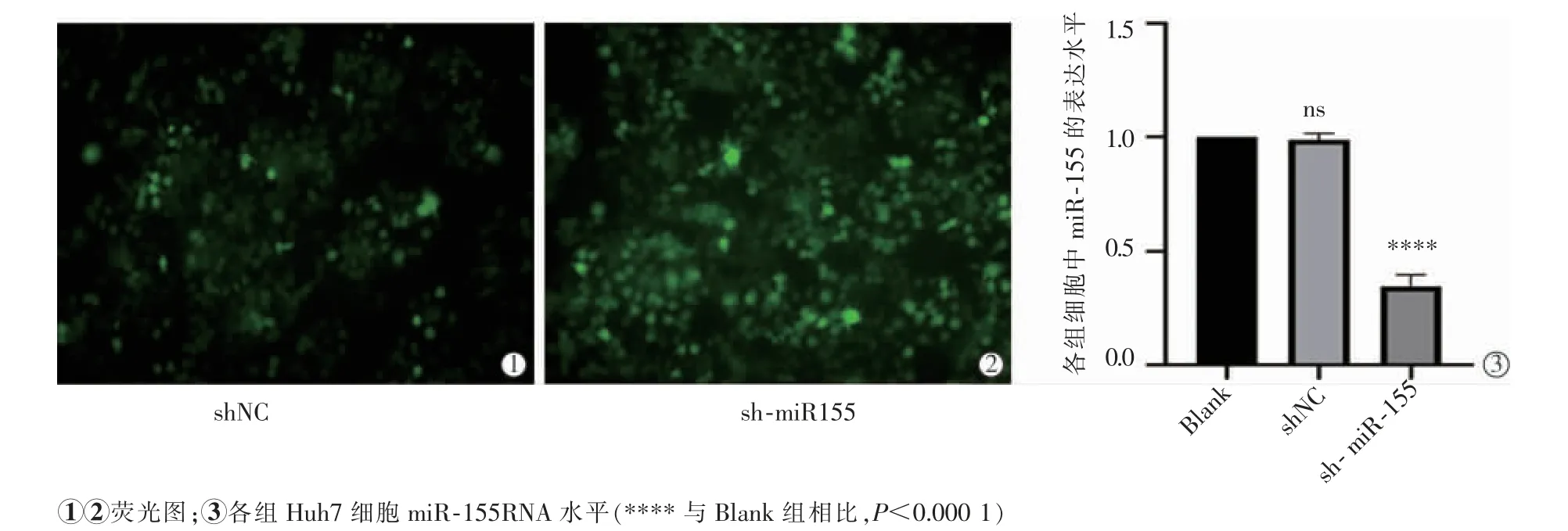
图1 转染shNC、sh-miR-155 后荧光图及其转染效率
2.2 miR-155 靶向调控PTPN21 的表达
根据microRNA 靶基因预测在线数据库(http://www.targetscan.org/vert_70/)(http://mirwalk.umm.uniheidelberg.de/)和(http://mirdb.org/miRDB/)预测PTPN21 基因3' 非翻译区(PTPN21-3'-UTR)上存在与miR-155 的潜在靶向结合点。双荧光素酶实验结果显示,miR-155-3p 与PTPN21 有2 个结合位点,2 个位点分别设计PTPN21- 3'UTR 突变序列(PTPN21-3'UTR MUT-1)和(PTPN21-3'UTR MUT-2)。miR-155-3p 可以和PTPN21-3'UTR 野生型(PTPN21-3'UTR WT)结合使双荧光素酶活性增强,MUT-1 位点突变后双荧光素酶的活性也增强,说明该位点不是结合位点; 而MUT-2 位点突变后双荧光素酶活性没有变化,说明该位点是结合位点。通过双荧光素酶实验得出:miR-155-3p 可与PTPN21 结合,且结合位点是MUT-2 对应的序列,见图2。

图2 双荧光素酶实验检测miR-155 与PTPN21 的关系
2.3 沉默miR-155 抑制肝癌细胞的增殖
MTT 结果显示,sh-miR-155 组中Huh7 细胞在2、3、4、5 d 时A 值均低于Blank 组及shNC 组(P<0.000 1),而Blank 组与shNC 组差异无统计学意义(P>0.05);sh-miR-155 组在2、3、4、5 d 时A 值低于sh-miR-155+Recilisib 组及shNC+Recilisib 组(P=0.005 2,P<0.000 1),而sh-miR-155+Recilisib 在2、3、4、5 d 时A 值低于shNC+Recilisib 组(P<0.000 1),见图3。
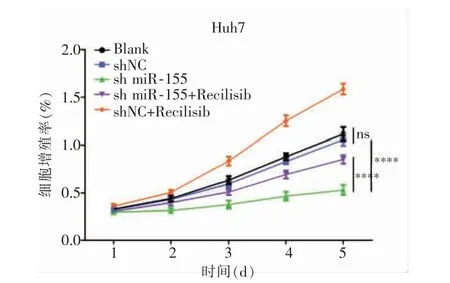
图3 MTT 检测各组细胞增殖能力(**** 与Blank 组相比,P<0.000 1)
2.4 沉默miR-155 抑制肝癌细胞的迁移和侵袭
Blank 组与shNC 组迁移及侵袭细胞数差异无统计学意义(P>0.05),在激活PI3K-AKT 信号通路后,与Blank 组相比,shNC+Recilisib 组肝癌细胞的迁移、侵袭能力显著增加(P<0.000 1)。相反,沉默miR-155 后Huh7 细胞的迁移及侵袭细胞数明显低于Blank 组及shNC 组(P<0.000 1),而PI3K 激动剂逆转了这一现象,与sh-miR-155 组相比,sh-miR-155+Recilisib 组肝癌细胞的迁移、 侵袭能力增强(P=0.000 2),见图4。
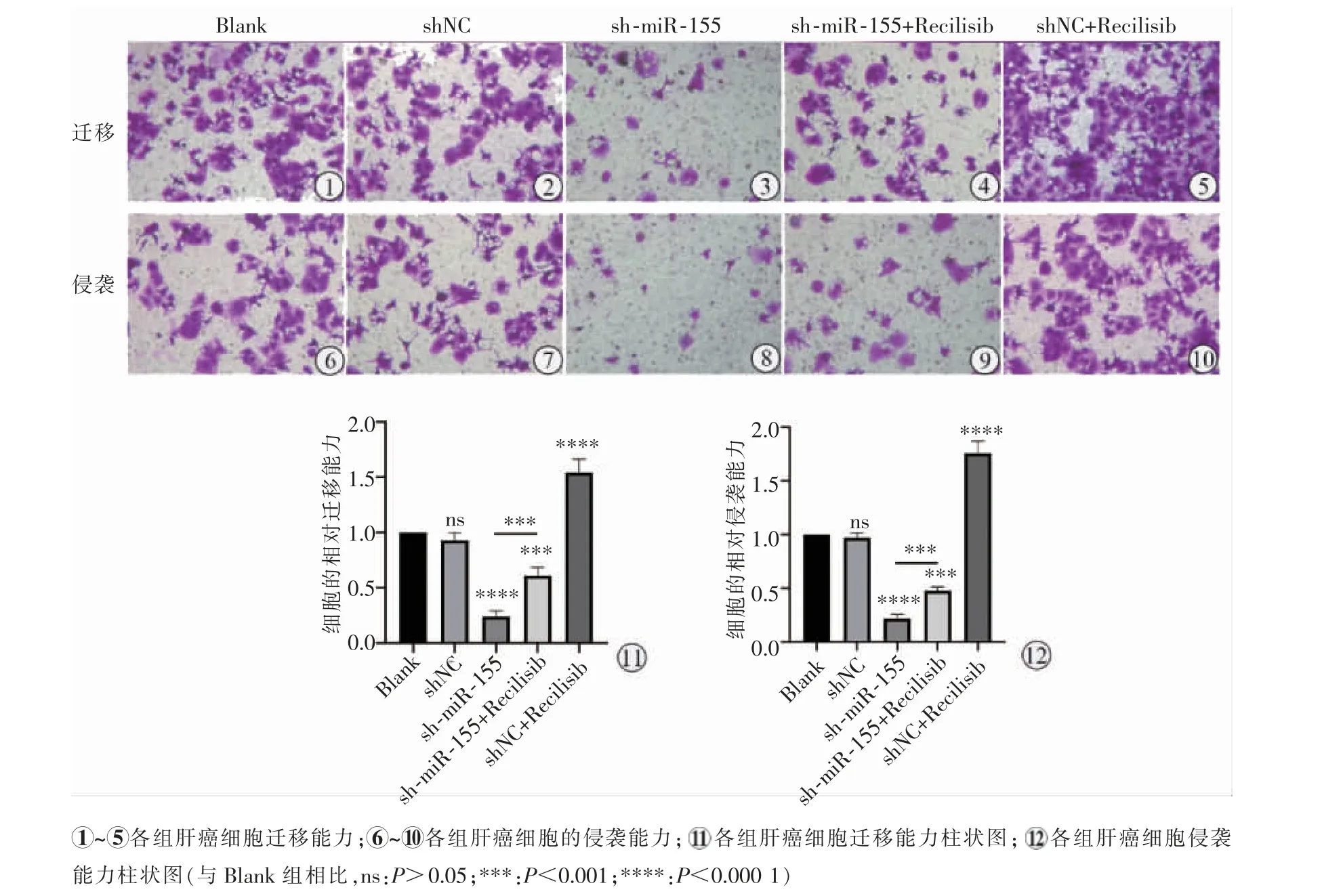
图4 Transwell 检测各组细胞侵袭及迁移能力
2.5 敲低miR-155 促进肝癌细胞的凋亡
流式细胞术结果显示,Blank 组、shNC 和shNC+Recilisib 组之间细胞凋亡率差异无统计学意义(P>0.05)。与Blank 组相比,sh-miR-155 组细胞凋亡率显著增加(P<0.000 1),并且sh-miR-155 组细胞凋亡率高于sh-miR-155+Recilisib 组(P<0.000 1),见图5。
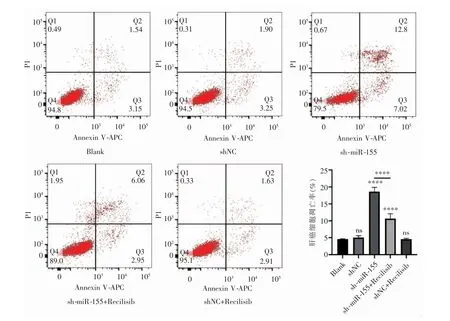
图5 各组肝癌细胞流式细胞术图及凋亡分析柱状图(与Blank 组相比,ns:P>0.05;****:P<0.000 1)
2.6 miR-155 对PTPN21、PI3K-AKT 信号通路及凋亡相关蛋白的影响
蛋白印迹实验结果显示,与Blank 组相比,沉默miR-155 后促凋亡蛋白Caspase-3 和BAX 表达水平显著增加(P<0.000 1),而抗凋亡蛋白BCL2 的表达量明显降低(P<0.000 1); 此外,sh-miR-155 组与Blank 组相比PTPN21 表达明显下调(P<0.000 1),而在PI3K-AKT 信号通路激活时PTPN21 表达较shmiR-155 组高(P<0.000 1),但sh-miR-155+Recilisib组PTPN21 表达仍低于Blank 组(P=0.000 2);与Blank组相比,在沉默miR-155 后P-AKT 和P-PI3K 的表达显著下降(P<0.000 1),且sh-miR-155+Recilisib 组P-AKT 和P-PI3K 表达也较Blank 组低(P=0.017 7,P=0.031 3),而sh-miR-155+Recilisib 组P-AKT和P-PI3K 表达较sh-miR-155 组高(P<0.000 1,P=0.001 4),PI3K 与AKT 在各组肝癌细胞之间的差异无统计学意义(P>0.05),见图6。
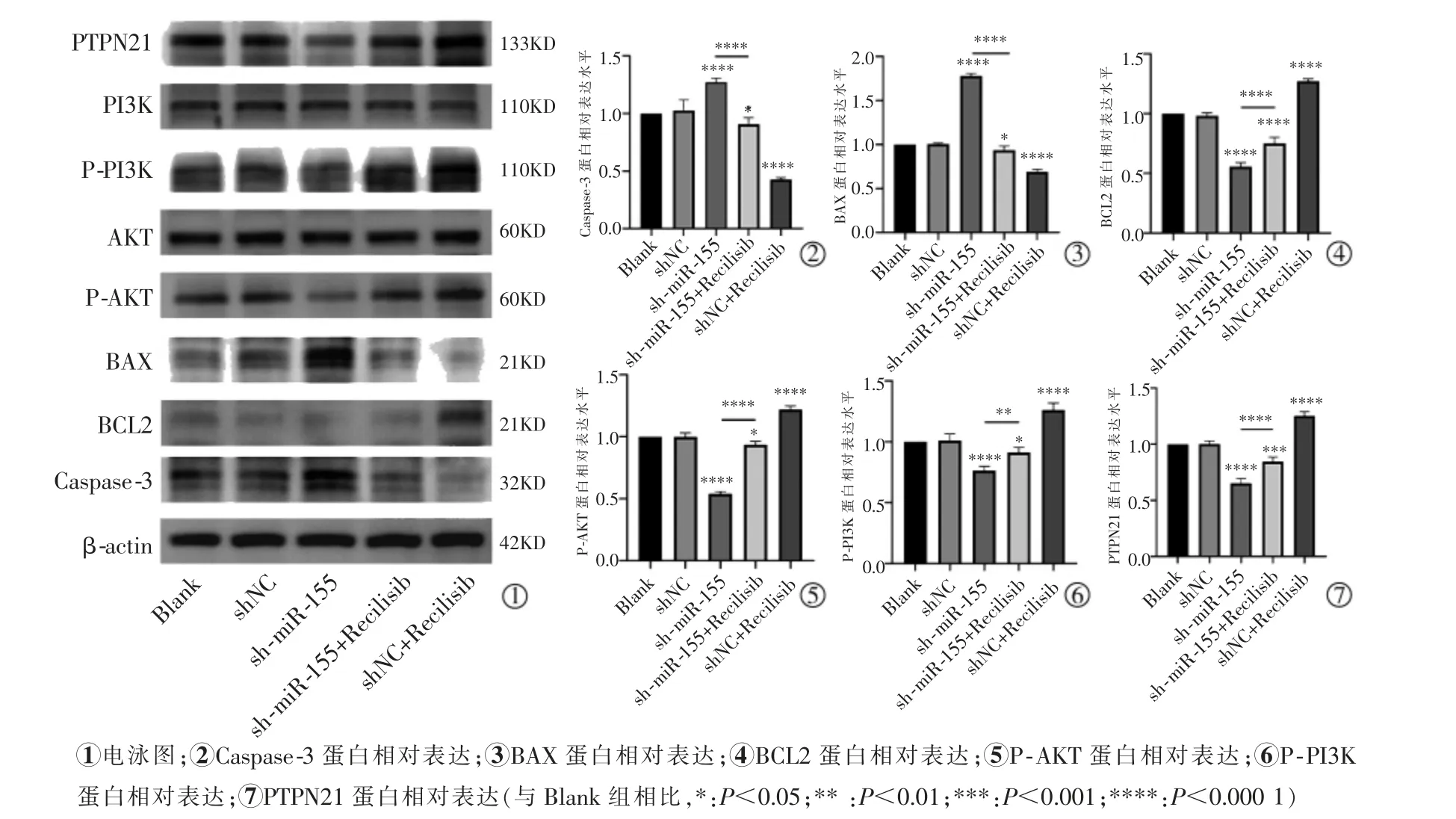
图6 蛋白质印迹检测PTPN21、PI3K-AKT 信号通路及凋亡相关蛋白
3 讨论
研究表明,miRNA 与肿瘤的发生有密切关系,致癌相关miRNA 的过表达通过沉默肿瘤抑制因子或参与细胞分化中的某一过程,最终影响肿瘤组织血管生成、增殖及侵袭水平导致肿瘤形成[9-11]。miR-155 作为一类癌症相关miRNA,在各种肿瘤细胞中表达量增加,如胃癌、膀胱癌、结直肠癌、乳腺癌和其他实性恶性肿瘤,并发挥不同的作用[12]。此外,miR-155 在肝癌中高表达,并与HCC 患者不良的临床病理特征和较低生存率相关[13]。本研究通过构建miR-155 沉默稳转株,探讨下调miR-155 后对肝癌细胞增殖和侵袭迁移影响的机制。
PTPN21 在肺癌[14]、膀胱肿瘤[15]及非霍奇金淋巴瘤[16]中高表达,同时参与肿瘤细胞的生长过程,但其在肝癌中的作用机制尚不明确。本研究发现,PTPN21 基因3'-UTR 上存在与miR-155 相结合的潜在靶点。双荧光素酶实验结果显示,miR-155-3p与PTPN21 有2 个结合位点,2 个位点分别设计突变序列MUT-1 和MUT-2,MUT-1 位点突变后双荧光素酶的活性增强,而MUT-2 位点突变后双荧光素酶活性没有变化,说明MUT-2 是结合位点,并且miR-155 沉默可以抑制PTPN21 的表达,提示PTPN21 是miR-155 的下游靶点。
PI3K-AKT 通路是调控细胞生长、代谢、增殖、存活、转录和蛋白质合成的关键调控中心[17]。研究表明,miRNA 在调控PI3K-AKT 通路中发挥着至关重要的作用,其通过靶向PI3K-AKT 信号轴,在调节细胞增殖、凋亡和代谢方面具有重要意义[18-19]。本研究发现下调miR-155 后,各组PI3K、AKT 总蛋白变化不明显,而磷酸化蛋白P-PI3K、P-AKT 表达量明显下降,提示miR-155 的表达与PI3K-AKT 通路呈正相关。为了进一步验证miR-155 对肝癌细胞生长影响是通过PI3K-AKT 通路实现的,本实验在shNC组及沉默miR-155 的同时应用PI3K-AKT 通路激动剂,观察PI3K-AKT 通路相关蛋白的变化情况,结果显示,与shNC+Recilisib 组相比,miR-155 可抑制P-PI3K 及P-AKT 的表达,提示miR-155 可通过调控PI3K-AKT 通路影响HCC 生长。MTT 实验发现,沉默miR-155 可抑制肝癌细胞的增殖。此外,流式细胞术结果显示,与Blank 组及shNC 组相比,shmiR-155 组细胞凋亡率显著增加,Blank 组和shNC组细胞凋亡量无显著变化,差异无统计学意义。细胞凋亡常与多个信号传导通路密切相关,其中BCL-2及Caspase 家族蛋白扮演着重要角色,当细胞进入凋亡途径时,抑凋亡蛋白BCL-2 表达水平下调,而促凋亡蛋白BAX 表达上调,其下游Caspase 家族蛋白接受凋亡信号,进而激活Caspase-3 活化,执行凋亡程序[20]。本研究结果显示,sh-miR-155 组与Blank组及shNC 组相比,抑凋亡蛋白BCL-2 表达水平显著降低,促凋亡蛋白Caspase-3 及BAX 表达水平显著提高,加速了肝癌细胞凋亡进程。
有研究表明,沉默PTPN21 通过调控PI3K-AKT信号通路抑制胶质瘤的进展[21]。本研究中,Transwell结果显示,沉默miR-155 明显抑制肝癌细胞侵袭及迁移。以上实验表明,miR-155 通过靶向PTPN21 调控PI3K-AKT 信号通路,进而影响肝癌细胞生长,提示miR-155 在肝癌发生发展过程中发挥促癌基因的作用。
综上所述,沉默Huh7 细胞中miR-155 通过靶向PTPN21 调控PI3K-AKT 信号通路抑制肝癌细胞生长。因此,miR-155 可能是未来HCC 患者的辅助诊断指标之一,也为临床治疗HCC 患者提供了新的治疗靶点。