特立帕肽对大鼠药物相关性颌骨坏死模型作用的 实验研究
2024-03-12廖晨羽徐陆晨李运峰
廖晨羽,徐陆晨,李运峰
(1.口腔疾病研究国家重点实验室,国家口腔疾病临床研究中心,四川大学华西口腔医院正颌及关节外科,成都 610041;2.同济大学附属口腔医院口腔颌面外科,上海牙组织修复与再生工程技术研究中心,上海 200072)
药物相关性颌骨坏死(MRONJ)是一种使用抗骨吸收药物、抗血管生成药物后产生的严重不良反应[1];临床上主要表现为颌骨坏死、骨暴露及感染(如肿胀、疼痛、流脓)长期存在,其具体的发病机制仍不明确,可能包括骨改建抑制、微循环障碍、炎症、感染及持续存在的微创伤等[2]。现已发现的可导致MRONJ 发生的药物包括抗骨吸收药物双膦酸盐类药物(bisphosphonates,BPs)、狄诺塞麦(denosumab)、抗血管生成药贝伐单抗(bevacizumab)、酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)舒尼替尼(sunitinib)、哺乳动物雷帕霉素靶向基因(mammalian target of rapamycin,mTOR)抑制剂西罗莫司(sirolimus)等[3]。
关于MRONJ 的治疗,临床上所使用的治疗方法主要包括保守治疗及手术治疗。保守治疗包括臭氧疗法(ozone therapy,OT)、高压氧治疗(hyperbaric oxygen,HBO)、局部低剂量激光治疗(low-intensity laser therapy,LILT)等[4-6],不同方法的治疗效果尚不明确。特立帕肽(teriparatide),即重组人甲状旁 腺激素1-34(recombinant human parathyroid hormone 1-34,rhPTH 1-34)是一种合成的多肽激素,为人甲状旁腺素的1-34 氨基酸片段,其生物学特性与内源性甲状旁腺素完全相同,是一种甲状旁腺激素的同化剂。特立帕肽刺激骨形成和骨吸收,可减少绝经后妇女骨折的发生率,主要用于原发性骨质疏松及性腺功能减退性骨质疏松、绝经后骨质疏松[7]。鉴于MRONJ 主要是由抗骨吸收、抗血管生成药物引起,特立帕肽促进骨代谢的作用可能对MRONJ 具有潜在的治疗价值,并引起了学者们的重视[8-9]。本实验旨在建立稳定的MRONJ 动物模型,探究特立帕肽对MRONJ 的治疗作用。
1 材料和方法
1.1 实验动物
选择10 月龄雌性SD 大鼠,体质量400~450 g,购自四川大学实验动物中心。所有动物饲养于可控环境中,保持恒定适宜的温度、光照和湿度,所有动物接受相同的饮食条件。所有动物接受MRONJ 建模操作,将建模成功的动物随机分为2 组,比较特立帕肽的治疗效果。本研究通过四川大学华西口腔医院伦理委员会审批(批准号:WCHSIRB-D-2017-197)。
1.2 MRONJ 动物模型的建立
经大鼠尾静脉注射唑来膦酸溶液(80 μg/kg),每周1 次,持续 7 周,第8 周拔除右上颌第一、第二磨牙。拔牙方法参照李庆帆等[10]研究中的拔牙方法。经10%水合氯醛(3.3 mL/kg)腹腔注射麻醉后,将大鼠放置为仰卧位,放置自制开口器,局部消毒,用2%利多卡因麻醉后,使用探针拔除大鼠右上颌第一、第二磨牙(图1)。拔牙术后8 周,观察大鼠颌骨坏死情况,建模成功的动物用于后续实验[11-14]。

图1 拔除大鼠右上颌第一、第二磨牙Figure 1 The first and second molars of the right maxillary of rats were extracted
1.3 特立帕肽对MRONJ 的治疗作用
将MRONJ 建模成功的大鼠随机分成对照组和实验组,每组各6 只。对照组动物接受皮下生理盐水注射,实验组动物接受皮下特立帕肽溶液注射(60 μg/kg,每周3 次),每周拍照观察大鼠骨坏死区域的愈合情况,4 周后将所有大鼠行安乐死处理,收集标本,采用大体观察、组织学检测、micro-CT 检测评价2 组动物的骨愈合情况。
2 结果
2.1 大鼠MRONJ 模型的建立
拔牙术后第2 周观察大鼠拔牙创愈合情况,部分大鼠右上颌拔牙创未闭合,见骨面暴露,MRONJ 模型建立成功率约为67%(图2)。
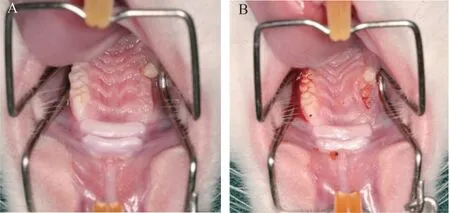
图2 建立MRONJ 动物模型的结果Figure 2 Results of the establishment of MRONJ
2.2 大体观察结果
治疗4 周的过程中,对照组所有动物的骨创面均未愈合,且有逐渐扩大及骨坏死加重的趋势(图3)。特立帕肽治疗的动物中,部分动物骨创面逐渐缩小,最终完全愈合,治愈率约为66.7%(6 只动物中4 只痊愈)(图4)。
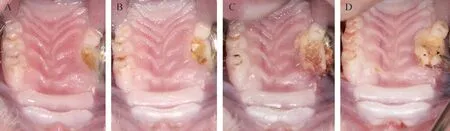
图3 对照组(生理盐水治疗)动物颌骨坏死随时间的变化情况Figure 3 Changes in osteonecrosis of the jaws over time in the control group (saline treatment)

图4 实验组(特立帕肽治疗)动物颌骨坏死随时间的变化情况Figure 4 Changes in osteonecrosis of the jaw over time in the experimental group (teriparatide treatment)
2.3 组织学检测和micro-CT 结果
治疗4 周后,对照组拔牙创均未愈合,组织切片结果示拔牙创内组织结构紊乱,未形成正常骨组织排列;而实验组中,部分痊愈动物的组织切片结果示拔牙创完全愈合,形成正常骨组织排列(图5)。micro-CT 的结果与组织学类似,对照组micro-CT 影像见拔牙窝空虚,骨创未愈;而实验组中,部分痊愈动物的micro-CT 影像见拔牙窝愈合,充满正常的骨组织(图6)。

图5 颌骨坏死区域的苏木精-伊红(hematoxylin and eosin,HE)染色图片(×100)Figure 5 Hematoxylin and eosin(HE)staining of osteonecrotic area of the jaw(×100)

图6 颌骨坏死区域的micro-CT 图片Figure 6 Micro-CT images showing the osteonecrotic area of the jaw
3 讨论
MRONJ 的诊断标准包括正在使用或曾经使用过抗骨吸收或抗血管生成药物治疗、颌面部死骨暴露或能探查到死骨的窦道存在8 周以上、排除口腔颌面部放射治疗病史及肿瘤转移性病变[2]。为了加强对MRONJ 的准确诊断及病情分析,需结合患者的临床表现及影像学改变,其中CT 检查是针对MRONJ 的影像学检查中最有用的检查方式之一,其影像学检查主要表现为持续存在的拔牙窝及拔牙窝周围的骨坏死[15]。
为进行MRONJ 相关研究,学者们[12-14]通过不同方法建立了MRONJ 的动物模型,成功率各不相同。关于MRONJ 在上、下颌骨的发生率是否有差异仍有争议[13-15]。通过拔除上颌磨牙或下颌磨牙来建立MRONJ 动物模型的实验中,因用药剂量、用药持续时间、操作方法不同,也无法进行MRONJ 发生率的比较[16]。本实验结合前期文献[12-14],采用10 月龄雌性SD 大鼠作为研究对象,经尾静脉注射唑来膦酸后,拔除大鼠上颌磨牙来建立MRONJ 模型,建模成功率约为67%。
BPs 会造成骨内的毛细血管网丧失,导致颌骨局部缺血和营养供应不足,从而干扰伤口愈合过程,甚至造成颌骨坏死。通过实验建立MRONJ 动物模型,尚不能达到100%的成功率,这可能跟大鼠的个体差异有关,尤其与大鼠颌骨血液供应及创伤愈合能力密切相关。目前,我们仍不清楚建模失败的具体原因是什么。
BPs 被广泛用于治疗以钙和骨代谢紊乱为特征的骨病[17-18]。随着其应用增加,由其导致MRONJ 的报道逐渐增加。已有研究[19]表明,BPs 对骨骼矿物质有高亲和性,且骨骼中药物半衰期非常长,骨中BPs 的长期滞留和骨改建的长期抑制可导致创伤长期不愈合[20-21]。停药在临床上难以很快奏效,且停药对肿瘤患者有何影响,暂不明确,故因BPs 治疗引起的MRONJ 已引起广泛重视。特立帕肽可通过刺激骨母细胞增殖、骨基质蛋白合成和破骨细胞生成来诱导骨转换和增加骨量[22]。同时,特立帕肽还可消除BPs 对破骨细胞的抑制作用[23],故特立帕肽被认为对治疗MRONJ 有效。但也有研究[24]表明,特立帕肽可诱导大鼠骨肉瘤的发生,且其发生呈现剂量和时间依赖性。虽然还没有发现特立帕肽治疗与人类骨肉瘤之间存在因果关系的证据,但特立帕肽显然不适合用来治疗肿瘤患者因使用BPs 而产生的MRONJ[25]。但现实的情况是,使用BPs 治疗的肿瘤相关患者,其MRONJ 的发生率远高于使用BPs 治疗的骨质疏松症患者[26]。故特立帕肽对MRONJ 的治疗适应证严重受限,针对肿瘤患者使用BPs 后发生的MRONJ,仍需要进一步的研究。
综上所述,特立帕肽对MRONJ 具有显著的治疗作用,这可能与特立帕肽促进骨代谢、逆转BPs抑制骨代谢的作用机制有关。
