基于人诱导多能干细胞的组织工程化软骨再生
2024-03-12李阳阳张茂林邹多宏张志愿
李阳阳,张茂林,邹多宏,张志愿
(上海交通大学医学院附属第九人民医院口腔外科,上海交通大学口腔医学院,国家口腔医学中心,国家口腔疾病临床医学研究中心,上海市口腔医学重点实验室,上海 200011)
由体细胞重编程而来的诱导多能干细胞(iPSCs)类似于胚胎干细胞,具有无限增殖能力及多向分化潜能[1],且能够避免胚胎干细胞(embryonic stem cells,ESCs)所面临的伦理和免疫排斥等问题[2-3]。定向诱导iPSCs 分化可以系统性揭示特定组织发育再生机制及其相关疾病的发病机制[4-5],为下一代再生医学开辟一条新的道路[6-10]。目前iPSCs 来源的多巴胺能神经元及胰腺细胞已经开始被考虑用于临床治疗帕金森综合征及糖尿病[11],iPSCs 在软骨/ 骨组织发育再生及相关疾病治疗研究方面也具有良好的应用前景[12]。
基于iPSCs 软骨再生及骨关节等相关疾病的研究,研究者们[13-14]多采用拟胚体(embryoid bodies,EBs)、细胞团块、细胞分选或选用支架材料结合等培养方式,通过加入转化生长因子β超家族(transforming growth factor β superfamily,TGF-βs)和其他蛋白因子,包括骨形态发生蛋白(bone morphogenic proteins,BMPs)及活化素(activins)等分阶段诱导iPSCs 向软骨中胚层方向分化,以期获得均质软骨细胞。然而上述诱导培养方式周期长、过程复杂且不连续。因此,构建合适的诱导培养体系,系统高效稳定诱导iPSCs 向软骨中胚层方向分化,是实现基于iPSCs 软骨再生及其发育畸形发病机制探究这一目标的关键前提[15]。
针对上述基于iPSCs 发育生物工程学及疾病模拟体系,在软骨发育畸形发病机制及再生研究方面面临的诱导培养难题,本研究通过诱导人源iPSCs(human iPSCs,hiPSCs)向中胚层方向分化,进而通过三维(3D)悬浮培养成功诱导hiPSCs 分化为均质软骨组织,且hiPSCs 来源的软骨组织在体内未形成畸胎瘤。与前期研究相比,3D 悬浮培养体系能够高效快速诱导hiPSCs 向软骨中胚层方向分化,简化了诱导方式,能够为探究以hiPSCs 介导的发育再生医学方式修复关节软骨缺损问题提供良好的平台,以期逐步解决临床上所面临的关节软骨缺损修复重建难题。
1 材料和方法
1.1 实验材料
主要试剂:hiPSC 维持培养液(STEMCELL Technologies 公司,加拿大);中胚层诱导液(STEMCELL Technologies 公司,加拿大);软骨诱导液(STEMCELL Technologies 公司,加拿大);GAPDH(Proteintech 公司,美国);Nanog 抗体(abcam 公司,英国);SSEA-4 抗体(Thermo Scientific 公司,美国);BCIP/NBT 碱性磷酸酯酶显色试剂盒(上海碧云天公司,中国);Sox2 抗体(abcam 公司,英国);Ⅱ型胶原蛋白抗体(Millipore 公司,美国);Sox9 抗体(Millipore公司,美国);Aggrecan 抗体(Millipore 公司,美国);番红O-固绿染液(北京索莱宝公司,中国);阿利新蓝染液(广州赛业公司,中国);基质胶(BD 公司,美国)。
1.2 hiPSCs 及ESCs 培养
H9 ESCs;hiPSCs(型号:DYR0100,人包皮细胞来源)由中国科学院提供。冰上溶解基质胶,无血清DMEM/F12 培养液稀释,均匀铺在6 孔板上,并置于37 ℃孵育箱过夜,次日吸走上层培养液,将复苏的hiPSCs/ESCs 细胞悬液接种到6 孔板中,每2 天换液1 次。
1.3 诱导hiPSCs 向软骨中胚层方向分化
hiPSCs 中胚层诱导液培养3 d。3 d 后更换为软骨诱导液继续培养,诱导培养至第14 天后,将初步成形的细胞团块转移至超低附着培养板,进行悬浮培养,软骨诱导液每2 天换液1 次。
1.4 细胞免疫荧光
4%多聚甲醛固定30 min,磷酸盐缓冲液(phosphate buffered saline,PBS)清 洗3 遍,抗 体Nanog(1∶200)、SSEA-4(1∶200)分别稀释于含0.1% TritonX-100、1% 牛血清白蛋白、0.1% Tween 的PBS 溶液中,分别室温避光孵育1 h,用PBS 清洗,红色荧光二抗(孵育Nanog 一抗),绿色荧光二抗(孵育SSEA-4 一抗)避光孵育1 h,4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)法染核10 min,PBS 清洗,置于荧光显微镜下观察。
1.5 碱性磷酸酯酶染色
4% 多聚甲醛固定30 min,PBS 清洗3 遍,配置好的碱性磷酸酯酶工作液避光孵育30 min,蒸馏水终止反应,PBS 清洗,置于倒置相差显微镜下观察。
1.6 Western blotting
RIPA 裂解液提取hiPSCs、ESCs 的总蛋白,BCA法测定蛋白浓度,用10% 十二烷基硫酸钠聚丙酰胺凝胶电泳(SDS-PAGE)分离等量的总蛋白,后转至PVDF 膜(Bio-Rad 公司,美国),5% 脱脂奶粉室温封闭1 h,TBST 清洗3 遍,4 ℃孵育过夜一抗Nanog(1∶2 000)、SSEA-4(1∶2 000)、Sox2(1∶2 000)、GAPDH(1∶5 000),第2 天用TBST 清洗3 遍,HRP-羊抗兔二抗(1∶5 000)室温孵育1 h,在ChemiDoc成像系统(Bio-Rad 公司,美国)下观察蛋白印迹条带。
1.7 实时定量聚合酶链反应(RT-qPCR)
用RNAiso Plus 裂解液(TaKaRa 公司,日本)提取hiPSCs、ESCs 及中胚层诱导第3 天、软骨诱导 第28天的总RNA,Multiskan GO 系统(Thermo Scientific 公司,美国)测定RNA 的浓度及纯度,反转录试剂盒(TaKaRa 公司,日本)合成cDNA,SYBR Green I aster mix(TaKaRa 公司,日本)混合cDNA,Light Cycler 96(Roche 公司,瑞士)进行RT-qPCR,引物序列见表1,通过β-actin 标准化内参,用2-ΔΔCt值表示每个基因的相对表达量。

表1 RT-qPCR 引物序列Table 1 Primers sequence for RT-qPCR
1.8 阿利新蓝、番红O-固绿染色
hiPSCs来源的软骨球用4%多聚甲醛固定24 h,脱水,包埋,切片,梯度脱蜡至水。阿利新蓝8GX 染色20 min,蒸馏水中浸泡数秒,核固红染色液染核20 min,梯度脱水,二甲苯透明20 min,光学树脂封固;番红O 染色:苏木精染核68 s,酸性分化液分化 1~2 s,水洗,固绿染色30~60 min,弱酸溶液洗涤切片1~2 s,番红O 染色2 min,水洗,95%乙醇脱水,无水乙醇脱水10~20 s,二甲苯透明10 min,光学树脂封固。
1.9 免疫组织化学染色
hiPSCs来源的软骨球用4%多聚甲醛固定24 h,脱水,包埋,切片,梯度脱蜡至水,胰蛋白酶修复抗原决定簇,用PBS 清洗,山羊血清37 ℃孵箱封闭1 h,甩去血清加一抗(1∶200),4 ℃孵育过夜,次日37 ℃复温30 min,PBS 清洗,生物素二抗(1∶200)37 ℃孵育60 min,辣根过氧化物酶标记的链霉卵白素37 ℃孵育20 min,PBS 清洗,DAB 液(1∶50)显色,苏木精复染,中性树胶封片。
1.10 裸鼠皮下实验
裸鼠背部备皮,用0.5%碘伏消毒,以麻醉剂戊巴比妥钠腹腔注射,纵向切开裸鼠背部皮肤,向两侧钝性分离,两侧植入hiPSCs 来源的软骨球,缝合切 口。4 周后处死裸鼠并取材(裸鼠n=3;软骨球n=6)。
1.11 统计学分析
采用SPSS 25.0 软件进行单因素方差分析及独立样本t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 hiPSCs 体外培养与多能干性维持
hiPSCs 体外传代培养能够维持其多能干性。免疫荧光检测(图1A、1B)显示hiPSCs 与ESCs相似,均高表达干细胞标志物Nanog 及SSEA4。hiPSCs 及ESCs 碱性磷酸酶活性染色均呈现强阳性(图1C)。Western blotting 实验(图1D)显示多能干性标志物Sox2、SSEA4 及Nanog 蛋白表达水平无明显差异。RT-qPCR 检测结果(图1E)与Western blotting 结果一致。以上结果证实,本研究hiPSCs体外培养体系能够较好地维持其未分化状态,保持其多能干性,为后续诱导hiPSCs 定向向软骨中胚层分化打下坚实基础。

图1 hiPSCs 体外培养与多能性维持(×100)Figure 1 In vitro culture and pluripotency maintenance of hiPSCs(×100)
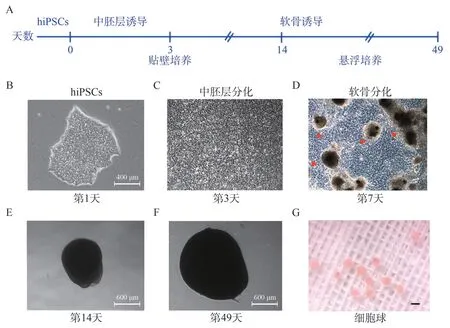
图2 hiPSCs 软骨中胚层方向诱导分化培养体系Figure 2 Culture system of hiPSCs cartilage mesodermal induced differentiation

图3 标志物Nanog、Brachyury、Sox9 及Col2a1 的表达分析及hiPSCs 来源的软骨球组织学分析Figure 3 Expression analysis of markers Nanog,Brachyury,Sox9 and Col2a1,and histological analysis of hiPSCs-derived cartilaginous pellets

图4 hiPSCs 来源的软骨球皮下移植及组织化学分析(×100)Figure 4 Subcutaneous transplantation of hiPSCs-derived cartilaginous pellets and histological analysis (×100)
2.2 诱导hiPSCs 向软骨中胚层方向分化
本研究通过模拟体内的发育方式,采用分阶段诱导的方式,逐步诱导hiPSCs 向软骨中胚层方向分化(图2A)。中胚层诱导3 d 后,hiPSCs 克隆逐渐融合,细胞形态明显改变,由圆形变为梭形(图2B、2C)。中胚层诱导3 d 后,更换为软骨诱导液,软骨诱导培养至7 d 时,细胞逐渐聚集,形成细胞团块(图2D)。培养至14 d 时,细胞球体逐渐从培养皿中脱离,至此,细胞球转至低附着培养6 孔板中进行悬浮培养(图2E)。随着培养时间的延长,细胞球体直径逐渐增大(图2F),形成具有软骨光泽的类软骨球体(图2G)。
2.3 软骨中胚层诱导过程中标志基因表达变化及hiPSCs 来源的软骨球组织形态学分析
如图3A 所示,中胚层诱导3 d 后,中胚层标志物Brachyury 表达显著上升,而多能干性标志物Nanog 表达逐渐下降,提示hiPSCs 向中胚层方向分化,多能干性逐渐丧失;软骨诱导培养后,软骨特异性标志物Sox9 及Col2a1 的表达显著提高,提示 hiPSCs 向软骨方向分化。如图3B 所示,培养至49 d 时,对hiPSCs 来源的软骨球进行组织化学分析,组织形态学及免疫组织化学分析显示,hiPSCs 分化为均质的软骨细胞,具有典型的卵圆形细胞形态;番红 O、阿利新蓝及Ⅱ型胶原染色呈现均质阳性。以上结果提示软骨基质逐渐在细胞团块中沉积。
2.4 hiPSCs 来源的软骨球裸鼠皮下移植
hiPSCs 来源的软骨球体内维持其软骨特性且无畸胎瘤或其他组织形成(图4A)。移植的软骨球被纤维膜包绕(图4B)。组织学分析表明移植的软骨球保持稳定的软骨形态,番红O 及阿利新蓝染色阳性(图4B)。免疫组织化学分析显示软骨球Ⅱ型胶原蛋白染色呈现阳性(图4B)。
3 讨论
干细胞是一类未充分分化,尚不成熟的能够自我更新的多潜能细胞,其具有再生各种组织器官乃至生物个体的潜能,是体外研究组织器官发育再生、构建特定疾病模型及模拟病理过程的一个有效工具,在疾病治疗和再生医学领域具有重要的价值[5]。iPSCs 最初由日本京都大学山中申弥[1,16]于2006 年利用病毒载体将4 种转录因子(Oct4、Sox2、Klf4 和c-Myc)转入分化的体细胞中,使其重新编程进而得到的类似胚胎干细胞的一种细胞类型。iPSCs 具有无限增殖能力及多向分化潜能,在组织器官发育再生研究方面能够避免成体干细胞来源有限及胚胎干细胞所面临的伦理学和免疫排斥等问题,为下一代再生医学开辟了一条全新的道路。本研究体外成功培养hiPSCs,并能维持其类似于ESCs 的多能干性,同时构建诱导hiPSCs 向软骨中胚层方向分化的培养体系,成功诱导hiPSCs 体外分化为透明软骨球体,且hiPSCs 来源的软骨球体体内移植无畸胎瘤形成的风险。本研究有望为基于iPSCs 的软骨再生重建开创新的手段和技术平台。
体外稳定培养hiPSCs 并维持其多能干性是诱导hiPSCs 定向分化的关键前提。本研究中,hiPSCs经多次传代培养,细胞集落形态立体、紧密,形状规则,能长期增殖保持其未分化的状态[17]。免疫荧光、ALP 染色检测显示,hiPSC 与ESCs 类似,均高表达特定多能干性标志物SSEA-4、Nanog 及碱性磷酸酶。同时,Western blotting 及RT-qPCR 结果进 一步验证,多能干性标志物Nanog、SSEA-4、Sox2 及Oct3/4 在hiPSCs 中的表达与在ESCs 中相当[18]。以上结果证实本研究体外培养体系能够维持hiPSCs未分化状态,保持其多能干性,为后续诱导hiPSCs向软骨方向分化奠定良好基础。
关节软骨主要分布在长骨的末端,起着润滑和降低摩擦力的作用,当它受到损伤或退行性变时,运动等对关节的冲击无法得到缓冲,久之形成骨关节炎。组织工程和再生医学的发展为骨关节软骨的缺损修复提供了新的策略[19]。构建高效稳定的软骨诱导培养体系,是基于hiPSCs 软骨再生的关键前提。细胞增殖、分化和代谢均受到微环境的影响。二维(two dimensions,2D)平面培养状态下,细胞与基质间及细胞与细胞间的相互作用与体内生理条件存在明显差异。3D 培养能够模拟体内的生理环境,建立细胞间及细胞与胞外基质的联系[20-21],促进细胞增殖、分化及细胞外基质分泌等作用[22]。首先,本研究将hiPSCs 维持培养在铺满基质胶的6 孔板进行扩增,然后诱导分化更换为中胚层诱导液,诱导hiPSCs 向中胚层方向分化,3 d 后中胚层相关标志物Brachyury 表达显著上升,此后将中胚层诱导液更换为软骨诱导液培养[23]。经过一段时间的软骨诱导培养,培养皿中逐渐出现细胞团块。培养至14 d 后,将细胞团块转移至低附着培养板中进行3D悬浮培养。软骨诱导培养至28 d 时,RT-qPCR 检测结果显示,软骨标志物Sox9、Col2a1 表达逐渐升高,多能性标志物Nanog 表达不断下降,中胚层标志物Brachyury 先上升后下降。软骨诱导培养至49 d 时,对hiPSCs 来源的软骨球体进行组织化学分析,番红O、阿利新蓝化学染色及Col2a1 免疫组织化学染色均呈阳性。球体内细胞呈现均一的卵圆形类软骨细胞形态。以上结果证实,hiPSCs 成功分化为软骨细胞。3D 悬浮培养体系能够简化诱导培养方式,稳定高效诱导hiPSCs 分化为均质软骨细胞。
畸胎瘤形成的潜在风险是iPSCs 细胞用于临床治疗的一个主要障碍。未分化hiPSCs 体内移植后,一般在4~12 周会有畸胎瘤的形成,本研究中hiPSCs 来源的软骨球裸鼠皮下移植4 周后,无畸胎瘤形成。软骨球的番红O 和阿利新蓝化学染色及Ⅱ型胶原蛋白免疫组织化学染色均呈阳性。以上结果证明hiPSCs 来源的软骨球体内能够维持其软骨特性且无畸胎瘤形成。因此,hiPSCs 来源的软骨球具有良好软骨再生临床应用前景。
综上所述,本研究成功构建了诱导hiPSCs 向软骨中胚层分化的培养体系,该体系能够模拟体内发育过程,稳定诱导hiPSCs 向软骨中胚层方向分化,用于软骨再生,为后续软骨发育再生及发育畸形发病机制的研究提供一个全新的平台。
