低氧环境中Rac1调节破骨细胞功能的实验研究
2024-03-12顾家泓田原野康非吾
顾家泓,田原野,康非吾
(1.同济大学口腔医学院,同济大学附属口腔医院口腔颌面外科,上海牙组织修复与再生工程技术研究中心,上海 200072;2.吉林大学口腔医院口腔颌面外科,长春 130021)
骨是人体中的一个动态器官,其无时无刻地通过破骨细胞吸收旧骨-成骨细胞形成新骨,进行着骨改建,以维持骨代谢的平衡。然而有很多因素会影响骨代谢的平衡,例如遗传、炎症、年龄、低氧、压力等[1]。细胞的特定活动与微管、微丝和中间纤维的细胞骨架密切相关。对于细胞骨架的调节,Rho家族发挥着重要的作用,其中包括Rho、Rac1 和CDC42 等蛋白,它们可以通过改变细胞骨架来参与许多细胞活动,例如肌动蛋白和微管细胞骨架的组织、基因表达的调控、囊泡运输、细胞周期的进程、细胞形态发生、细胞极性和细胞迁移等[2-3]。破骨细胞在进行骨吸收前会通过由大量微丝所组成的伪足小体,在骨基质表面形成一伪足小体环,即封闭带来进行骨吸收过程。有研究[4]表明,Rac1 失活后会破坏其封闭带并且降低破骨细胞吸收活性。然而低氧微环境下的低氧诱导因子-1α(HIF-1α)将会如何影响Rac1,进而调节破骨细胞细胞骨架,最终对 破骨细胞的骨吸收能力产生何种影响,尚不明确。
1 材料和方法
1.1 材料与试剂
小鼠单核细胞系RAW264.7(中国医学科学院细胞库);HIF-1α KO RAW264.7 细胞(中国医学科学院细胞库);HIF-1αfl/fl/cre-小鼠,HIF-1αfl/fl/ctsk-cre 小鼠(美国杰克逊实验室);胎牛血清(fetal bovine serum,FBS)、青霉素-链霉素(penicillin and streptomycin,PS)、高糖DMEM 培养液(Gibco 公司,美国);CoCl2(Sigma 公司,美国);sRANKL(Peprotech 公司,美国);Rac1抗体、HIF-1α抗体(Abcam公司,美国);Rac1 抑制剂(型号:NSC23766;Selleck 公司,美国);TRIzol 试剂、逆转录试剂盒(TaKaRa 公司,日本);实时定量聚合酶链反应(RT-qPCR)试剂盒(上海翊圣生物科技有限公司,中国);Western blotting 试剂盒(碧云天生物技术研究所,中国)。
1.2 细胞培养与实验处理
小鼠单核巨噬细胞RAW264.7 细胞及HIF-1α KO RAW264.7 细胞接种于完全培养液(含有10%FBS、1%双抗的DMEM),于37 ℃、5%CO2混 合气体的培养箱,换液时间为1~2 d,传代时间为2~3 d。实验分为5 组,将接种于完全培养液的RAW264.7 细胞作为对照组,接种于完全培养液的HIF-1α KO RAW264.7 细胞作为KO 组;同时取 100 μmol/L CoCl2加入对照组中,用以模拟低氧微环境,将其作为低氧组;取浓度100 μmol/L Rac1活性抑制剂于对照组中,用以抑制Rac1 活性,将其作为抑制剂组;同时在抑制剂组的基础上加入100 μmol/L CoCl2作为抑制低氧组。
1.3 TRAP 染色
将小鼠单核细胞系RAW264.7 细胞及HIF-1α KO RAW264.7 细胞以2 000 个/孔接种于24孔板中,在含10%FBS 和10 ng/mL sRANKL 的新鲜DMEM中培养2 d,第6 天更换为条件培养液。第7 天时,根据说明书用TRAP 试剂盒进行染色。超过3 个核的TRAP 阳性多核细胞计为破骨细胞。TRAP 阳性细胞由2 名实验人员观察并计数。
1.4 RT-qPCR
将RAW264.7 细 胞和 HIF-1α KO RAW264.7细胞接种于6 孔板中,细胞贴壁后,按上述条件培养细胞。TRIzol 法提取细胞总RNA,按RT-qPCR 试剂盒说明书进行RT-qPCR,检测RAW264.7 HIF-α、CTSK、MMP-9、TRAP、Rac1、β-actin mRNA的表达水平。引物见表1。

表1 引物序列Table 1 Primers sequence
1.5 细胞免疫荧光
将RAW264.7 细胞和HIF-1α KO RAW264.7细胞接种于24 孔板,细胞贴壁后,按上述条件培养细胞。4%多聚甲醛固定细胞,0.5%Triton X-100通透细胞膜,牛血清白蛋白(bovine serum albumin,BSA)非免疫羊血清封闭,加入兔抗HIF-1α(1∶200)、兔抗Rac1(1∶300)4 ℃过夜,荧光二抗(1∶200)、鬼笔环肽(1∶300)、4',6-二脒基-2-苯基吲哚(4',6-diamidino-2-phenylindole,DAPI)(1∶1 000)避光孵育,倒置荧光显微镜下观察并拍摄图像。
1.6 Western blotting
将RAW264.7 细胞和 HIF-1α KO RAW264.7细胞接种于6 孔板,细胞贴壁后,按上述条件培养细胞。强裂解液裂解细胞,4 ℃下以11 000 r/min 离心,取上清液后于金属浴100 ℃煮沸,加入5×上样缓冲液后于-20 ℃保存待用。将蛋白样品进行电泳转膜,封闭液封闭。封闭完成后,加入兔抗HIF-1α(1∶500)、兔抗Rac1(1∶1 000)、兔抗β-actin(1∶1 000)4 ℃过夜。加入二抗,即抗兔HRP-IgG(1∶1 000)室温孵育,曝光拍摄。
1.7 生物信息学
取得4~6 周龄HIF-1αfl/fl/ctsk-cre C57 小鼠与 HIF-1αfl/fl/cre-小鼠各3 只,前者作为CKO 组,后者为Ctrl 组。通过提取小鼠股骨及胫骨中的单核细胞,进行体外培养。经鉴定后,破骨向诱导分化及提取RNA 后,行RNA 测序,对测序结果使用limma程序包对细胞骨架相关基因(CDC42、Rac1、PI3K、PAK1、CD47、PI4P5K、LIMK1)及破骨细胞表面标志 物(MMP-9)的表达进行差异分析,使用经验eBayes 算法,将阈值设定为logFC>1,校正P<0.05,数据经过归一化处理,采用eBayes 检验差异。
1.8 统计学分析
所有实验至少进行3 次,并使用SPSS 23.0 软件和GraphPad Prism 9.4 软件进行统计学分析。使用单因素方差分析(ANOVA 方差分析)和Tukey分析进行组间差异分析,P<0.05 为差异有统计学意义。
2 结果
2.1 低氧刺激促进RAW264.7 破骨向分化
TRAP 染色结果(图1A)显示,相比对照组,低氧组所形成的破骨细胞体积更大。此外,RT-qPCR结果(图1B)显示,与对照组相比,低氧组破骨细胞HIF-1α mRNA 表达水平升高,破骨细胞相关标志物(MMP-9、TRAP、CTSK)mRNA 的表达水平升高,差异均有统计学意义(P<0.01)。
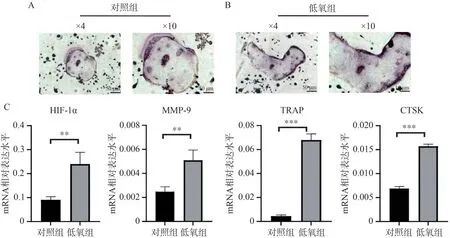
图1 体外模拟低氧状态下破骨细胞的生成情况与相关标志物mRNA 的表达情况Figure 1 Osteoclast generation and mRNA expression of related markers in vitro under hypoxia
2.2 生物信息学预测HIF-1α与细胞骨架相关基因的关系
在热图中,蓝色表示低表达,红色表示高表达(图2A)。在火山图中,红点表示转录本上调,蓝点表示转录本下调,差异有统计学意义(图2B,P<0.05)。结果显示,CKO 组小鼠原代单核细胞诱导分化后,Rac1 mRNA 的表达均明显低于对照组。Rac1 属于Rho 蛋白家族,其主要调控破骨细胞的肌动蛋白,影响破骨细胞进行骨吸收时所形成的肌动蛋白环,即封闭带。因此,HIF-1α可能通过调控Rac1 影响破骨细胞细胞骨架,从而影响破骨细胞的骨吸收能力。
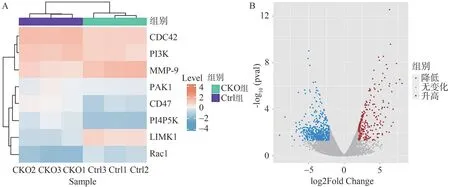
图2 生物信息学分析Figure 2 Bioinformation analysis
2.3 HIF-1α通过调控Rac1 影响破骨细胞细胞骨架,影响骨吸收能力
TRAP 染色结果(图3A、3B)显示,与对照组及低氧组相比,KO 组形成的破骨细胞呈相对规则的圆形,体积相对较小。RT-qPCR 结果(图3C)显示,KO 组破骨细胞HIF-1α mRNA 表达降低,Rac1 mRNA 表达也随之降低,破骨细胞表面标志物(MMP-9、TRAP、CTSK)mRNA 表达同样减弱。Western blotting 结果(图3D)显示,KO 组HIF-1α与Rac1 表达均呈明显降低。细胞免疫荧光实验结果(图3E、3F)显示,将HIF-1α敲除后的实验组使用鬼笔环肽对肌动蛋白(filamentous actin,F-actin)进行染色,发现细胞肌动蛋白所形成的封闭带形成异常,Rac1 阳性表达面积与对照组和低氧组相比呈明显降低,差异具有统计学意义。我们推测HIF-1α位于Rac1 上游,能够通过调控Rac1 影响破骨细胞细胞骨架,参与调控破骨细胞封闭带形成,从而影响破骨细胞的骨吸收能力。
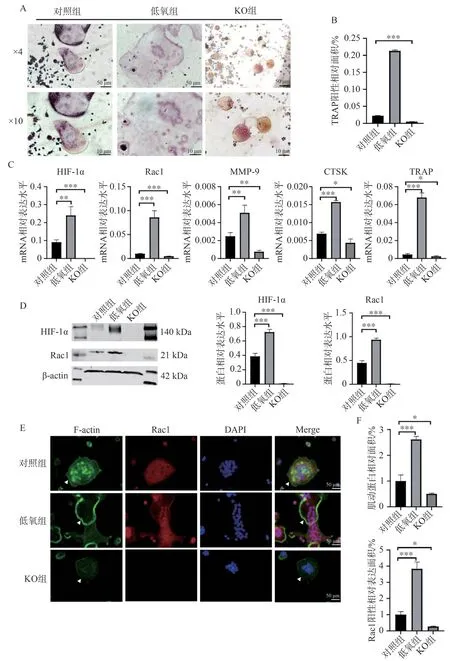
图3 HIF-1α 条件性敲除 RAW264.7 所形成破骨细胞的生成情况Figure 3 Osteoclast formation from HIF-1α conditional knockout of RAW264.7
2.4 抑制RAW264.7 内Rac1 使破骨吸收能力降低
TRAP 染色结果(图4A、4B)显示,抑制剂组所形成的破骨细胞体积减小,而抑制低氧组所形成的破骨细胞体积继续增大。RT-qPCR 结果(图4C)显示,抑制剂组所形成的破骨细胞的HIF-1α及Rac1 mRNA 表达无明显差异,破骨细胞表面相关标志物mRNA 表达降低;而抑制低氧组其HIF-1α、Rac1 mRNA 及表面相关标志物mRNA 表达增高。以上结果证明了Rac1 位于HIF-1α下游,并不会影响破骨细胞HIF-1α表达,而NSC23766 本身作为Ra1 活性抑制剂,对其本身Rac1 mRNA 表达无明显改变,却会通过影响细胞骨架来改变其所形成的破骨细胞的骨吸收能力。但通过再次模拟低氧环境,其相关的mRNA 表达会发生改变。

图4 低氧抑制RAW264.7 内Rac1 使破骨吸收能力降低Figure 4 Inhibition of Rac1 in RAW264.7 decreased osteoclast absorbance
此外,Western blotting 结果(图4D)中也显示,抑制剂组HIF-1α 与Rac1 蛋白表达无明显差别,然而抑制低氧组中HIF-1α 与Rac1 蛋白表达量均明显升高。细胞免疫荧光结果(图4E、4F)显示,同样使用鬼笔环肽对肌动蛋白进行染色,抑制剂组破骨细胞的封闭带形成不完整,红色荧光阳性Rac1表达与对照组无明显差异。与之相反,抑制低氧组破骨细胞的封闭带荧光表达明显,Rac1 阳性表达也同样增强。
3 讨论
在骨发育过程中,骨骼重建和骨骼完整性通常是由成骨细胞进行的骨形成和破骨细胞参与的骨吸收之间的平衡所调节的。当这个平衡被打破以后,便会发生病理性的骨丢失。破骨细胞过度激活可直接导致类风湿性关节炎、骨质疏松、癌症的骨转移[5-7]。当口腔颌面部颌骨骨折时,由于血流中断或减少,从而造成局部低氧环境,破骨细胞在此条件下,其分化能力与骨吸收能力将得到增强,会影响骨折愈合。同理,正颌手术Lefort Ⅰ型截骨手术后,由于鼻腭动脉及腭降动脉被切断,产生了局部低氧环境,破骨细胞骨吸收能力得到增强,对术后的恢复也将有一定的影响。而细胞在进行生物活动过程中,其细胞骨架起到重要作用。破骨细胞与骨基质相接触后,细胞骨架将会发生变化,在其外围形成肌动蛋白环,即封闭带,封闭带将吸收的微环境与一般的细胞外空间分隔开来,进而开始骨吸收过程。然而生长在非矿化基质上,破骨细胞无法形成封闭带,而是会形成由肌动蛋白聚集所成的带状结构,即伪足小体带[8-9]。
低氧诱导因子(hypoxia-inducible factor,HIF)是低氧条件下诱导生成的一种结合蛋白,其广泛存在于慢性低氧的细胞中,而HIF-1α亚基是HIF-1特有的调节蛋白,因此大多数研究均集中于HIF-1α这个活性亚基上[10-13]。在破骨细胞形成过程中,低氧可以刺激其HIF-1α产生,促进其细胞分化与维持骨吸收功能[14]。于是在此基础上,本研究通过诱导RAW264.7 细胞形成破骨细胞,并使用CoCl2模拟局部低氧环境,并发现低氧环境下破骨细胞 体积变大,骨吸收功能也得到增强,低氧环境下破骨细胞外围的肌动蛋白环所围成的表面积也相对增大。我们推测在局部低氧微环境下,破骨细胞骨吸收功能得到增强可能是由于其细胞骨架发生的变化所造成的。破骨细胞肌动蛋白环所围成的表面积增大,破骨细胞所能进行骨吸收的面积也将变大,由此骨吸收的能力得到增强。
破骨细胞在与骨基质结合的过程中,细胞的肌动蛋白被认为与Rac1 有着密切关系,其可以诱导破骨细胞的片状伪足和皱褶缘[15]。Rac1 是Ras 相关C3肉毒杆菌毒素底物1,属于Rho家族成员之一,其能调节伪足小体的产生和排列,影响其封闭带的形成[16]。Rac 活化后会促进片状伪足的扩散,而Rac 失活后则会使得细胞发生回缩和伪足小体的解体。有证据[17]表明,Rac1 可以被各种应激刺激激活。有研究[18]发现,低氧会刺激乳腺癌细胞产生活性氧成分,这可能是低氧通过PI3K/ERK 信号通路来刺激Rac1 活化的重要介质。同时,进一步认证发现,将Rac1激活下调阻断,HIF-1α将会上调[19-20]。然而HIF-1α究竟处于Rac1 的上游还是下游,还存在争议。有研究[21]通过模拟慢性低氧环境,抑制PHDs 来使HIF-1α获得长期的稳定,从而作用于Rac1 表达。然而短期低氧的作用却刚好相反,Rac1 作用于HIF-1α的上游,是诱导HIF-1α蛋白表达和转录活性所必需的[22]。本研究发现,通过使用CoCl2来模拟低氧环境作用24 h 后,Rac1 表达将会得到增强;将HIF-1α敲除后,Rac1 表达将会降低。然而将Rac1 活性抑制后,HIF-1α表达不会有明显变化,证明长期低氧环境下HIF-1α位于Rac1上游,会对其产生影响。将HIF-1α敲除后,所诱导形成的破骨细胞体积明显缩小,在免疫荧光下,其外围的肌动蛋白环所围成的表面积也减小,表达不显著。而将Rac1 活性抑制后,诱导RAW264.7 细胞形成的破骨细胞体积也会缩小。外围肌动蛋白环表达不明显,甚至会发生缺如,破骨细胞无法较好地行使骨吸收功能,造成骨吸收能力减弱。对此可以认为HIF-1α位于Rac1 上游,通过HIF-1α表达量的变化来影响Rac1,进一步改变破骨细胞细胞骨架的变化。而骨架的变化对破骨细胞的功能将产生一定的影响,例如细胞与骨基质所接触的面积得到扩大或缩小,从而可以促进或减弱其骨吸收能力。
但是本研究也存在一定的局限性,首先通过体外药物去模拟低氧环境不能真实反映体内的低氧情况,无法构建细胞所生活的低氧环境[23]。此外,影响细胞骨架的蛋白还有很多,HIF-1α 可能也会对其产生影响,而不是只影响Rac1 并使其发生变化。因此,HIF-1α对于破骨细胞细胞骨架的影响还需要进一步研究。
综上所述,本研究证实了低氧可以影响破骨细胞细胞骨架,上调Rac1 的表达,使其细胞与骨基质相接触的面积得到扩大,增强破骨细胞的骨吸收功能。本研究加深了对骨代谢平衡中低氧环境作用的认识,为治疗颌面部骨折及正颌手术术后治疗提供了一种思路。
