鳖甲煎丸对肝癌大鼠黏着斑激酶/雷帕霉素靶蛋白通路的影响
2024-03-12李杳瑶孙铜林孟小莎伍梦思苏联军
李杳瑶,刘 华,孙铜林,伍 静,孟小莎,伍梦思,,苏联军
(1.湖南中医药大学第一附属医院,湖南 长沙 410007;2.湖南中医药大学,湖南 长沙 410208)
肝癌(Hepatic carcinoma,HCC)是我国第三大最常见的癌症。化疗耐药引起的复发和转移是肝癌管理改善临床结果的主要挑战[1-2]。肝转移瘤手术切除后的5年生存率为25%~55%,且在大多数患者中观察到癌症复发[3]。因此,需要更多的研究来推进复发风险高且对当前疗法反应率低的HCC。恶性肿瘤发展的分子机制研究表明,黏着斑激酶(Focal adhesion kinase,FAK)通过控制细胞外基质(Extracellular matrix,ECM)微环境与肿瘤细胞之间的相互作用有助于癌细胞运动和侵袭性活动[4]。FAK将底物磷酸化为支架,局灶黏附诱导促进基质金属酶(Matrix metalloenzymes,MMP)分泌的信号转导途径,导致ECM底物降解并增加ECM底物上的肿瘤细胞黏附。此外,除了与细胞生长相关外,雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR)信号通路还参与细胞的存活和分化,以及它们的侵袭潜力。此外,许多研究表明,mTOR信号传导有助于调节MMP-2/-9活性[5-7]。鳖甲煎丸是治疗体内肿块的经典方剂,来源于《文一伦》一书。方中鳖甲、乌扇炮、黄芩、鼠妇熬用于分解积聚和消除瘀血,干姜、大黄、桂枝起到寻找和清除病原体作用,石韦、厚朴、瞿麦、紫葳擅长软化肿瘤硬度,阿胶、柴胡、蜣螂熬滋肝阴,甘草是各药的调剂。作为传统中药,鳖甲煎丸已被证明对多种肿瘤具有抗肿瘤活性,如肺癌、乳腺癌和肝癌[8]。迄今为止,多项研究表明鳖甲煎丸具有加速细胞凋亡、诱导自噬、促进细胞周期阻滞或抑制肿瘤转移的能力[9]。然而,关于鳖甲煎丸治疗肝癌坏死性凋亡的研究很少。本研究拟探讨鳖甲煎丸对HCC大鼠病理损伤及FAK、mTORC1蛋白表达的影响,为HCC治疗提供依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:体重18~22 g的Sprague-Dawley(SD)大鼠100只获自昆明医科大学动物试验中心[许可证编号SCXK(云)2019-0012,合格证号SCXK(云)2019-0013]。大鼠喂养环境为(22±2)℃,12 h光-暗循环。
1.1.2 实验试剂及仪器:5-氟尿嘧啶组(批号45896.36,20 mg/kg)、TRIzol试剂(批号DC-45896.36)、Thermo script RT系统试剂(批号MN-52636.36)、Power SYBRGREEN PCR MasterMix试剂(批号VB-45896.36)、BCA蛋白质检测试剂盒(批号BC-4896.36)、聚偏二氟乙烯膜(批号526987.36)。FAK、mTORC1一抗(中国碧云天生物科技,批号CI-636985.36、854635.54);HRP偶联的二抗(批号45874585.3);VEGFR-2、VEGF、IL-4、IL-8、TNF-α蛋白Quantikine ELISA试剂盒(泉州市睿信生物科技有限公司,批号69696.36、47852.54、48965.25、52419.65、95487.25)。Applied Biosystems序列检测系统7900(ABI Prism7900HT)、化学发光系统(Amersham Biosciences)。
1.1.3 鳖甲煎丸配方:炙鳖甲、乌扇炮、黄芩、鼠妇熬、干姜、大黄、桂枝、石韦去毛、厚朴、瞿麦、紫葳、阿胶各3 g,柴胡、蜣螂熬各6 g,芍药、牡丹去心、虫熬各5 g,蜂窠炙4 g,赤硝12 g,桃仁2 g,人参、半夏,葶苈各1 g,由湖南中医药大学第一附属医院提供。
1.2 实验方法
1.2.1 分组:根据大鼠体重随机分成五组,正常组、模型组、5-氟尿嘧啶组(20 mg/kg)、鳖甲煎丸低剂量组(40 mg/kg)、鳖甲煎丸高剂量组(80 mg/kg),每组20只,雌雄各半。
1.2.2 各组大鼠模型建立:模型组、5-氟尿嘧啶组、鳖甲煎丸低剂量组、鳖甲煎丸高剂量组用HepG2(1×107)细胞皮下注射到大鼠右腋皮下,10 d后,肿瘤体积达到50 mm3说明建模成功。24 h后5-氟尿嘧啶组、鳖甲煎丸低剂量组、鳖甲煎丸高剂量组给予相应药物灌胃,持续4周,正常组、模型组均给予等体积0.9%氯化钠溶液。
1.2.3 各组大鼠肝癌组织重量、肝癌组织体积、肝癌组织抑瘤率测定:采用游标卡尺检测其长短径,计算肿瘤抑制率及肿瘤组织体积。肿瘤抑制率=[(模型组肿瘤体积-其他组肿瘤体积)/模型组肿瘤体积]×100%。肿瘤组织体积=(肿瘤组织长径×肿瘤组织短径2)/2。
1.2.4 各组大鼠肝癌组织FAK、mTORC1基因测定:使用TRIzol试剂从肝癌组织中分离总RNA,并使用TRIzol试剂提取总RNA。根据制造商的说明,通过Thermo script RT系统试剂将RNA逆转录为互补DNA(cDNA)。使用Applied Biosystems序列检测系统7900(ABI Prism7900HT)与10 μl由Power SYBRGREEN PCR Master Mix、500 nmol每个引物和300 ngcDNA模板。反应条件为95 ℃下初始变性5 min,然后是60个循环,94 ℃下20 s,60 ℃下20 s和72 ℃下40 s,再以0.1 ℃/s速度从72 ℃升温至95 ℃之前,包括在72 ℃下进行5 min最终延伸,并进行连续荧光采集。对于定量RT-qPCR的每个实例,复制每个cDNA样本,并使用2-ΔΔCt方法确定平均相对倍数mRNA表达,其中检测到GAPDH作为内部对照。RT-qPCR中使用的引物序列,见表1。

表1 FAK、mTORC1基因引物序列
1.2.5 各组大鼠肝癌组织FAK、mTORC1蛋白测定:肝癌组织用裂解缓冲液(20 ml Tris-HCl、1 m MEDTA、1 ml EGTA、1 ml钒酸钠、0.2 ml苯甲基磺酰氟、0.5%NP-40、1 μg/ml亮抑酶肽、1 μg/ml抑肽酶和1 μg/ml胃酶抑素A)裂解。用BCA蛋白质检测试剂盒测定蛋白质浓度。将等量的总细胞裂解物30 μg溶解在样品缓冲液中,并在变性SDS-PAGE凝胶(5%浓缩凝胶和8%~12%分离凝胶)电泳,然后将蛋白质转移到聚偏二氟乙烯膜。用FAK、mTORC1一抗探测印迹,然后用HRP偶联的二抗探测,通过增强的化学发光系统观察抗原-抗体复合物。
1.2.6 各组大鼠肝癌组织VEGFR-2、VEGF、IL-4、IL-8、TNF-α蛋白水平测定:使用Quantikine ELISA试剂盒根据制造商的说明书测量肝癌组织VEGFR-2、VEGF、IL-4、IL-8、TNF-α水平。用分光光度法分别在450、459、468、652、548 nm处测量吸光度。

2 结 果
2.1 各组大鼠肝癌组织重量、肝癌组织体积、肝癌组织抑瘤率比较 见表2。与正常组比较,模型组肝癌组织重量、肝癌组织体积、肝癌组织抑瘤率升高(P<0.05)。与模型组比较,5-氟尿嘧啶组、鳖甲煎丸低剂量组、鳖甲煎丸高剂量组肝癌组织重量、肝癌组织体积、肝癌组织抑瘤率降低,且鳖甲煎丸高剂量组肝癌组织重量、肝癌组织体积、肝癌组织抑瘤率低于鳖甲煎丸低剂量组,差异有统计学意义(P<0.05)。

表2 各组大鼠肝癌组织重量、肝癌组织体积、肝癌组织抑瘤率比较
2.2 各组大鼠肝癌组织VEGFR-2、VEGF蛋白表达比较 见表3。与正常组比较,模型组肝癌组织VEGFR-2、VEGF蛋白表达升高(P<0.05)。与模型组比较,5-氟尿嘧啶组、鳖甲煎丸低剂量组、鳖甲煎丸高剂量组肝癌组织VEGFR-2、VEGF蛋白表达降低,且鳖甲煎丸高剂量组肝癌组织VEGFR-2、VEGF蛋白表达低于鳖甲煎丸低剂量组,差异有统计学意义(P<0.05)。

表3 各组大鼠肝癌组织VEGFR-2、VEGF蛋白表达比较(ng/g)
2.3 各组大鼠肝癌结构比较 正常组肝组织结构正常;模型组肝癌细胞异型性增生,有明显增生灶结节,可见脂肪变性、细胞核增大出血及坏死细胞,炎症细胞浸润明显;经过5-氟尿嘧啶、各剂量的鳖甲煎丸干预后,肝癌面积减少,癌细胞异型性增生减弱,炎症细胞浸润减少(图1)。
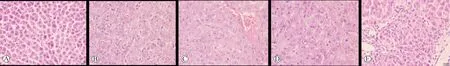
A:正常组;B:模型组;C:5-氟尿嘧啶组;D:鳖甲煎丸低剂量组;E:鳖甲煎丸高剂量组
2.4 各组大鼠肝癌组织FAK、mTORC1 mRNA表达比较 见表4。与正常组比较,模型组肝癌FAK、mTORC1 mRNA表达升高(P<0.05)。与模型组比较,5-氟尿嘧啶组、鳖甲煎丸低剂量组、鳖甲煎丸高剂量组肝癌组织FAK、mTORC1 mRNA表达降低,且鳖甲煎丸高剂量组肝癌组织FAK、mTORC1 mRNA表达低于鳖甲煎丸低剂量组,差异有统计学意义(P<0.05)。
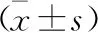
表4 各组大鼠肝癌组织FAK、mTORC1 mRNA表达比较
2.5 各组大鼠肝癌组织FAK、mTORC1蛋白表达比较 见表5(图2)。与正常组比较,模型组肝癌FAK、mTORC1蛋白表达升高(P<0.05)。与模型组比较,5-氟尿嘧啶组、鳖甲煎丸低剂量组、鳖甲煎丸高剂量组肝癌FAK、mTORC1蛋白表达降低,且鳖甲煎丸高剂量组肝癌FAK、mTORC1蛋白表达低于鳖甲煎丸低剂量组,差异有统计学意义(P<0.05)。
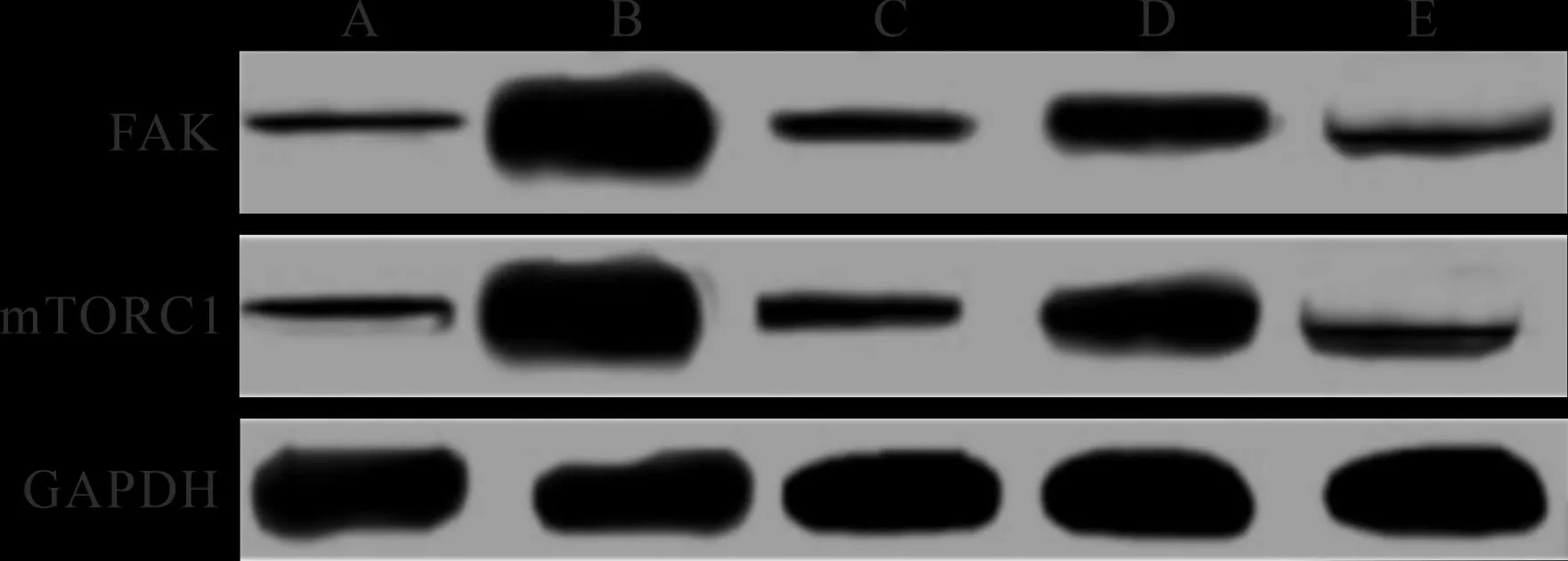
A:正常组;B:模型组;C:5-氟尿嘧啶组;D:鳖甲煎丸低剂量组;E:鳖甲煎丸高剂量组
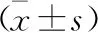
表5 各组大鼠肝癌组织FAK、mTORC1蛋白表达比较
2.6 各组大鼠肝癌组织IL-4、IL-8、TNF-α比较 见表6。与正常组比较,模型组肝癌组织IL-4、IL-8、TNF-α升高(P<0.05)。与模型组比较,5-氟尿嘧啶组、鳖甲煎丸低剂量组、鳖甲煎丸高剂量组肝癌组织IL-4、IL-8、TNF-α水平降低,且鳖甲煎丸高剂量组肝癌组织IL-4、IL-8、TNF-α低于鳖甲煎丸低剂量组,差异有统计学意义(P<0.05)。

表6 各组大鼠肝癌组织IL-4、IL-8、TNF-α水平比较(ng/g)
3 讨 论
鳖甲煎丸的抗肿瘤作用集中体现在细胞凋亡诱导、侵袭和迁移抑制以及细胞周期停滞[10]。近期报道,鳖甲煎丸通过抑制多种癌细胞生长和诱导细胞凋亡而具有抗癌活性[11]。据报道,鳖甲煎丸可诱导人白血病细胞系中的坏死性凋亡[12]。研究发现,鳖甲煎丸通过抑制NF-κB和NF-κB调节的基因产物抑制人胰腺肿瘤的生长并增强吉西他滨的抗肿瘤作用[13]。此外,鳖甲煎丸通过内质网应激和线粒体凋亡途径诱导人前列腺癌细胞[14]。体外试验发现,鳖甲煎丸可通过激活Caspase-3诱导细胞凋亡,在用鳖甲煎丸处理的胶质瘤U251细胞中,Caspase-8蛋白质水平降低[15]。根据中草药配伍原则,结合肝癌病理特点,鳖甲煎丸在三家散的基础上选用黄芪支持气机运行,去除了黄蝉、蝉科,代替了姜黄以加强祛血功效,减去白芍,代之以紫芍、红花,增强当归的活血、养阴功效。鳖甲煎丸能促进血液循环,对体内肿块表现明显抑制作用,因此可用于治疗肝硬化、肝细胞癌等。此外,临床应用表明鳖甲煎丸对肝硬化或HCC疗效较好,肝功能指标、门静脉直径均得到改善。然而,鳖甲煎丸对HCC的潜在机制仍然知之甚少。本研究中鳖甲煎丸对VEGFR-2、VEGF蛋白表现出直接抑制作用,说明鳖甲煎丸对大鼠肝癌具有抑制作用,这与前述讨论一致。此外,高剂量的鳖甲煎丸与5-氟尿嘧啶效果一致,提示加大鳖甲煎丸剂量可达到更好疗效。病理研究结果发现,正常组肝组织结构正常,模型组肝癌细胞异型性增生,细胞排列密集,核大见分裂,炎症细胞浸润明显;经过5-氟尿嘧啶、各剂量的鳖甲煎丸干预后,肝癌面积减少,癌细胞异型性增生减弱,炎症细胞浸润减少,说明鳖甲煎丸能减轻大鼠肝癌所致的病理损伤。
最近报告表明,MMP-9和FAK与表皮生长因子受体(EGFR)在表皮生长因子(EGF)诱导时相关,并促进肿瘤细胞运动和侵袭。EGF/EGFR信号传导被确定为包括乳腺癌、肺癌在内的多种肿瘤类型的重要参与者。当FAK与179-kDa EGFR结合时,受体激活涉及与其他EGFR家族成员的同源和异质二聚化,以及磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)和MAPK途径激活,这些途径增强了肿瘤生长和侵袭。此外,EGFR/PI3K/Akt信号通路调节mTOR靶标,称为癌细胞增殖的关键控制器。mTOR信号通路能抑制F-肌动蛋白重组和FAK磷酸化,这是细胞迁移的功能指标。mTORC1最近已被证明与坏死性凋亡有关。FAK和mTORC1通过它们的RIP同型相互作用基序(RHIM)域相互作用,形成FAK/mTORC1复合物,介导经典的坏死性凋亡[16]。近期研究发现,5-氟尿嘧啶在mRNA水平上抑制mTORC1转录,降低mTORC1表达和磷酸化[17-18]。在mTORC1-/-MEF和mTORC1过表达的肝癌细胞中5-氟尿嘧啶诱导的凋亡被显著降低。因此,5-氟尿嘧啶诱导的凋亡可定义为mTORC1依赖性坏死性凋亡[19-22]。研究发现,环磷酰胺诱导乳腺癌细胞中的ROS生成和线粒体功能障碍显著触发细胞凋亡[23-25],环磷酰胺引起坏死性凋亡来抑制体内和体外肺癌细胞生长,mTORC1的激活使S358处的MLKL磷酸化并衍生其寡聚化,这直接破坏了坏死性凋亡过程中的膜完整性。因此,MLKL在5-氟尿嘧啶处理后被mTORC1磷酸化,并通过与mTORC1的相互作用被招募形成坏死体。本研究结果说明,鳖甲煎丸能抑制肝癌FAK、mTORC1表达进而诱导肝癌细胞凋亡。这与上述研究一致。
