膀胱癌铜死亡相关免疫检查点基因预后特征和免疫与药物治疗分析
2024-03-12杨丛语阿茹娜刘嘉铭
杨丛语,阿茹娜,刘嘉铭
(1.蚌埠医科大学临床医学院,安徽 蚌埠 233000;2.四川大学华西第二医院生殖内分泌科,四川 成都 610000;3.苍溪县人民医院泌尿外科,四川 苍溪 628400;4.四川大学华西医院泌尿外科,四川 成都 610041)
膀胱癌(bladder cancer, BC)有着极高复发率和死亡率,是泌尿系统常见的恶性肿瘤之一[1]。2020 年 全 球 发 病550 000 例,死 亡200 000 例,男 性的发病率显著高于女性[2]。尽管70%~80%的患者首诊为预后相对较好的非肌层浸润性膀胱癌,但半数以上会经历术后复发;10%~30%会进展为预后更差、5 年生存率更低的肌层浸润性膀胱癌(muscle-invaisve bladder cancer,MIBC)[3]。虽 然 新辅助化疗联合根治性膀胱切除术已成为黄金治疗方案,但在此情况下很多患者的预后仍不理想[4]。研究表明多基因模型特征可以对癌症风险进行分层并预测患者预后[5]。因此,构建能够预测患者生存预后和为临床决策提供依据的新基因模型十分重要。
铜是人体重要的微量元素,它的存在使神经系统和血液系统正常运作,并能发挥调节机体新陈代谢和免疫力、抗氧化的作用[6]。Tsvetkov 等[7]提出了一种新的细胞死亡机制,即铜死亡。其原理是当铜离子在细胞内含量过高时,就会被转运到线粒体中与三羧酸循环中的酯酰化蛋白结合,导致酯酰化蛋白的聚集和铁硫簇蛋白的减少,进而产生蛋白毒性应激并最终诱导细胞死亡,该过程所需的ATP 由线粒体呼吸而并非糖酵解产生。参与铜死亡过程的基因在癌症的发生、发展和免疫应答中发挥了重要作用[8],利用铜死亡优先清除肿瘤细胞而非正常细胞的机制制定靶向治疗方案能提高治疗的选择性、降低肿瘤抗药性,并最大限度地减少不良反应[9],这使其具有重要的研究意义。免疫检查点是一类免疫抑制性分子,通过靶向效应免疫细胞上的负调控受体激活和促进机体的抗肿瘤反应[10]。许多接受靶向PD-1/PD-L1 免疫检查点抑制治疗的膀胱癌患者得以延长生存期。然而调查发现,由于肿瘤微环境的复杂性、患者个体差异和临床病理特征的不同,实际上只有不到20%的患者对免疫治疗产生了客观反应[11]。因此,构建有助于预测个体对免疫疗法反应的分子或基因模型对于确定个体化治疗的靶点和优化治疗策略非常重要。Hu 等[12]发现免疫检查点基因参与了癌症的发生、发展,因而其可能作为免疫检查点抑制治疗的潜在靶点。所以,为进一步提高患者生存预后和临床治疗的精准度,本研究拟构建铜死亡基因和免疫检查点基因的联合预测模型。Voil 等[13]发现神经母细胞瘤中的铜可以调节免疫检查点的表达、肿瘤免疫细胞浸润和免疫逃逸;Xie 等[14]认为铜能够通过调节免疫检查点PD-L1 的表达水平从而控制免疫检查点的应答情况;Bian 等[15]发现在肾透明细胞癌中铜死亡与免疫浸润和PD-1 的表达量相关。这些研究都表明铜死亡和免疫检查点之间存在生物学关联,为构建联合预测模型提供了理论依据。
目前,有关铜死亡相关免疫检查点基因在膀胱癌中预测价值的研究较少,其在膀胱癌中发挥了何种作用未有定论。本研究从公共数据库中获得了膀胱癌的转录本和临床数据,以生物信息学联合实验验证的方法来评价其在膀胱癌中的表达情况和预后价值。
1 材料和方法
1.1 数据来源
从TCGA 数据库(The Cancer Genome Atlas,https://Portal.gdc.cancer.gov)中整理了膀胱癌的表达矩阵和临床数据,包括19 例正常样本和414 例膀胱癌样本作为训练集。从既往的研究结果中提取了13 个铜死亡基因和79 个免疫检查点基因[12]。从GEO 数 据 库(Gene Expression Omnibus,https://www.ncbi.nlm.nih.gov/geo)中整理了包括165 个样本的GSE13507 数据集作为验证集。
1.2 构建与评价预后模型
铜死亡基因与免疫检查点基因的相关性|r|>0.3,P<0.05 即为铜死亡相关免疫检查点基因。由单因素和多因素Cox 回归分析确定与患者生存预后相关的基因。用scale 函数对数据的表达矩阵进行集中化和标准化处理后计算模型的风险评分。公式如下:
即Risk score =(Coef1×expression of BTNL9)+(Coef2×expression of CD160)+(Coef3×expression of TNFRSF14) + (Coef4×expression of TNFRSF18)。用ROC 曲线下面积评估该模型的预测能力;Kaplan-Meier 曲线评估两组患者生存率的差异;结合临床因素进行独立预后分析和分层分析,评估患者的预后并鉴定该模型的预测能力。
1.3 富集分析
基因本体(Gene Ontology, GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)分析能探究预后基因潜在的生物学功能。基因集富集分析(Gene Set Enrichment Analysis, GSEA)能发现两组基因不同的富集通路。筛选标准为:|NES|(标准化富集分数)>1,P<0.05。
1.4 免疫浸润和体细胞突变
肿瘤细胞的免疫浸润能参与到癌症的发展并与 预 后 相 关。 因 此,采 用 CIBERSORT,CIBERSORT-ABS, QUANTISEQ, MCP -counter, TIMER 和EPIC 算法探究高危组和低危组患者的免疫细胞浸润水平。 从TCGA 下载BLCA-Masked Somatic Mutation 数据用于计算肿瘤突变负荷(tumor mutation burden, TMB)并用maftools 包可视化突变数据,比较两组患者体细胞突变的信息。
1.5 免疫治疗
探究各免疫检查点基因在两组间的表达差异以预测有效的免疫检查点阻断治疗靶点。同时,由于参与建模的基因本身也属于免疫检查点基因,故研究其表达差异有助于开发膀胱癌
新的靶向阻断治疗策略。肿瘤免疫功能障碍和排斥算法(TIDE)能推断患者接受免疫检查点抑制治疗的效果,方法为采用Wilcoxon 检验比较两组患者的TIDE,Dysfunction,Exclusion 评分。
1.6 药物治疗
使用癌症药物敏感性基因组学数据库GDSC(https://cancerrxgene.org/)评估病人的化疗反应。用pRRophetic 包分析药物的半最大抑制浓度(IC50),判断两组患者的药物敏感性差异。
1.7 qPCR 实验验证
选用人尿路上皮永生化细胞SV-HUC-1 和人膀胱癌细胞UMUC-3 进行实验。以磷酸盐缓冲液冲洗细胞,随后每孔加入1 mL Trizol 反复吹打,直到完全裂解细胞后提取细胞裂解液中的总RNA。按照Takara 反转录试剂盒将RNA 逆转录为cDNA,将cDNA 梯度稀释4、16、64、256 倍,其中各稀释倍数条件下,设置三个平行孔上样,进行重复检测确定均值。PCR 反应体系如下:
PCR Forward Primer (10 μmol/L)-1 μL; PCR Reverse Primer (10 μmol/L)-1 μL; ROX Reference Dye Ⅱ (50×Conc)-0.5 μL; SYBR®Premix Ex Taq TM Ⅱ(2×)-12.5 μL; DNA 模 板(cDNA 溶液)-2 μL; dH2O (灭 菌 蒸 馏 水)-8 μL; Total (总计)-25 μL;再经95 ℃预变性且酶激活30 s、95 ℃变性30 s、60 ℃退火20 s,并重复变性退火共45 个循环的PCR 扩增程序后,得到标准曲线。选择比较阈值法,以GAPDH 为内参计算基因mRNA 的相对表达量:Expression of genes = 2-△△CT×100%。4 个基因的上下游引物序列见表1。

表1 实时荧光定量PCR 引物Tab 1 Real-time fluorescent quantitative PCR primers
1.8 统计学处理
统计学分析基于R(4.2.2 版本)和Graphpad Prism10 进行。采用卡方检验和Fisher 检验确定有统计学意义的临床因素;KM 生存曲线和log-rank 双侧检验计算两组患者的总生存时间; Spearman 相关性分析评估风险评分与免疫细胞浸润的相关性;Wilcoxon 检验比较两组免疫检查点基因的表达差异;独立样本t检验比较两组间的统计学差异,结果用(±s)表示。P<0.05 为差异有统计学意义。
2 结果
2.1 提取目标基因及构建预后模型
以相关性分析共得到4 个目标基因,分别是BTNL9,CD160,TNFRSF14和TNFRSF18。 用Cytoscape 软件可视化两个数据库中铜死亡基因和免疫检查点基因的调控关系,并展示在图1A、B 中。单 因 素Cox 回 归 分 析 显 示BTNL9,CD160,TNFRSF14与降低发病风险相关,TNFRSF18与增加发病风险相关,TNFRSF14与预后显著相关(P<0.001)(图1C);多因素 Cox 回归分析得出了相似的结论,且TNFRSF14 仍患者的独立预后因素(P<0.001)(图1D)。由于基因数目较少,故将4 个基因都纳入构建预后模型。图1E 展示了4 个基因在风险预后模型中的分布特征,结果显示BTNL9,CD160,TNFRSF14在 低 危 组 中 高 表 达;TNFRSF18在高危组中高表达。

图1 预后基因的分布特征和回归分析Fig 1 Distributional characteristics and regression analysis of prognostic genes
2.2 评价预后模型。
根据风险评分的中位数将患者分为高危组和低危组(图2A)。散点图显示TCGA 队列死亡患者的总体生存时间较短,散点大多沉积在底部;且随着风险评分的增加死亡人数越来越多(图2B)。Kaplan-Meier 生存曲线显示高危组患者的生存率显著低于低危组(P<0.001)(图2C)。ROC 曲线预测患 者1、3、5 年 的 生 存 率 为0.694、0.64、0.638(图2D)。GEO 队列的Kaplan-Meier 生存曲线提示高危组患者的生存率显著低于低危组(P<0.001)(图2E),ROC 曲线预测患者1、3、5 年的生存率分别为0.789、0.588 和0.634(图2F)。这些结果表明高风险评分的患者生存预后更差,且差异在两组间显著,说明该模型具有良好的预测能力。
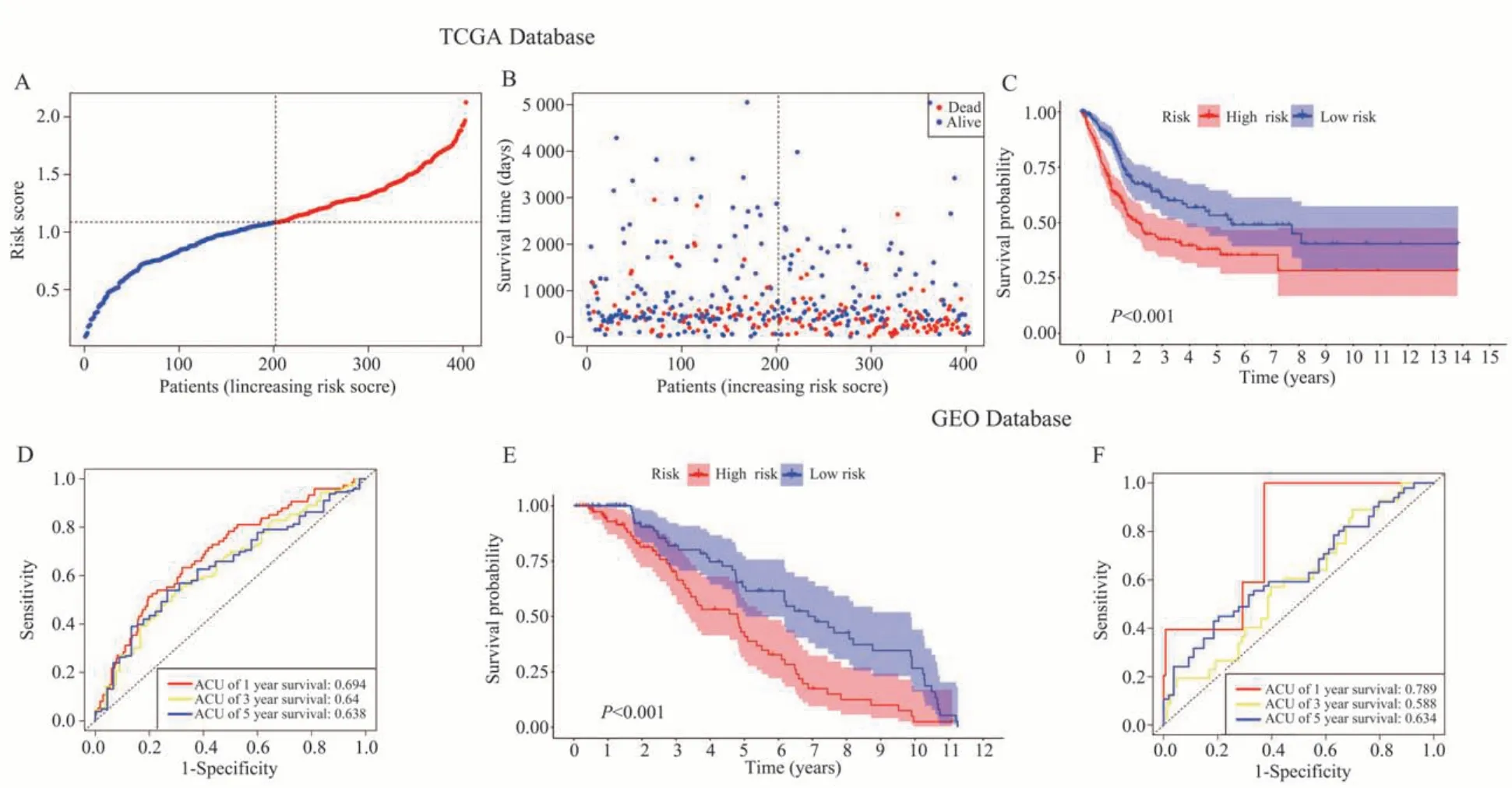
图2 TCGA 队列和GEO 队列的风险评分生存分析Fig 2 Risk score survival analysis of the TCGA cohort and GEO cohort
2.3 独立预后分析及绘制列线图
独立预后的单因素Cox 回归分析显示,年龄、临床病理分期、TN 分期、风险评分均与生存预后显著相关(P<0.001)(图3A)。多因素Cox 回归分析显示,年龄(P<0.001)、N 分期(P<0.01)、风险评分(P<0.01)与预后显著相关(图3B),故铜死亡相关免疫检查点基因模型是BLCA 临床因素的独立预后指标。以年龄、性别、肿瘤分级、病理分期、风险评分、T、N 期构建列线图。TCGA 队列结果显示年龄(P<0.001)、N 分期(P<0.01)、风险评分(P<0.01)的差异具有统计学意义,校准曲线的良好契合度证实了列线图良好的预测能力(图3C、D)。GEO 队列的年龄、N 分期、风险评分有统计学差异(P<0.05),校准曲线也能证实其准确的预测能力(图3E、F)。

图3 独立预后分析和列线图Fig 3 Independent prognosis analysis and nomogram
2.4 临床因素的预后分析
采用卡方检验和Fisher 检验比较不同临床信息的风险评分。用卡方检验评估年龄、性别、肿瘤分级;用Fisher 检验评估病理分期、T、N 期。结果显示,大于70 岁、高肿瘤分级、Ⅲ-Ⅳ期、T 分期3~4 期的患者具有更高的风险评分(图4A-D),证明该模型对指导临床预后具有价值。用分层分析进一步探讨模型的临床预后价值。结果显示(图4E-M),低风险组中所有年龄阶段、所有临床病理分期、男性、高肿瘤分级、低N 分期、所有T 分期的病人的生存概率均显著高于具有上述同样特征的高风险组中的病人,展示了该模型良好的临床预测能力。
2.5 功能富集分析和体细胞突变
GO 和KEGG 能分析铜死亡相关免疫检查点基因的重要生物学功能和作用途径。GO 功能富集分析的生物过程(Biological process, BP)分析显示基因参与细胞黏附的正调控、免疫记忆过程、T 细胞共刺激、淋巴细胞共刺激和适应性免疫反应的负调控(图5A);细胞组分(Cellular component, CC)分析提示基因主要富集在质膜的外侧(图5B)。分子功能(Molecular function, MF)分析提示基因主要在肿瘤坏死因子活性受体和死亡活性受体中发挥作用(图5D)。KEGG 信号通路包括细胞因子受体互作通路和病毒蛋白与细胞因子的受体互作通路(图5C)。GESA 显示基因在低危组主要富集于与癌症和DNA 的损伤相关的信号通路中,包括Bladder cancer、Inflammatory mediator regulation of TRP channels、Long-term potentiation、Longevity regulating pathway-multiple species、Non-homologous end-joining(图5E);在高危组主要富集于与免疫和炎症相关的信号通路,包括Hepatitis B,IL-17 signaling pathway,Natural killer cell mediated cytotoxicity,Protein processing in endoplasmic reticulum,Toll-like receptor signaling pathway(图5F)。体细胞突变分析结果显示,低危组的TMB 较高危组更高;MIBC 中突变频率最高的TP53、RB1、KDM6A 在两组中的突变频率均大于10%,其中TP53、RB1 在高危组中突变频率更高,KDM6A 在危组中突变频率更高(图5G、H)。
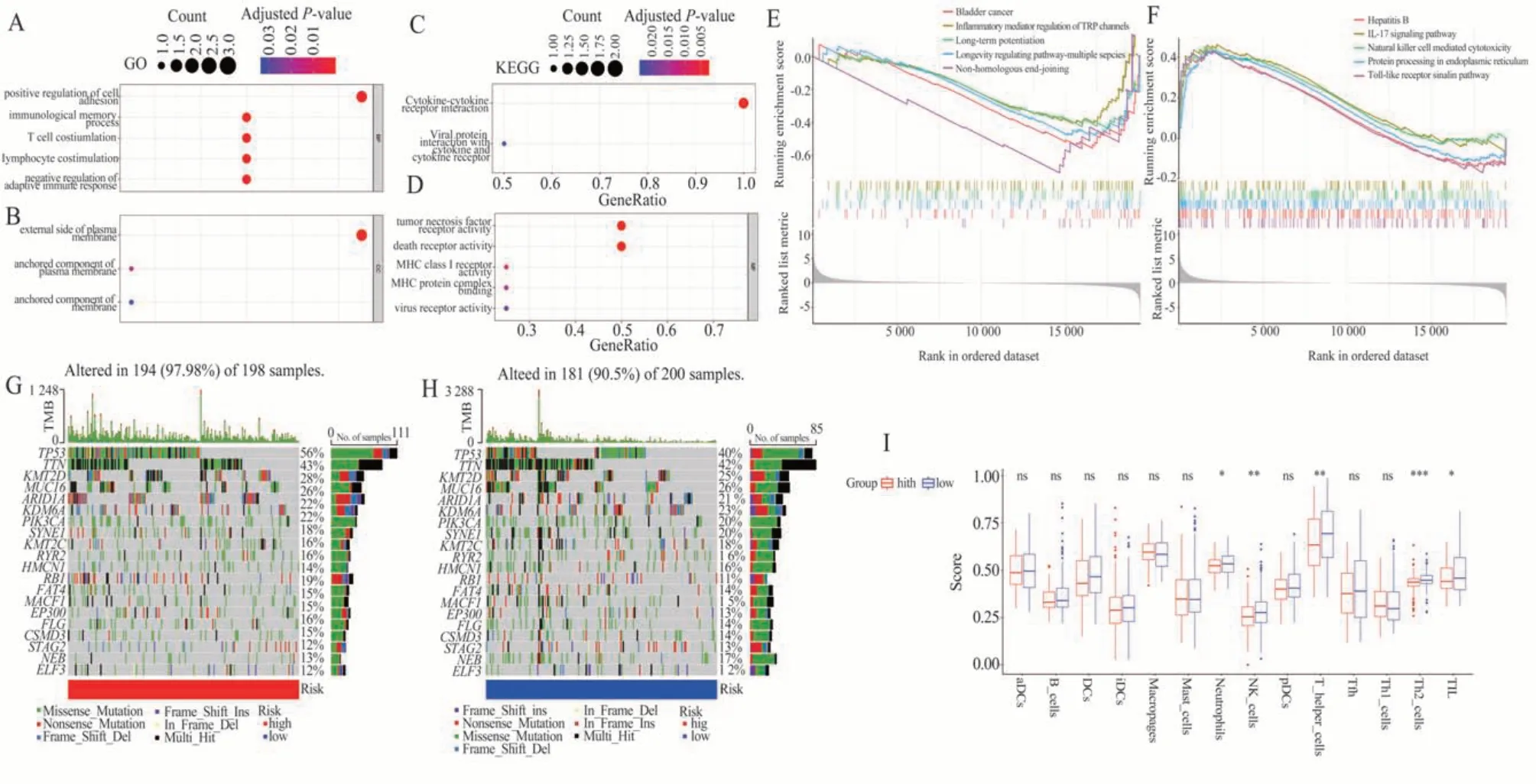
图5 富集分析、体细胞突变景观和免疫浸润Fig 5 Enrichment analysis, somatic mutation landscapes, and immune infiltration
2.6 免疫浸润和免疫治疗
CIBERSORT、CIBERSORT-ABS、QUANTISEQ、MCP-counter、XCELL、TIMER 和EPIC 计算预后基因与免疫细胞浸润水平的关系。CIBERSORT 计算提示M0 和M2 巨噬细胞在高风险组的浸润水平较高,而CD8+T 细胞、单核细胞在低风险组的浸润水平较高;XCELL 算法提示Treg 细胞在高危组的浸润水平较高(图6A)。TIDE 算法提示高危组的免疫逃逸、功能障碍和免疫排斥评分均大于低危组,提示高危组患者接受免疫治疗的疗效更差,而低危组患者更适合接受免疫治疗(图6B-D)。图6E 提示PD-1、PD-L1、CTLA-4 的表达不具有差异,但本研究的预后基因BTNL9,CD160,TNFRSF14 在低危组的表达量显著高于高危组,说明低危组患者接受该免疫检查点阻断治疗的更好。ssGSEA 提 示 低 危 组 中 性 粒 细 胞、NK 细 胞、Th 和Th2 细胞、TIL 细胞的浸润水平更高(图5I)。

图6 风险模型的免疫浸润和预测免疫治疗Fig 6 Immune infiltration and predict immunotherapy in the risk model
2.7 药物敏感性分析
高危组患者多西紫杉醇、顺铂、多柔比星、小白菊内酯、毒胡罗卜素的IC50值显著低于低危组患者,说明这些药物对高危组患者的疗效更好。高危组患者替西罗莫司、乙胺嘧啶、尼罗替尼、甲氨蝶呤、来那度胺的IC50值显著高于低危组,说明它们对低危组患者的疗效更好(图7)。
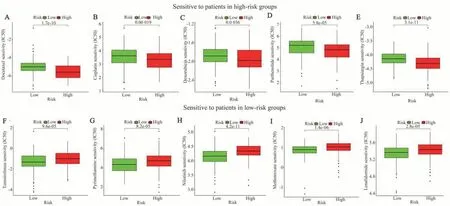
图7 风险模型预测化疗反应Fig 7 Risk model predicts chemotherapy response
2.8 qPCR 验证结果
qPCR 实验结果显示(图8),BTNL9 基因在正常组和癌症组的mRNA 表达量分别是(1.103±0.135)、(0.427±0.113),其在癌细胞中的表达量显著降低(t=3.311,P=0.0296); CD160 基因在正常组和癌症组的mRNA 表达量分别是(1.626±1.032)、(2.021±1.112),其在癌细胞中的表达量显著降低(t=4.260,P=0.013); TNFRSF18 基因在正常组和癌症组的mRNA 表达量分别是(0.746±0.509)、(0.805±0.475),其在癌细胞中的表达量显著降低(t=3.555,P=0.024);TNFRSF14 基因在正常组和癌症组的mRNA 表达量分别是(0.860±0.402)、(1.547±1.249),其在癌细胞中的表达量显著增加(t=3.511,P=0.025)。

图8 qPCR 验证预后基因的表达量Fig 8 Verify the expression of prognostic genes by qPCR
3 讨论
随着微量元素检测技术的发展,铜在肿瘤中的关键作用已逐渐被人们所认识,铜死亡作为一种新的细胞死亡机制,被认为是研究抗肿瘤方案的有效新靶标[11]。铜稳态失衡能影响肿瘤的生长并促进肿瘤细胞死亡[16],在肿瘤免疫和抗肿瘤治疗中发挥着不可或缺的作用[17]。膀胱癌具有较高TMB 的特点使患者能受益于免疫检查点阻断治疗,但是由于机体的动态免疫平衡受到严格的调控,且在某些情况下肿瘤可以反向调控免疫检查点的表达,营造抑制性肿瘤微环境而发生免疫逃逸,传统的靶向PD-1/PD-L1 并不能使大多数患者受益,因此寻找新的免疫检查点治疗靶点非常重要[18]。本研究从膀胱癌肿瘤微环境和生存预后的角度探究新预测模型的临床意义,为铜死亡联合免疫检查点的临床应用提供依据。
本研究确定了4 个与膀胱癌预后有关的铜死亡相关免疫检查点基因,分别是BTNL9、CD160、TNFRSF14和TNFRSF18。嗜乳脂蛋白样9(BTNL9)可以通过调控T 细胞来影响癌症的发展,其激活γδT 细胞使之产生细胞因子、趋化因子和表达抗原从而对癌细胞产生细胞毒性,以强大的细胞毒作用直接杀伤肿瘤细胞[19]。与本研究类似,BTNL9在结肠癌、肺腺癌中表达下调并与患者预后相关[20,21]。CD160是NK 细胞激活受体,它通过激活NK 细胞从而增加肿瘤微环境中IFN-γ 和TNF-α 的分泌,促进靶细胞的溶解[22]。肿瘤坏死因子受体超家族(TNFRSF)主要源于单核巨噬细胞和T 细胞等,它能诱导肿瘤细胞凋亡、调节机体免疫应答、调控肿瘤组织血管系统、诱导细胞程序性死亡等,具有多种 生 物 学 活 性[23]。值 得 注 意 的 是,CD160是TNFRSF14的配体,二者的跨膜结合能传递激活信号,增强NK 细胞的细胞毒作用。Sun 等[24]发现膀胱癌中CD160-TNFRSF14 受体配体对的高表达能增加IL-2 扩增型NK 细胞表型并与BLCA 患者的预后密切相关。TNFRSF18 也被称为糖皮质激素诱导的TNFR 相关蛋白(GITR),在T 细胞等多种免疫细胞上表达。GITR 激动剂抗体通过逆转CD25+/CD4+调节性T 细胞介导的免疫耐受从而在多种肿瘤模型中显示出抗肿瘤作用,被认为与肾透明细胞癌患者的不良预后相关[25]。
肿瘤的体细胞突变可以帮助其突破机体的自我监控机制进而无限增殖和侵犯周围组织,还能使其产生自身表面抗原修饰和改变肿瘤微环境进而逃避抗肿瘤免疫应答。TMB 与患者的临床病理特征相关,被认为是预测免疫治疗疗效的标志物[26]。高风险性MIBC 患者的TP53 和RB1 突变频率往往更高, TMB 更高的膀胱癌患者预后更好[27],均与本研究的结论一致。Qiu 等[28]发现KDM6A 的缺失促进了M2 巨噬细胞的极化,与p53 功能失调协同作用导致膀胱癌的发生;其缺失还能触发表观遗传开关,破坏尿路上皮分化,在膀胱的癌变过程中诱导其细胞增殖。同时,RB1 和TP53 共突变与膀胱癌患者免疫治疗反应的基因组生物标志物密切相关[29]。这可能是高危组患者病情更易恶化且免疫治疗效果更差的潜在机制。因此,将铜死亡联合免疫检查点预后模型与TMB 结合是预测患者治疗反应和预后的有效方法。
Cox 回归分析发现TNFRSF14 与膀胱癌患者的预后显著相关(P<0.001);KM 生存曲线表明两组患者具有显著的生存率差异;ROC 预测了患者1、3、5 年的生存率;独立预后分析表明风险评分是良好预后指标;临床相关性分析、分层分析、列线图和校准曲线说明了预后模型与临床因素良好的契合度;GSEA 显示Bladder cancer 通路富集在低危组,证明铜死亡免疫检查点基因的确在膀胱癌中表达;同时,qPCR 实验验证预后基因mRNA 的表达情况与生物信息学的分析结果一致。综上,基于该模型预测患者的生存预后是可靠的。
为了给临床决策提供依据,从免疫治疗和化疗两个角度进行分析。尽管PD-1/PD-L1 抑制剂被指南推荐为铂类耐受和PD-L1 阳性膀胱癌患者的一线治疗方案[30],但仍有很多患者因为严重的副作用和不良反应而中断了免疫治疗。而BTNL9,CD160,TNFRSF14 属于铜死亡相关免疫检查点基因,具有高度选择性,它们在低危组表达量显著增加的特点为患者的临床决策提供了新治疗靶点,其抑制剂的应用可能会降低肿瘤的耐药性、减少不良反应并实现个体的精准化治疗。TIDE 算法提示低危组患者的免疫治疗疗效更好,高危组更易发生免疫排斥,这可能与两组患者免疫细胞浸润的不同特点有关。低危组CD8+T 细胞和TILs 细胞的浸润水平更高,使得患者生存预后和免疫检查点阻断治疗效果更好[31];同时,由于免疫检查点受体主要在CTL 和NK 细胞中表达[32],因此NK 细胞浸 润程度更高的低危组患者更易受益于免疫治疗。相反,高危组中免疫抑制性细胞如Treg 细胞、M2 巨噬细胞浸润程度更高,它们会抑制CTLs 的浸润水平和功能,并影响患者的临床预后和免疫反应[33],这需要进一步的实验来加以验证。化疗药物为高危组患者提供了辅助治疗方案,如顺铂能与DNA 交叉联接破坏DNA 功能,进而对肿瘤细胞产生细胞毒作用;多西紫杉醇通过减少小管数目和破坏微管结构而产生细胞毒作用,且能与顺铂联用;小白菊内酯通过选择抑制USP7 的活性促进β-catenin 的泛素化和降解从而抑制肿瘤细胞增殖[34];多柔比星通过嵌入DNA 抑制核酸合成,已被证明能用于膀胱癌的治疗[35]。综上,该预后模型能预测患者免疫治疗疗效,是决定患者辅助治疗方案的可靠指标。
总之,本研究证明了铜死亡相关免疫检查点基因模型预测膀胱癌患者治疗反应和生存预后的可靠性,并基于此为临床治疗提供了方案。同时潜在靶点的发现为将来的临床决策提供了新的选择,为高选择性、低耐药性、低不良反应的治疗手段提供了新的思路。
作者贡献度说明:
杨丛语:文章设计、数据分析、手稿撰写、文献搜索与整理;阿茹娜、刘嘉铭:文章设计、提供整改思路和意见。
所有作者声明不存在利益冲突关系。
