LncRNA MEG3靶向调节miR-17-5p对缺氧缺血性脑损伤新生小鼠血-脑屏障的影响
2024-03-11范敏娜李明
范敏娜,李明
新生儿缺血缺氧性脑病(HIE)是围产期因窒息导致的脑缺血缺氧引发脑组织受损的疾病,严重威胁生命,且存活者遗留后遗症[1-2]。血-脑屏障是血液与脑组织间的屏障,可阻碍有害物质自血液流向大脑损伤脑组织,缺血缺氧的强刺激可改变血-脑屏障通透性致其受损,引起继发性神经元损伤[3-4]。血-脑屏障受损是HIE发病及导致不良预后的重要机制,因此改善血-脑屏障损伤、控制脑水肿对HIE的治疗有帮助。LncRNA MEG3是缺血缺氧性脑损伤(HIBD)的靶点[5],可调节内皮细胞功能与血管生长[6]。miR-17-5p在抑制HIBD新生大鼠炎性激活中发挥作用[7],且与miR-17-5p存在靶向关系[8]。本研究通过构建HIBD新生小鼠模拟HIE,探究LncRNA MEG3调控miR-17-5p对HIBD新生小鼠血-脑屏障的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 7日龄C57BL小鼠(SPF级)90只,购自广东维通利华实验动物技术有限公司[SCXK(粤)2022-0063],雌雄各半,质量4.5~4.8 g,由体格健壮的母鼠喂养。
1.1.2 主要试剂 si-NC、si-LncRNA MEG3、anti-miR-NC、anti-miR-17-5p购自上海生工;EB(R20616)购自上海源叶生物科技有限公司;总RNA抽提试剂盒(12183016)、逆转录试剂盒(4366597)、总蛋白提取试剂盒(89842)购自赛默飞世尔科技公司;ZO-1(ab190085)、Occludin(ab216327)、GAPDH(ab9485)兔抗以及HPR标记的羊抗兔(ab6721)购自美国abcam公司。
1.2 方法
1.2.1 分组、造模及干预方法 按照随机数字表法将小鼠分为对照组、模型组、si-NC组、si-LncRNA MEG3组、si-LncRNA MEG3+anti-miR-NC组、si-LncRNA MEG3+anti-miR-17-5p组,每组15只。除对照组外,其余各组小鼠均按照文献[9]方法构建HIBD模型。乙醚吸入麻醉后让小鼠仰卧于手术板上,碘伏局部消毒后在颈部正中切口,分离皮下组织,结扎右侧颈总动脉,逐层缝合皮肤,送回母笼恢复。2 h后将其放入包含8%氧气+92%氮气混合气体的密闭缺氧箱中缺氧处理2 h,完成造模。造模结束使用Longa评分进行神经行为缺损评分,评分为2~3分即为造模成功[10]。造模成功后,si-NC组、si-LncRNA MEG3组分别脑内注射5 μL si-NC及si-LncRNA MEG3,si-LncRNA MEG3+anti-miR-NC组、si-LncRNA MEG3+anti-miR-17-5p组除注射si-LncRNA MEG3外注射5 μL anti-miR-NC与anti-miR-17-5p,注射完毕退针。
1.2.2 神经功能评分 各组小鼠处理完毕后均进行Longa评分。0分:无神经功能损伤;1分:小鼠不能完全的伸直前肢;2分:小鼠一侧瘫痪,存在追尾现象;3分:小鼠不能打滚及站立;4分:小鼠无法进行自发性活动,存在意识障碍。
1.2.3 血-脑屏障通透性测定 各组小鼠造模后按照1.2.1的分组方法处理24 h,然后每组挑选5只小鼠通过尾静脉注射2% EB(2 mL/kg),循环1 h后,生理盐水灌流,断头取缺血侧脑组织,于冰上分离,称量湿重,加入5 mL甲酰胺,对脑组织进行匀浆,水浴48 h,离心(4000 r/min、15 min)。分光光度计测定上清液吸光度值(630 nm处),计算脑组织中EB含量,设置3个重复。EB含量与血-脑屏障通透性呈正比。
1.2.4 脑含水量情况测定 各组小鼠造模后按照1.2.1的分组方法处理24 h,然后每组挑选5只小鼠,采用戊巴比妥钠麻醉后断头取左侧脑组织,称量湿重,烘干后测干重。脑含水量(%)=(湿重-干重)/湿重×100%。
1.2.5 LncRNA MEG3、miR-17-5p水平测定 每组选取剩余的5只小鼠分离血肿组织,平均分为3份。提取其中一份脑组织RNA,将一定量的RNA逆转录为cDNA,通过实时荧光定量PCR法进行扩增,程序设定为:95 ℃预热5 s,95 ℃ 15 s、60 ℃ 30 s、72 ℃ 15 s,以2-△△Ct方法分析LncRNA MEG3、miR-17-5p表达情况,其中LncRNA MEG3以GAPDH作为内参,miR-17-5p以U6作为内参,引物见表1。

表1 qRT-PCR引物
1.2.6 小鼠血-脑屏障结构观察 取1.2.5中脑组织一份,经过固定(1%锇酸)、脱水、包埋后切片(60 nm),进行醋酸铀和枸橼酸铅染色,透射电镜观察脑组织切片超微结构。
1.2.7 小鼠脑组织ZO-1、Occludin蛋白测定 取1.2.5中脑组织一份并裂解,离心后得上清,总蛋白经蛋白提取试剂盒提取,定量蛋白(BCA试剂盒),经SDS-PAGE电泳后将目的蛋白转膜至PVDF膜,封闭,添加ZO-1、Occludin、GAPDH一抗(稀释比均为1∶1000),孵育过夜后添加二抗,孵育1 h,ECL试剂进行显色后经凝胶成像仪曝光、观察,Image-J软件分析ZO-1、Occludin蛋白灰度值,并计算其含量。

2 结 果
2.1 各组小鼠神经功能缺损评分的比较 与对照组(0分)相比,模型组[(2.60±0.32)分]小鼠神经功能缺损评分显著升高(P<0.05)。与模型组相比,si-NC组[(2.57±0.28)分]小鼠神经功能缺损评分差异无统计学意义(P>0.05),si-LncRNA MEG3组[(1.40±0.15)分]小鼠神经功能缺损评分显著降低(P<0.05)。与si-LncRNA MEG3组相比,si-LncRNA MEG3+anti-miR-NC组[(1.42±0.17)分]小鼠神经功能缺损评分差异无统计学意义(P>0.05),si-LncRNA MEG3+anti-miR-17-5p组[(1.94±0.21)分]小鼠神经功能缺损评分显著升高(P<0.05)。
2.2 各组小鼠脑含水量的比较 与对照组[(62.10±2.15)%]相比,模型组[(85.23±2.25)%]小鼠脑含水量显著升高(P<0.05)。与模型组相比,si-NC组[(83.57±2.26)%]小鼠脑含水量差异无统计学意义(P>0.05),si-LncRNA MEG3组[(72.79±2.04)%]小鼠脑含水量显著降低(P<0.05)。与si-LncRNA MEG3组相比,si-LncRNA MEG3+anti-miR-NC组[(73.75±2.06)%]小鼠脑含水量差异无统计学意义(P>0.05),si-LncRNA MEG3+anti-miR-17-5p组[(78.58±2.19)%]小鼠脑含水量显著升高(P<0.05)。
2.3 各组小鼠血-脑屏障血管内皮细胞情况 见图1。对照组小鼠血管内皮结构完整、薄厚均匀、无明显水肿、内皮细胞连接紧密,吞饮小泡数量少。模型组小鼠血管内皮薄厚不均多处呈现水肿状态、内皮细胞连续性消失、吞饮小泡数量增多。与模型组相比,si-LncRNA MEG3组血管内皮细胞逐渐连接紧密、薄厚较为均匀,水肿减少;与si-LncRNA MEG3组相比,si-LncRNA MEG3+anti-miR-17-5p组血管内皮细胞损伤加重。
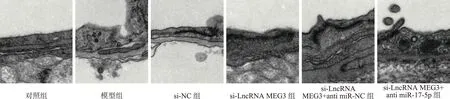
图1 各组小鼠血-脑屏障血管内皮细胞电镜图(×15000)
2.4 各组小鼠血-脑屏障通透性比较 与对照组[(8.72±1.06)μg/g]相比,模型组[(31.75±4.69)μg/g]小鼠EB含量升高(P<0.05)。与模型组相比,si-NC组[(32.16±4.52)μg/g]小鼠EB含量差异无统计学意义(P>0.05),si-LncRNA MEG3组[(14.35±2.71)μg/g]小鼠EB含量降低(P<0.05)。与si-LncRNA MEG3组相比,si-LncRNA MEG3+anti-miR-NC组[(14.62±2.69)μg/g]小鼠EB含量差异无统计学意义(P>0.05),si-LncRNA MEG3+anti-miR-17-5p组[(21.37±3.58)μg/g]EB含量升高(P<0.05)。
2.5 各组小鼠miR-17-5p、LncRNA MEG3表达情况的比较 见表2。与对照组相比,模型组小鼠LncRNA MEG3水平显著升高,miR-17-5p显著降低(均P<0.05)。与模型组相比,si-NC组小鼠LncRNA MEG3、miR-17-5p水平差异无统计学意义(均P>0.05),si-LncRNA MEG3组小鼠LncRNA MEG3水平显著降低,miR-17-5p水平显著升高(均P<0.05)。与si-LncRNA MEG3组相比,si-LncRNA MEG3+anti-miR-NC组小鼠LncRNA MEG3、miR-17-5p水平差异无统计学意义(均P>0.05),si-LncRNA MEG3+anti-miR-17-5p组miR-17-5p水平显著降低(P<0.05)。
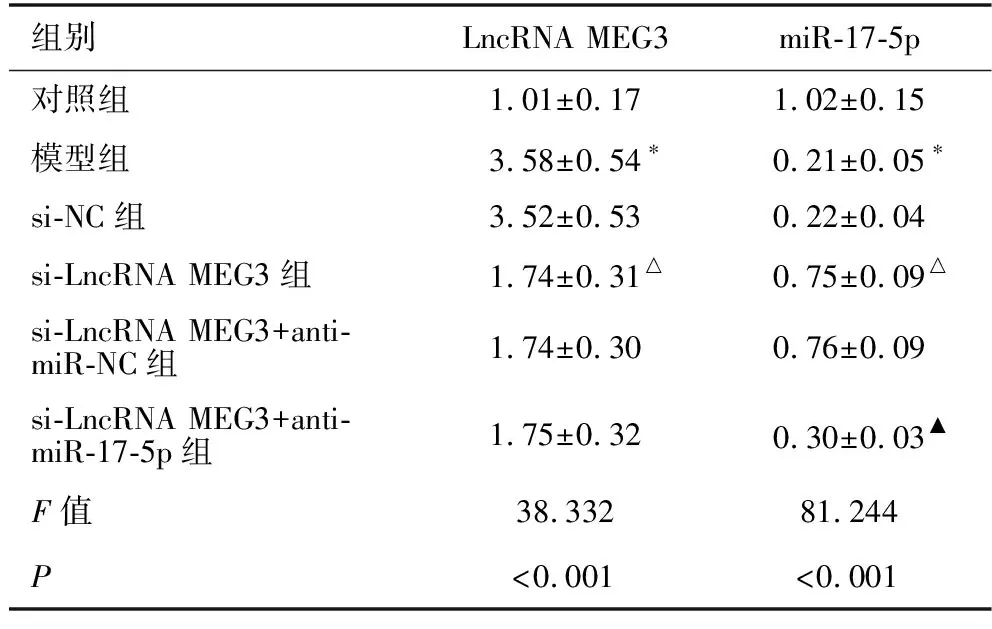
表2 各组小鼠LncRNA MEG3、miR-17-5p水平的比较(n=5)
2.6 各组小鼠ZO-1、Occludin蛋白水平的比较 见图2、表3。与对照组相比,模型组小鼠ZO-1、Occludin蛋白表达显著降低(均P<0.05)。与模型组相比,si-NC组小鼠ZO-1、Occludin蛋白表达差异无统计学意义(均P>0.05),si-LncRNA MEG3组小鼠ZO-1、Occludin蛋白表达显著升高(均P<0.05)。与si-LncRNA MEG3组相比,si-LncRNA MEG3+anti-miR-NC组小鼠ZO-1、Occludin蛋白表达差异无统计学意义(均P>0.05),si-LncRNA MEG3+anti-miR-17-5p组ZO-1、Occludin蛋白表达显著降低(均P<0.05)。
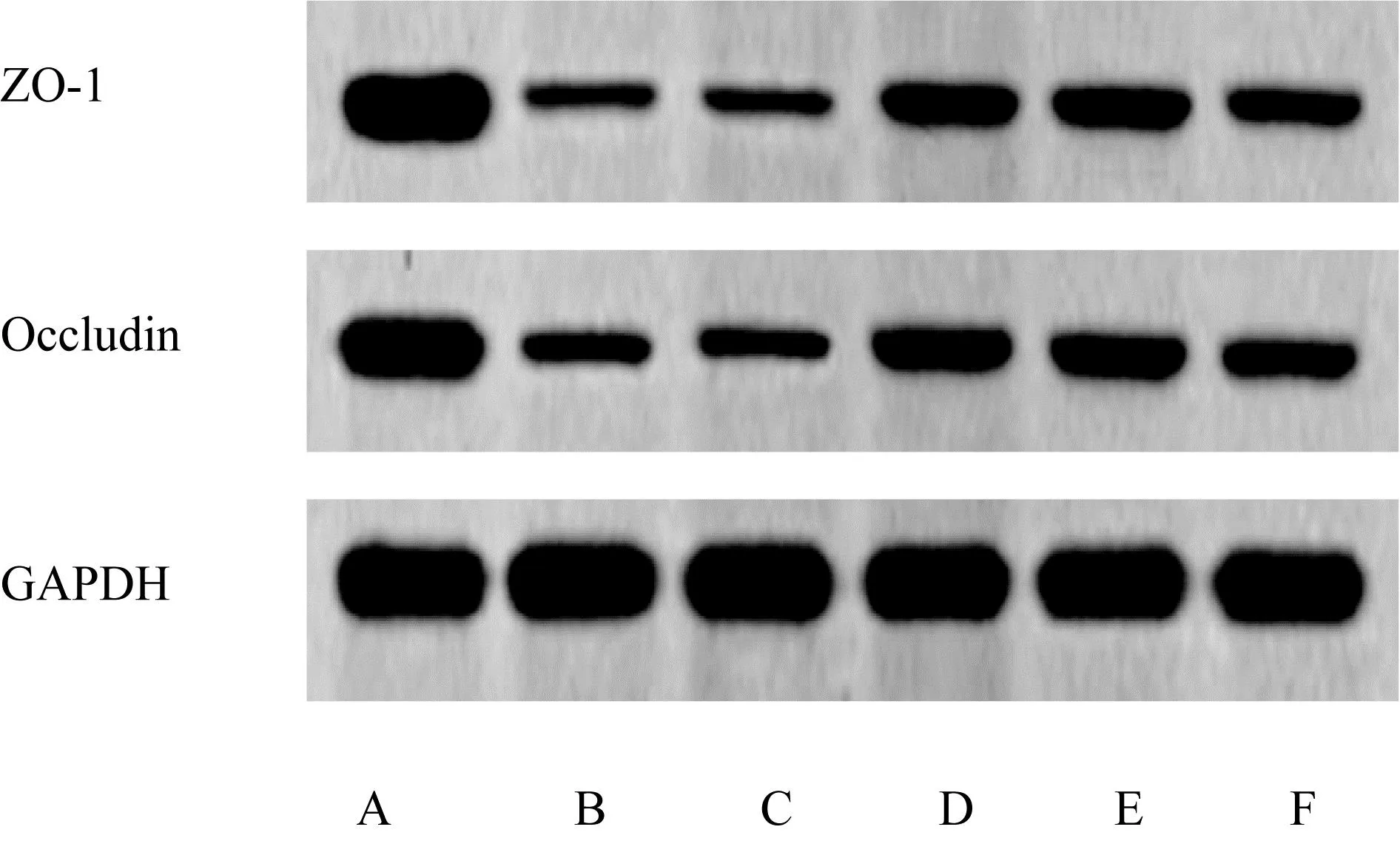
图2 各组小鼠ZO-1、Occludin蛋白表达A:对照组;B:模型组;C:si-NC组;D:si-LncRNA MEG3组;E:si-LncRNA MEG3+anti-miR-NC组;F:si-LncRNA MEG3+anti-miR-17-5p组。
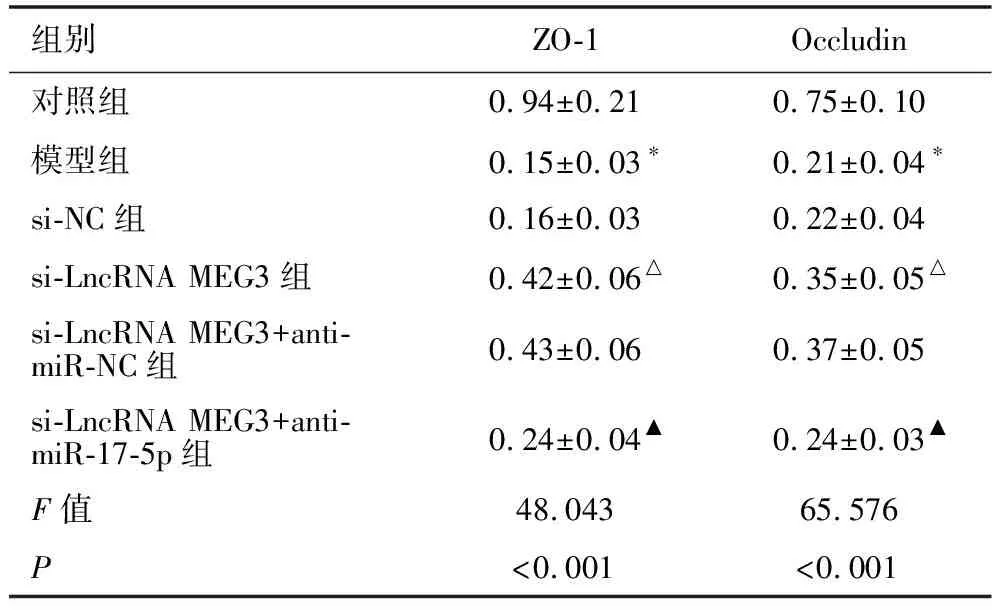
表3 各组小鼠脑组织ZO-1、Occludin蛋白水平的比较(n=5)
3 讨 论
新生儿HIE是围生期窒息引发的脑部缺血缺氧导致脑组织受损的疾病,对患儿的生存以及日后生活质量均有负面影响[11]。血-脑屏障是遍布于脑组织周围的脑毛细血管壁构成的脉络丛屏障,可以有效隔开血浆与CSF,阻碍血液中的一些有害物质进入,在维护CNS的生理功能方面发挥重要作用[12]。缺血缺氧造成的刺激会引起血-脑屏障结构的损害,为继发性脑损伤提供条件。
本研究通过构建新生小鼠HIBD模型进行血-脑屏障影响相关机制的研究,所构建模型脑组织含水量升高,出现神经受损症状,提示新生小鼠造模成功,有神经受损、氧化应激损伤症状。LncRNA在大脑中特异性表达,并参与神经系统疾病。大量研究[13-14]显示,LncRNA在HIBD模型中表达异常。LncRNAMEG3是一种抑癌基因,在脑损伤相关疾病中发挥一定作用。LncRNA MEG3在神经系统疾病中异常表达,如MEG3-miR-455-pI3K轴在大脑中动脉闭塞小鼠脑梗死缺氧神经干细胞损伤模型的氧化应激、增殖、凋亡中发挥作用[15];下调MEG3可减少中脑动脉闭塞/再灌注模型小鼠脑梗死面积[16];MEG3可调控脑卒中后血管新生的功能[17];下调MEG3可减轻过氧化氢诱导的PC12细胞损伤[18]。本研究中模型组小鼠MEG3水平升高,此时小鼠神经功能损伤评分升高,脑含水量升高,血-脑屏障通透性升高,ZO-1、Occludin蛋白表达降低,提示MEG3改变可能与HIBD小鼠的发病有关,MEG3变化可能与血-脑屏障完整性有关。Occludin是体内血-脑屏障功能完整性的关键跨膜调节剂。ZO-1是一种膜相关鸟苷酸激酶样蛋白,将跨膜紧密连接蛋白连接到肌动蛋白细胞骨架上。ZO-1与结复合体的分离导致血-脑屏障通透性增加[19]。血-脑屏障破坏与这些紧密连接蛋白和血-脑屏障转运蛋白的异常表达有关[20]。ZO-1、Occludin表达的下降导致血-脑屏障完整性受损[21],与本研究一致。当沉默MEG3表达后,小鼠神经功能损伤评分降低,血-脑屏障通透性降低,ZO-1、Occludin蛋白表达升高,提示MEG3沉默可能通过调节ZO-1、Occludin蛋白表达恢复血-脑屏障的阻滞作用,保护HIBD小鼠免受有害物质的侵袭。
miRNA被认为是HIBD发病机制中的关键介质。LncRNA通常通过海绵化miRNA调控相关靶基因发挥作用,在HIBD期间,miRNA表达发生显著变化。miR-17-5p可保护新生小鼠免受HIBD[22]。Chen等[7]研究显示,miR-17-5p在抑制HIBD新生大鼠炎性激活中发挥作用。本研究中,HIBD模型小鼠miR-17-5p水平降低,提示其在HIBD中发挥作用。研究[8]显示,miR-17-5p是MEG3的靶标。MEG3沉默可能通过海绵化miR-17-5p降低血-脑屏障通透性。进一步研究表明,在MEG3沉默基础上抑制miR-17-5p表达后,MEG3的沉默不能显著减轻HIBD小鼠的神经损伤、脑水肿以及血-脑屏障通透性。MEG3沉默可能通过上调miR-17-5p发挥对HIBD小鼠的神经保护以及血-脑屏障保护作用。
综上所述,LncRNA MEG3沉默可能通过上调miR-17-5p,降低HIBD新生小鼠血-脑屏障通透性,维持血-脑屏障对大脑的保护作用,保护脑组织。下一步将开展细胞实验进行进一步验证。
作者贡献说明范敏娜指导选题、设计研究,指导起草、修改文章,提供技术材料;李明提出选题,设计、实施研究,采集、分析、解释数据,撰写、修改文章
