羟基壬烯醛通过抑制内皮细胞焦亡减轻新生儿脓毒症诱导的急性肺损伤
2024-03-11武周游李婷张腾伟房巧燕杨刘黎巧
武周游 李婷 张腾伟 房巧燕 杨刘 黎巧
湖南省妇幼保健院新生儿一科(长沙 410008)
急性肺损伤(acute lung injury, ALI)是常见的脓毒症临床并发症,具有较高的发病率和死亡率,其特征是肺的上皮层和内皮层均受损,导致肺水肿和急性呼吸衰竭[1-2]。因此,内皮细胞(epithelial cells, ECs)损伤或死亡被认为是ALI 的主要病理特征之一。目前,越来越多的证据表明细胞焦亡与ALI 有关。细胞焦亡由炎症小体(NLRP3)触发,并依赖于胱天蛋白酶-1(Caspase-1)激活和gasdermin D (GSDMD)裂解,诱导IL-1β 和IL-18 成熟[3]。临床研究[4]发现,脓毒症患者外周单核细胞中Caspase-1 的表达显著增加,并与脓毒症的发生和不良预后相关。此外,激活的NLRP3 炎性小体通过直接激活Caspase-1 介导的细胞焦磷酸转移和间接释放的促炎细胞因子而加重脓毒症小鼠肺损伤[5-6]。因此,细胞焦亡被认为是维持肺内皮完整性和治疗ALI 的潜在治疗靶点。最近的数据[7]表明,内源性脂质或其氧化产物可以激活或抑制 NLRP3 的组装。在由脂质过氧化产生的活性醛中,4-羟基壬烯醛(4-hydroxynonenal, HNE)是最丰富的终产物。已证实,HNE 产生有益的效果,包括刺激内源性抗氧化防御机制、抑制炎症和巨噬细胞焦亡[8]。然而,尚不清楚HNE 是否有助于减轻新生儿脓毒症诱导的ALI。在本研究中,我们通过盲肠浆液(cecal slurry, CS)在野生型和GSDMD-/-新生小鼠中建立了ALI 模型,并通过腹腔注射HNE 治疗,结果显示HNE 可以通过下调NLRP3/caspase-1 信号来抑制ECs 细胞焦亡,进而有助于减轻肺部损伤。
1 材料与方法
1.1 动物和分组新生(5 ~ 7 d)C57BL/6J 雄性小鼠(野生型)和C57 GSDMD-/-雄性小鼠购自江苏集萃药康生物科技股份有限公司。小鼠饲养于SPF级实验动物中心,室温保持在大约22 ℃。研究经湖南省妇幼保健院伦理委员会审批通过(编号:2021-012-05)。将它们随机分成5 只小鼠/笼,在12 h 的昼夜循环中正常喂食和饮水。将所有小鼠随机分为5 组:(1)假手术组(Sham 组);(2)假手术小鼠接受HNE 治疗组(Sham+HNE 组);(3)盲肠浆液(cecal slurry,CS)处理组(CS 组);(4)CS 处理的GSDMD-/-小鼠组(CS + GSDMD-/-组);(5)CS 小鼠接受HNE 治疗组(CS + HNE 组)。根据文献[9]描述的方法建立了CS 模型以诱导新生儿脓毒症。具体操作为:处死成年小鼠,收集盲肠内容物并与5%葡萄糖溶液混合以产生CS 溶液(80 mg/mL)。在Sham 组和Sham + HNE 组中,小鼠接受0.9%盐水的腹膜内注射。在其他组中,小鼠接受浓度为1.3 mg/g 体质量(BW)的CS 腹膜内注射。在CS +HNE 组,小鼠接受了腹腔注射CS 和6 μmol/L HNE(美国Sigma 公司)[8]。每12 h 记录1 次小鼠的存活状态,计算72 h 内小鼠的存活率,存活小鼠使用过量(150 mg/kg BW)的戊巴比妥钠处死。收集肺组织进行苏木精-伊红(H&E)染色,以评估脓毒症小鼠肺的病理损伤,从而确定建模是否成功。
1.2 肺组织病理学将肺组织固定在4%多聚甲醛中,包埋在石蜡中,切成5 μm 厚的切片,然后用H&E 染色。使用RX51 显微镜(日本Olympus 公司)进行组织病理学检查。根据国际标准评估肺损伤评分[10]。从每个切片中随机选择6 个区域,根据5 个标准评估肺损伤的严重程度:(1)肺泡中性粒细胞积聚;(2)间质中性粒细胞积聚;(3)透明膜形成;(4)肺泡蛋白渗出;(5)肺泡间隔厚度。每个项目的得分为0 - 4,如下所示:0,无损伤;1,轻伤;2,中度损伤;3,重伤;4,非常严重的损伤。累积损伤的分数定义为ALI 的总分数。
1.3 肺湿/干重量比分离新鲜肺并称重以测量湿重。然后,将它们在80 ℃的烘箱中干燥48 h,称重以确定干重。最后,计算肺湿/干重比来评估肺水肿。
1.4 CT 图像每组随机抽取5 只小鼠,胸部CT扫描由广州瑞舒生物科技有限公司完成。选择在获得的连续图像中具有最小冠状心包阴影图像的横截面图像。
1.5 蛋白质印迹法用含有放射免疫沉淀分析缓冲液(美国Thermo Fisher 公司)的蛋白酶抑制剂混合物提取总肺蛋白,用BCA 试剂盒(美国Thermo Fisher 公司)测定浓度。将蛋白质浓度稀释至3 μg/μL,并在100 ℃的恒温水浴中煮沸10 min,使蛋白质样品完全变性。使用8% ~ 12% SDSPAGE 凝胶分离蛋白,并转移到0.45 μm 聚偏二氟乙烯(PVDF)膜上。将PVDF 膜与第一抗体在4 ℃下孵育过夜,用含吐温缓冲液的Tris 缓冲盐水冲洗后,膜与第二抗体在室温下孵育2 h。使用化学发光过氧化物酶底物(美国Millipore 公司)观察蛋白质条带。利用Image J 软件进行定量光密度分析。本研究中使用了以下抗体:抗HNE、抗NLRP3、抗Caspase-1、抗GSDMD-N、抗IL-1β、抗IL-18、山羊抗兔IgG、β-Actin 和GAPDH(均购自英国Abcam 公司)。
1.6 RNA 测序和生物信息学分析使用RNAiso Plus(日本Takara 公司)从CS 组和CS + HNE 组小鼠的肺组织中提取总RNA。在定量和定性后,每个样品1 μg RNA 用作RNA 样品制备的输入材料。使用NEB next ultraTMRNA Library Prep Kit(美国NEB 公司)在Illumina 系统上生成测序文库。索引代码被添加到每个样品的属性序列中。然后使用TruSeq PE Cluster Kit v3-cBotHS 在cBot-Cluster 生成系统上对索引编码的样品进行聚类。在Illumina Novaseq 平台上对文库制备物进行测序,产生了150 bp 的成对末端读数。
用fastp(版本0.19.8)检测和修剪接头序列,然后进行原始阅读质量过滤。通过HISAT2(版本2.1.0)将处理后的读数与参考基因组(ENSEMBL基因组)进行比对。从ENSEMBL 数据库的GTF file 下载创建用于描述基因组特征的模型。在R中使用DEseq2 分析差异表达基因(Differentially expressed genes, DEG)。在R 中使用kohonen 软件包(版本3.0.10)进行聚类分析。使用R 软件包clusterprofler(版本3.14.3)进行基因本体(GO)分析和基因集合富集分析(GSEA)。校正P< 0.05 的GO 术语或基因集分别认为是显著富集的术语和途径。
1.7 肺ECs 培养和分组在脓毒症小鼠麻醉后,用无菌PBS 缓冲液灌注右心室,直到肺无血。随后,将肺切成1 mm 的小片,用0.25%胰蛋白酶在37 ℃溶解45 min。用血小板内皮细胞粘附分子-1包被的磁珠分选所得细胞悬液。将分离的肺ECs铺在纤连蛋白包被的T-25 烧瓶上。此外,用Dulbecco 氏改良Eagle 培养基培养ECs。使用流式细胞仪用抗CD-31 鉴定ECs,细胞> 90%未被污染。将ECs 分为Ctrl 组、LPS + ATP 组、LPS + ATP +HNE-L 组和LPS + ATP + HNE-H 组。除Ctrl 组外,其他组细胞用LPS(100 ng/mL,美国Sigma 公司)预处理细胞3 h,然后加入ATP(2 mmol/L,美国Sigma 公司)处理细胞60 min。对于LPS + ATP +HNE-L 组。
LPS + ATP + HNE-H组,在细胞暴露于LPS时,同时分别加入0.3 μmol/L HNE 或3 μmol/L HNE。Ctrl 组加入等量的DMSO 溶媒处理[8]。
1.8 免疫荧光将肺冷冻切片用甲醇固定。对于培养的细胞,将细胞铺在盖玻片上并用4%多聚甲醛固定。用山羊血清封闭后,将初级抗体加入切片中,在4 ℃孵育过夜。随后,将切片在黑暗中与含有DAPI 和第二抗体的封闭缓冲液一起温育2 h。使用RX51 荧光显微镜(日本Olympus 公司)获得图像。本研究中使用了以下抗体:抗HNE、抗GSDMD、抗Caspase-1 和Cy3 缀合的山羊抗兔IgG(均购自英国Abcam 公司)。
1.9 统计学方法使用SPSS 25.0 对数据进行统计分析。结果表示为平均值±标准偏差。通过方差分析和Newman-Keuls 检验分析组间差异。通过Kaplan-Meier 检验绘制生存曲线,通过log-rank检验分析组间差异。P< 0.05 认为差异有统计学意义。
2 结果
2.1 脓毒症小鼠肺组织中HNE水平显著增加CS小鼠肺组织中的HNE 以时间依赖性方式逐渐降低。此外,我们在CS 小鼠中腹腔注射HNE,结果显示小鼠肺组织中HNE 水平明显增加(图1)。
2.2 HNE 对CS 小鼠肺病变和死亡率的影响H&E 染色显示,与CS 组相比,CS + HNE 组和CS +GSDMD-/-组小鼠的肺组织评分显著降低(P< 0.05)(图2A)。计算机断 层扫描证实了HNE 和GSDMD基因缺失可以减轻肺损伤,并且CS + HNE 组和CS + GSDMD-/-组小鼠肺组织的湿和干重量比显著低于CS 组(图2B-C)。小鼠72 h 存活率观察结果显示,与CS 组相比,CS + HNE 组和CS + GSDMD-/-组小鼠的存活率显著提高(P< 0.05)。

图2 HNE 对CS 小鼠肺病变和死亡率的影响Fig.2 The effect of HNE on lung disease and mortality in CS mice
2.3 小鼠肺的 RNA 测序分析对标准化的基因计数进行差异表达分析,以确定各组之间的DEG。图3A 显示了CS 组和CS + HNE 组中P< 0.05 且差异倍数≥ 1.0 的DEG。在GSEA 研究中发现HNE下调了炎症反应和氧化应激(图3B-C)。DEG 的GO 分析揭示了HNE 在脓毒症诱导的ALI 中的保护作用机制涉及细胞焦亡通路(图3D)。
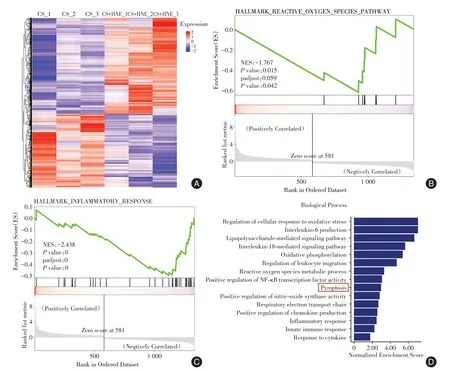
图3 小鼠肺组织的RNA 测序分析Fig. 3 RNA sequencing analysis of mouse lung tissue
2.4 HNE 对 CS 小鼠肺细胞焦亡的影响CS 显著上调小鼠肺组织中GSDMD 的表达,而HNE 显著下调CS 小鼠肺组织中GSDMD 的表达(图4A)。与Sham 组相比,CS 组肺ECs 中GSDMD-N 表达(GSDMD 的活性形式)显著增加(P< 0.05)。CS +HNE组和CS + GSDMD-/-组小鼠的肺ECs中GSDMDN表达显著低于CS组(P< 0.05)(图4B)。与Sham组相比,CS 组肺ECs 中C-caspase-1、NLRP3、IL-18、IL-1β表达显著增加(P< 0.05)。CS + HNE 组和CS+ GSDMD-/-组小鼠的肺ECs中C-caspase-1、NLRP3、IL-18、IL-1β 表达显著低于CS 组(P< 0.05)(图4C、D)。
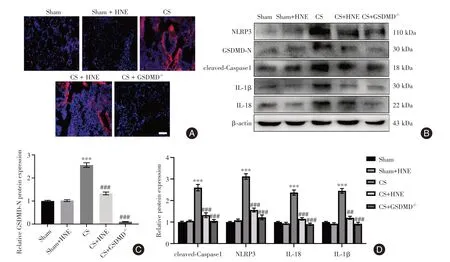
图4 HNE 对脓毒症小鼠细胞焦亡激活的影响Fig.4 Effect of HNE on activation of cell apoptosis in septic mice
2.5 HNE 对ECs 细胞焦亡的影响在细胞实验中,与Ctrl 细胞相比,LPS + ATP 显著降低细胞活力(P< 0.05),和增加了GSDMD、C-caspase-1、NLRP3、IL-18、IL-1β的蛋白表达(P< 0.05),而这些作用也被HNE 抑制(图5),表明HNE 通过NLRP3/Caspase-1 途径调节ECs 细胞的焦亡作用。

图5 HNE 在体外抑制了ECs 的细胞焦亡Fig.5 HNE inhibited the cell death of ECs in vitro
3 讨论
ALI 是脓毒症最常见的并发症之一,病死率高。严重感染可导致过度炎症反应和内皮屏障破坏,最终导致感染性ALI 的高死亡率[2]。因此,有效维持脓毒症时ECs 的功能仍然是一个亟待解决的问题。先前研究[8]发现,HNE 不仅是脂质过氧化的产物,而且还作为信号分子发挥重要作用,通过调节NLRP3 炎症小体的激活抑制炎症。在这项研究中,HNE 在CS 诱导的新生脓毒症小鼠肺组织中的表达显著降低。体内和体外研究表明,HNE 通过抑制ECs 细胞焦亡减少ALI。
HNE 是一种多效性脂质过氧化标记物,其能够干扰诱导炎症的主要生物分子的信号转导和活性并充当自由基的第二信使,因此参与各种病理生理过程[11]。最近的数据[8]表明,当细胞在LPS 刺激前用高剂量HNE(25 μmol/L)处理时,HNE 通过单核细胞和巨噬细胞中的NF-κB 信号调节IL-1β分泌,减轻肺损伤。近年来,在各种炎症疾病模型中发现HNE 在调节炎症和细胞凋亡中发挥重要作用[12-13]。这项研究发现,HNE 表达在脓毒症小鼠肺组织中显著降低,通过腹腔注射HNE 可在CS 诱导的ALI 小鼠模型中发挥保护作用。
细胞焦亡被认为是ALI 中内皮功能损伤的重要机制,也是ALI 治疗的重要靶点[5]。因此,本研究分析了GSDMD 缺失和HNE 对脓毒性ALI 的影响。结果显示,HNE 和GSDMD 基因缺失显著减轻了ALI肺组织损伤,并提高了脓毒症小鼠的存活率。通过对小鼠肺的RNA 测序分析,我们发现HNE 在脓毒症诱导的ALI 中的保护作用机制涉及细胞焦亡通路。研究发现,生理浓度(3 μmol/L)的HNE阻断了nigericin 和ATP 诱导的细胞焦亡[8]。此外,HNE 可显著降低肺组织中促炎细胞因子水平和ECs 焦亡,并通过抑制Cas-11 的表达来减轻溃疡性结肠炎的症状并改善的预后[14]。根据上述结果,我们推测HNE 通过抑制细胞焦亡在ALI 中发挥保护作用。
炎症性胱天蛋白酶的激活是介导细胞焦亡的关键途径[15-17]。NLRP3/Caspase-1 依赖型细胞焦亡在ALI 中起重要作用,并被认为是ALI 的潜在治疗靶点[18-19]。LPS 可以通过TLR4-NLRP 3 信号通路诱导ECs 中Caspase-1 的激活[20]。研究[21-22]表明,Caspase-1 的激活不仅诱导ECs 焦亡,而且诱导IL-1β 产生,IL-1β 是增加毛细血管通透性和促进炎症反应的重要因素。值得注意的是,最近研究证实HNE 是NLRP3 炎症小体激活和随后炎症的一种新的内源性抑制剂,调节 HNE 的形成可能是抑制NLRP3 炎症小体激活、IL-1β 分泌和组织炎症的一种新的治疗方法[8]。在这项研究中,HNE 的表达水平降低可能通过NLRP3/Caspase-1 途径促进细胞焦亡。在体外研究中,我们采用LPS + ATP联合刺激的方法模拟肺ECs 脓毒症。与LPS + ATP组相比,HNE 抑制了NLRP3/Caspase-1 的激活以及GSDMD、IL-1β 的成熟,并增加了ECs 的活性。因此,HNE 可以阻止细胞焦亡,从而保护ECs 的完整性,维持屏障功能,抵抗致病因子的入侵。
总之,我们的结果表明,HNE 的表达在脓毒症新生小鼠中降低,其可以通过抑制NLRP3/caspase-1信号传导来抑制肺ECs 细胞焦亡,并改善小鼠的ALI。这些发现揭示了内源性脂质或其氧化产物在保护新生儿ALI 中的作用,提示了一种新的潜在治疗策略。然而,这项研究并不是全面的,需要进一步研究以揭示内源性脂质或其氧化产物的深层调控机制,如HNE 的其他靶信号作为进一步研究的目标。
【Author contributions】WU Zhouyou performed the experiments and wrote the article. LI Ting and ZHANG Tengwei performed the experiments. FANG Qiaoyan and YANG Liu revised the article. LI Qiao designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
