循环肿瘤DNA检测在人乳头瘤病毒相关性宫颈癌中的应用与展望
2024-03-11江宝妮张美琴杨露陈致远韩娜娜
江宝妮 张美琴 杨露 陈致远 韩娜娜
南方医科大学珠江医院妇产医学中心 (广州 510280)
循环肿瘤DNA(circulating tumor DNA,ctDNA)是由肿瘤细胞主动分泌或肿瘤细胞坏死或凋亡过程中释放的片段化无细胞状态DNA,长度在132 ~145 bp,半衰期一般不超过2 h,大多存在于血浆或血清中,由双链或单链DNA 混合而成,可直接反映肿瘤相关信息[1]。有研究[2]表明,癌症早期ctDNA的含量极低,而晚期肿瘤在血液中释放的ctDNA明显增加。
人乳头瘤病毒(human papilloma virus,HPV)是属于乳头多瘤空泡病毒科乳头瘤病毒属的一组球形、微小、无包膜的环状双链DNA 病毒。其中,高危型HPV 长期感染是诸多妇科恶性肿瘤的重要病因,与约99.7%的宫颈癌[3]、29% ~ 43%的外阴癌、70%阴道癌[4]相关,HPV-DNA 整合到宿主基因组中,通常每个细胞以多个拷贝存在,因此也以ctDNA 的形式释放。
基于ctDNA 检测技术的出现和更新,为HPV相关性妇科恶性肿瘤的病程监测提供了一种新的选择。本综述主要总结了HPV-ctDNA 在宫颈癌中的应用,进而讨论HPV-ctDNA 在其他HPV 相关性妇科恶性肿瘤中应用的可能及前景。
1 ctDNA 与HPV 相关性宫颈癌
1.1 ctDNA 检测在HPV 相关型宫颈癌中应用的可行性绝大多数宫颈癌与HPV 相关。HPV 基因组编码6 种主要影响病毒基因调控及细胞转化的早期(E)蛋白,2 种影响病毒衣壳形成的晚期(L)蛋白的DNA 序列和一段称为上游控制区或长控制区的DNA调控序列。E6和E7蛋白分别结合P53和pRb蛋白,使肿瘤抑制蛋白显著减少,引起上皮细胞永生化。因此,E6、E7基因成为研究中的热点。
HPV 基因大多与宿主细胞的基因组发生整合,形成特异性的病毒-细胞DNA 连接,已有研究证实这种特异性连接可以通过不同的PCR 技术在HPV 相关型宫颈癌患者血浆中检测出[5-6]。瑞典卡罗林斯卡学院SIVARS 等[7]总结了近22 年的研究,发现HPV-ctDNA 在HPV 阳性的浸润性宫颈癌治疗前患者血液样本中是可检测到的,而在HPV 阳性的宫颈癌前病变及无宫颈病变人群治疗前血液样本中极少检测到HPV-ctDNA,特别是在2016 年后进行的研究中均无检测到HPV-ctDNA 记录。因此,HPV-ctDNA 可作为浸润性宫颈癌特异性生物标志物是具有可行性的。
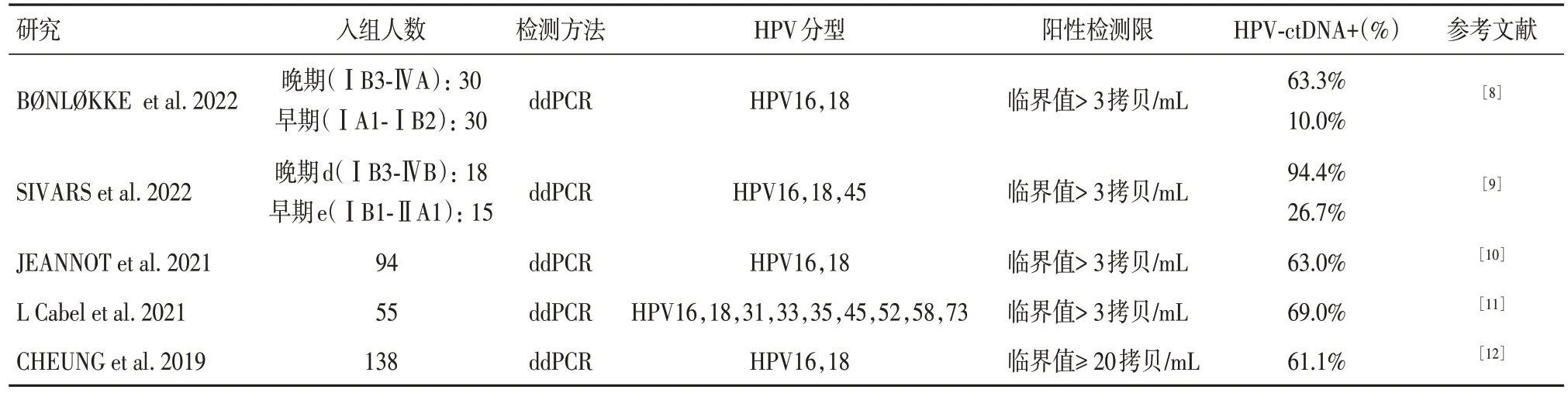
表1 近5 年浸润性宫颈癌的HPV-ctDNA 研究汇总Tab.1 Studies investigating detection of HPV-ctDNA from patient with invasive cervical cancer in the last five years
1.2 ctDNA 在HPV 相关性宫颈癌中的应用
1.2.1 常规随访手段及其局限大多数妇科恶性肿瘤患者在治疗结束5 年内,前2 年内每3 ~ 6 个月复查1 次,随后每6 ~ 12 个月复查1 次。随访内容包括复发或治疗不良反应相关的症状回顾,以及全面的临床检查。影像学需待肿瘤达到一定体积后才能检测出,存在滞后性,且因辐射等原因不能实时监测;血清学肿瘤标志物间接反映肿瘤状态,不能直接提供肿瘤进展信息,与病理相关性差,敏感性和特异性较低;病理学组织活检、免疫组化等需穿刺活检或手术后才能获得肿瘤组织,因此取材困难,亦不能作为实时监测手段。
1.2.2 ctDNA 检测技术的应用ctDNA 会携带来源于肿瘤细胞相关的遗传学特征,如基因突变、甲基化、扩增或重排等,在为肿瘤筛查、诊断、治疗疗效评估及预后风险分层等肿瘤全病程管理中显露独特优越性[13]。
实体瘤ctDNA 检测技术主要有两类:一类基于PCR 分析技术,以三代的微滴数字PCR(droplet digital PCR,ddPCR)为代表,将复杂的混合物中单个靶向序列分隔入独立单元进行检测,实现了在单个分子水平上定量检测肿瘤基因突变的罕见事件,检测的灵敏度达到0.001%;第二类是基于高通量测序技术,较具代表性技术为肿瘤个体分析深度测序法(CAncer Personalized Profiling by deep SEQuencing,CAPP-Seq),其平均测序深度达23 570×,将检出分子突变信息结合基因组捕获区域的基因拷贝数变异等信息纳入评估模型[14]。
目前ctDNA 检测的主要策略有两种:其一,肿瘤知情分析(Tumor-informed assays)即先对原发肿瘤组织进行测序,找到特异性基因组突变位点,以定制多重PCR-NGS 面板,实现个性化ctDNA 检测分析;其二,肿瘤未知分析(Tumor agnostic assays),与前者不同的是,该策略不需要检测原发肿瘤组织,而通过某特定癌种的已知突变基因来预先选定引物或探针,设计与该癌种相关的固定面板进行检测及分析。
1.2.3 ctDNA 检测的优势ctDNA 检测为代表的液体活检具有微创,可反复取材,收集、处理和分析报告周转时间短等优势[13]。其中,HPV-ctDNA检出水平可评估治疗疗效,且与宫颈癌预后相关,受多种因素影响。有研究[15]发现治疗反应与ctDNA检测之间存在显著相关性,这表明ctDNA 有机会作为治疗疗效的生物标志物和该患者群体复发的预测因子;定量研究显示,采用ddPCR 方法,宫颈癌患者HPV-ctDNA 水平与临床分期和肿瘤大小有关,范围为(55 ± 85)拷贝/mL(Ⅰ期)至(1 774 ±3 676)拷贝/mL(Ⅳ期);即使在亚临床阶段,HPV 相关侵袭性癌症患者的血浆中也可检出HPV-ctDNA,其水平与肿瘤动态有关[16]。HPV-ctDNA 在晚期宫颈癌患者中更容易检测到,特别是在存在淋巴血管浸润、深层间质侵犯、盆腔淋巴结转及肿瘤负荷大等的情况下[8],与不良预后相关。在一些前瞻性研究中,大多数患者在治疗结束时HPV-ctDNA均被清除,而完成放化疗后血清中持续存在HPVctDNA 的患者获得较低的无病生存期(P= 0.048)和总生存期(P= 0.001 3)[11];从检测到HPV-ctDNA到复发,中位时间为10 个月,因此,HPV-ctDNA 可以作为治疗结束时的残留肿瘤标志物及预测随访期间复发的生物学指标[10,12]。
1.3 ctDNA 检测在HPV 相关性宫颈癌中应用的局限影响检测的因素包括HPV-ctDNA 的水平及检测手段。经计算,每3 mL 血液可产生1 mL 血浆,包含6 ng 无细胞DNA(cfDNA),即血液中游离的DNA,则理论上相当于每毫升血浆里含有多达2 000 个总的cfDNA 拷贝[17]。其中,85%的cfDNA来自血细胞,10%来自血管内皮细胞,1%来自肝细胞,剩余的来自包括癌细胞在内的其他细胞[18]。并且,身体里炎症、手术、组织损伤或使用化疗药物,甚至年龄、高强度运动,以及肝肾功能降解代谢强弱、核酸酶活性等因素,都可能改变cfDNA 在体内的水平[19]。因此,在强大的基因背景下找到特定的基因事件需要更精确的检测手段的支持。但检测的特异度和灵敏度是ctDNA 能否应用于临床的两个关键点,较低的灵敏度会阻碍ctDNA 检测发展,反之,高灵敏度带来的高假阳性会带给患者严重的心理负担。
1.4 ctDNA 检测在HPV 相关性宫颈癌中应用的展望世界卫生组织早在2020 年提出了一个“70%”的目标,即有70%的女性能够在45 岁之前接受高效宫颈癌筛查[20]。目前公认使用的高危型HPV 检测方法均无法区分一过性感染和持续性感染[21]。在广东,全省宫颈癌筛查检出率为56.50/10 万,早期诊断率为94.15%[22],ctDNA 检测技术的更新,能否将应用阶段提前,达到早期诊断的目的,成为了研究的热点。
短暂的HPV感染可能导致循环HPV-DNA产生并非完全不可能,但检出率极低,在高危地区健康女性中检出循环HPV-DNA 的概率为0 ~ 2%[7]。因此,HPV 阳性宫颈病变高危人群的血清中若可检出HPV-ctDNA,则可作为宫颈癌早期诊断的参考。随着ddPCR 技术的出现及应用,HPV 阳性浸润性宫颈癌局部晚期及晚期(ⅠB3-ⅣB)患者血浆中HPV-ctDNA 检出率为63.3% ~ 94.4%,而早期患者检出率仅为10% ~ 26.7%[8-9]。早期宫颈癌HPVctDNA 含量低,检出率也低,容易出现假阴性[23]。Luisa Galati 在最新的研究中介绍了一种检测方法——基于珠状HPV 基因分型试验(E7 型特异性多重基因分型试验[E7-MPG]),并将其与ddPCR 检测和HPV16 E6 抗体检测进行比较,E7-MPG 检测HPV16 阳性宫颈癌的敏感性高于ddPCR(74.7%vs63.1%;P< 0.001);另外,在此验证试验中还发现E6 抗体主要出现在宫颈癌早期,而HPV-ctDNA 主要出现在肿瘤晚期[24]。新检测技术的出现为推动宫颈癌疾病早期诊断提供了强有力的支持,但检测准确性及特异性的提高依然是难题。
另外,实现利用HPV-ctDNA 检测宫颈癌假定的治疗靶点,制定个性化诊疗方案,探求化疗耐药的分子证据,亦或是在无法通过传统手段诊断的地区进行疾病筛查,则可大大减轻宫颈癌筛查及治疗靶点检测的负担,实现应用统一评价指标完成对HPV 阳性宫颈癌患者全病程的有效管理。
1.5 ctDNA 在HPV 相关性外阴癌及阴道癌在妇科恶性肿瘤中与HPV 感染关系密切的除了宫颈癌,还有外阴癌及阴道癌。据统计,外阴癌有接近四成与HPV 相关,其中,以鳞状细胞癌最为多见,常发生于年轻女性,与性危险因素相关,通常表现为多灶性,与经典的外阴上皮内瘤变相关,可并发下生殖道其他部位的鳞状上皮病变[25]。一项荟萃分析提示,HPV 阳性外阴癌的女性具有更高的生存率[26],这与发病年龄更年轻、病因较为明确以及存在更多可检测到的基因靶点相关。而阴道癌的发生发展与HPV 感染更关系更为密切[4]。
相似的病因,常伴以相似的特点。HPV 相关的恶性肿瘤是HPV-ctDNA 作为生物标志物的特异性模型[27],而HPV 相关妇科恶性肿瘤以其特殊人群类型、发病部位以及组织结构是否也可构成新的疾病模型,以求统一覆盖早期癌症检测、分子分型、治疗期诊疗方案选择、疗效评价、用药指导及随访期预后评估、复发监测的及时且有效的评价指标,更好规范临床诊疗。
2 总结与展望
目前,液体活检中ctDNA 检测已应用于各类实体肿瘤,被非小细胞肺癌、乳腺癌、结直肠癌等的相关诊疗指南纳入,但在妇科肿瘤中的研究仍在起步阶段。而HPV-ctDNA 可作为一把钥匙,优先打开HPV 相关性妇科恶性肿瘤液体活检的大门,逐步完成从预测复发到早诊优治,从单病程到全病程,甚至从某些癌种到全癌种的个体化、规范化管理的跨越。
【Author contributions】JIANG Baoni performed the Searched literature and wrote the article. ZHANG Meiqin performed the Searched literature. YANG Lu and CHEN Zhiyuan revised the article. HAN Nana designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
