沙库巴曲缬沙坦钠片预防多柔比星所致心脏毒性的机制
2024-03-11刘洁琼姚雅俪隋倩李科黄芳曹永清
刘洁琼 姚雅俪 隋倩 李科 黄芳 曹永清
长沙市第一医院(中南大学湘雅医学院附属长沙医院) 1血液肿瘤科,2妇科 (长沙 410005)
多柔比星(DOX)是一种高效的蒽环类化疗药物,用于治疗多种类型的肿瘤,如急性白血病、恶性淋巴瘤和实体瘤[1]。然而,剂量依赖性DOX 诱导的心脏毒性是一种有害的心肌病副作用,导致治疗过早终止,并增加了随后癌症复发的可能性[2-3]。右雷佐生是目前临床用于预防蒽环类心脏毒性的保护制剂,然而在表柔比星的化疗方案中能按照说明书和指南规范正确使用右雷佐生的病例数并不多[4]。鉴于目前除了静脉应用的右雷佐生之外,尚无有效预防蒽环类心脏毒性的保护制剂,有必要探寻新的保护剂为DOX 诱导心脏毒性的临床治疗提供新的选择。沙库巴曲缬沙坦钠片(Entresto)作为一种新的血管紧张素受体-血管紧张素抑制剂,同时具有沙库巴曲和缬沙坦两种药物的特性,可减少心力衰竭患者的心血管事件[5]。ARNI 作为处方口服药,确定Entresto 在DOX 诱导的心脏毒性中的有益作用的分子机制将有助于其在临床中推广应用。研究[6]表明,在DOX 诱导的心脏毒性中,Entresto 可以减少心肌损伤并改善心脏功能。心肌细胞富含线粒体,当DOX 在线粒体基质中累积时,可引起大量ROS 和线粒体功能障碍,最终导致严重的心脏毒性[7]。最近研究[8]证实Entresto 通过调节氧化应激和线粒体功能完整性来保护心肾综合征大鼠的心肌细胞和心脏功能。因此,在这项研究中,我们探讨了在DOX 诱导的心脏毒性小鼠中,Entresto 的心脏保护作用是否涉及氧化应激和线粒体功能障碍调节。
1 材料与方法
1.1 动物和实验设计雄性成年ICR小鼠[6 ~ 8周龄,体质量(22 ± 3)g],购自北京维通利华实验动物技术有限公司,质量证书编号为SCXK(京)-2019-0004。本研究经我院动物伦理委员会批准(批准号:2021080003)。所有小鼠在温度为(23.0 ± 2.0)℃、湿度为(60.0 ± 10.0)%的饲养室中饲养,光照/黑暗周期为12 h。适应性喂养2 周后,将小鼠随机分为3 组(n= 8):对照组、DOX 组和DOX + Entresto 组。动物实验中使用的Entresto 剂量是基于初步实验并结合先前描述其预防心脏毒性功效的研究确定[9]。DOX + Entresto 组小鼠接受连续28 d 口服Entresto治疗,治疗剂量为30 mg/(kg·d)。从Entresto给药的第7 天起,DOX 组和DOX + Entresto 组小鼠每周通过尾静脉注射DOX(5 mg/kg)1 次,连续4 周,累积剂量为20 mg/kg,以诱导亚急性心肌损伤。DOX 剂量的选择是基于初步实验和以前对DOX 诱导的心脏毒性的研究[10]。对照组的小鼠注射相同体积的生理盐水(0.9% NaCl),每周1 次,持续4 周。最后一次注射DOX 后,于次日处死小鼠,取出心脏,计算小鼠心脏指数,公式为心脏重量与体质量比值。
1.2 血清学测定通过市售试剂盒(南京建成生物工程研究所)检测血清中的肌酸磷酸激酶(CK)、肌激酶同工酶(CK-MB)和乳酸脱氢酶(LDH)的活性。
1.3 组织学变化分析将新鲜心脏组织在室温下浸入10%中性缓冲甲醛中超过48 h。在分级乙醇中脱水后,将组织包埋在石蜡中,切成5 μm厚度。切片用H&E 染料试剂盒染色,然后在光学显微镜下检查心脏组织的病理变化。
1.4 超声波心动描记术在VisualSonics Vevo 2100 超声系统(加拿大VisualSonics 公司)上通过M-模式在长轴视图上对小鼠进行超声心动图检查。在至少3 个连续完整的心动周期测量左心室射血分数(LVEF)和左心室缩短分数(LVFS)。
1.5 心肌线粒体的透射电镜检查将来自不同实验组的心脏组织样本切成小块(1 mm3)并在电子显微镜固定缓冲液中固定24 h,然后在1%四氧化锇中固定1 h,并包埋在环氧树脂中。通过HT7800透射电子显微镜(日本Hitachi 公司)获得图像。
1.6 氧化应激检测通过DCFH-DA 染色(南京建成生物工程研究所)评估ROS 产生。将新鲜的心脏冷冻切片或H9c2 细胞在黑暗中用DHE 或DCFH-DA 在37 ℃下染色30 min,然后用荧光显微镜分析。
1.7 TUNEL 染色使用TUNEL 检测试剂盒(荧光法)(上海碧云天公司)对心脏切片和H9c2 细胞进行TUNEL 染色,以检测小鼠心脏组织和细胞的凋亡。使用BX50-FLA 倒置荧光显微镜(日本Olympus 公司)观察凋亡细胞。
1.8 细胞培养和活力测定小鼠心肌细胞(H9c2)获自美国典型培养物保藏中心。H9c2 细胞在含有10% FBS、100 U/mL 青霉素和链霉素的DMEM 中培养。每48 h 更换培养基,直到细胞培养到80% ~ 90%,用于后续实验。
H9c2 细胞在DOX(1 mmol/L)存在或不存在的情况下用Entresto(0 ~ 48 μmol/L)预处理24 h,向细胞中加入20 μL MTT 溶液(美国Sigma 公司)。用Fluoroskan 酶标仪(美国Thermo 公司)在490 nm处检测细胞活力。
1.9 线粒体膜电位检测JC-1 荧光探针(北京Solarbio公司)分析DOX诱导的线粒体膜电位变化。向细胞中加入1 mL JC-1工作溶液,充分混合,孵育20 min。在激光共聚焦显微镜下观察细胞培养基。
1.10 Western blot 检测使用含有蛋白酶和磷酸酶抑制剂的RIPA 裂解缓冲液(上海碧云天公司)匀浆来自细胞和心脏组织的总蛋白样品。用SDS-PAGE(8% ~ 12%)分离蛋白质,然后转移到PVDF 膜上。在室温下用5%脱脂乳封闭2 h 后,将膜与初级抗体在4 ℃下孵育过夜。将膜与HRP 标记的羊抗兔抗体(1∶5 000)在室温下孵育2 h,然后与电化学发光反应1 min(在黑暗中)。用Image lab软件检测和分析膜上蛋白质的灰度值。使用以下抗体:抗SIRT1 抗体(1∶1 000)、抗PGC-1α 抗体(1∶1 000)、抗MFN2 抗体(1∶800)和GAPDH(1∶2 000)(均购自美国Cell Signaling Technology 公司)。
1.11 统计学方法在SPSS 22.0上进行统计分析,所有数据均以平均值±标准差表示。多组间比较采用单向方差分析和Tukey 事后检验。以P< 0.05为差异有统计学意义。
2 结果
2.1 Entresto 改善DOX 诱导的体内心脏毒性与对照组相比,DOX 组心肌细胞内CK、CK-MB 和LDH 的漏出量显著增加(P< 0.01),和心脏指数显著降低(P< 0.01),见表1。Entresto 给药逆转了DOX 组的这些变化。此外,在DOX 组中观察到心肌纤维的广泛变性和碎裂。Entresto 给药可改善上述组织病理学改变,心肌纤维呈现与对照组相似的放射模式(图1)。

图1 Entresto 对DOX 所致亚急性心肌损伤小鼠心肌组织病理学的影响Fig.1 Effect of Entresto on myocardial histopathology in mice with subacute myocardial injury induced by DOX
表1 Entresto 改善DOX 诱导的体内心脏毒性Tab.1 Entresto improves DOX-induced cardiotoxicity in vivo ±s
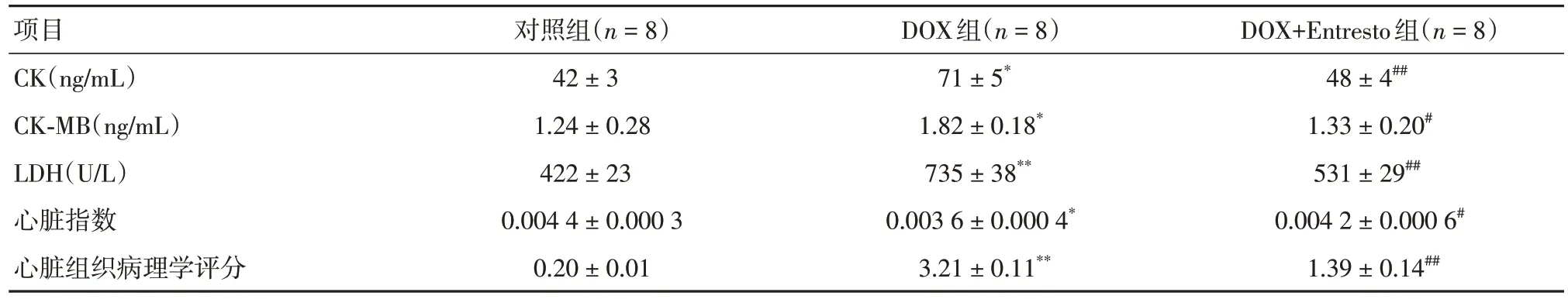
表1 Entresto 改善DOX 诱导的体内心脏毒性Tab.1 Entresto improves DOX-induced cardiotoxicity in vivo ±s
注:与Control组比较,*P < 0.01,**P < 0.001;与DOX组比较,#P < 0.05,##P < 0.01
项目CK(ng/mL)CK-MB(ng/mL)LDH(U/L)心脏指数心脏组织病理学评分对照组(n = 8)42 ± 3 1.24 ± 0.28 422 ± 23 0.004 4 ± 0.000 3 0.20 ± 0.01 DOX组(n = 8)71 ± 5*1.82 ± 0.18*735 ± 38**0.003 6 ± 0.000 4*3.21 ± 0.11**DOX+Entresto组(n = 8)48 ± 4##1.33 ± 0.20#531 ± 29##0.004 2 ± 0.000 6#1.39 ± 0.14##
2.2 Entresto 改善DOX 诱发的心肌功能障碍与对照组相比,DOX 严重影响小鼠左心室收缩功能,其中EF 和FS 显著降低(P< 0.01)。相反,Entresto治疗显著逆转了DOX 诱发的左心室收缩功能障碍(P< 0.05)。DOX 组小鼠的E/A 比值明显低于对照组(P< 0.01)。与DOX 组相比,DOX+Entresto组E/A 比值显著降低(P< 0.05)。见图2、表2。
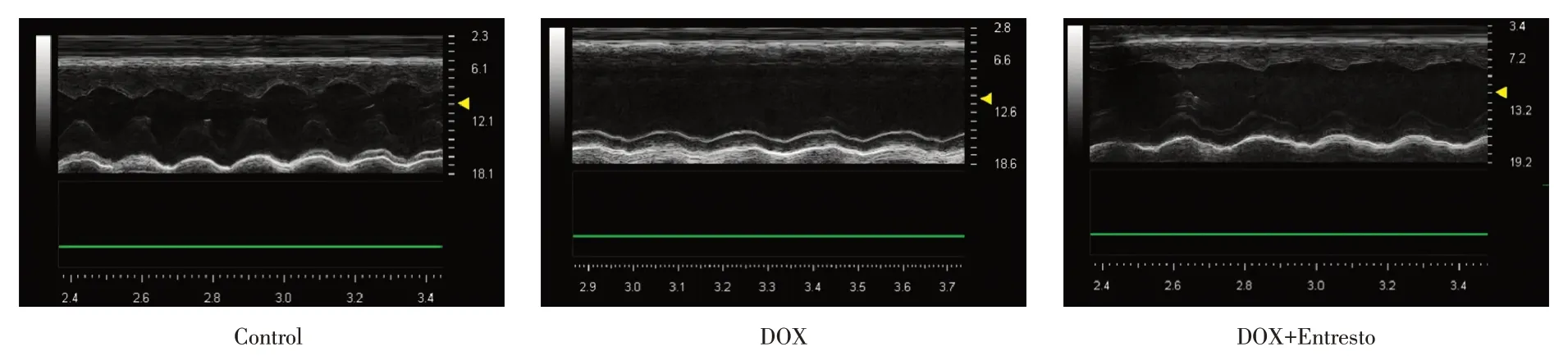
图2 每组获得的代表性M 型超声心动图Fig.2 The representative M-mode echocardiography obtained in each group
表2 Entresto 改善了DOX 诱发的心肌功能障碍Tab.2 Entresto improves myocardial dysfunction induced by DOX ±s
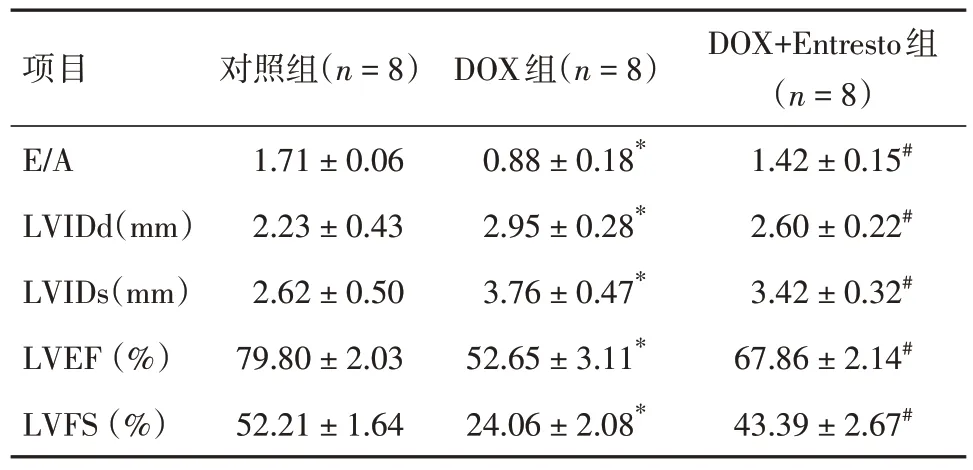
表2 Entresto 改善了DOX 诱发的心肌功能障碍Tab.2 Entresto improves myocardial dysfunction induced by DOX ±s
注:与Control组比较,*P < 0.01;与DOX组比较,#P < 0.05
项目E/A LVIDd(mm)LVIDs(mm)LVEF (%)LVFS (%)对照组(n = 8)1.71 ± 0.06 2.23 ± 0.43 2.62 ± 0.50 79.80 ± 2.03 52.21 ± 1.64 DOX组(n = 8)0.88 ± 0.18*2.95 ± 0.28*3.76 ± 0.47*52.65 ± 3.11*24.06 ± 2.08*DOX+Entresto组(n = 8)1.42 ± 0.15#2.60 ± 0.22#3.42 ± 0.32#67.86 ± 2.14#43.39 ± 2.67#
2.3 Entresto 保护心肌细胞免受DOX 诱导的心肌细胞毒性DOX 刺激的H9c2 细胞存活率明显低于对照组(P< 0.01)。Entresto 预处理可以剂量依赖性地增强心肌细胞的活力,并当Entresto 浓度为12 μmol/L 时达到峰值(P< 0.01)。因此,研究选择12 μmol/L 作为后续研究的Entresto 干预浓度。见表3。
表3 Entresto 对H9c2 细胞活性和DOX 诱导的H9c2 细胞毒性的影响Tab.3 The effect of Entresto on H9c2 cell activity and DOX induced H9c2 cell toxicity ±s

表3 Entresto 对H9c2 细胞活性和DOX 诱导的H9c2 细胞毒性的影响Tab.3 The effect of Entresto on H9c2 cell activity and DOX induced H9c2 cell toxicity ±s
注:与Ctrl组比较,*P < 0.01;与DOX+Entresto (0 μmol/L)组比较,#P<0.05,##P < 0.01
处理方法Entresto (μmol/L)DOX+Entresto (μmol/L)剂量Ctrl 0.75 3 12 48 96 Ctrl 0 0.75 3 12 48细胞活力(%)100 ± 2 102 ± 2 105 ± 3 97 ± 3 88 ± 3 72 ± 2*100 ± 3 70 ± 2*72 ± 2*84 ± 2#90 ± 1##82 ± 1#
2.4 Entresto 保护心肌细胞免受DOX 诱导的氧化应激和线粒体损伤与对照组比较,DOX 组心室组织中的ROS 水平和凋亡细胞数目显著增加(P< 0.001)。DOX+Entresto 组心室组织中的ROS水平和凋亡细胞数目显著低于DOX 组(P< 0.05)。DOX 诱导了小鼠心脏中的线粒体损伤,如线粒体肿胀、嵴缩短和减少以及局灶性空泡的出现。DOX+Entresto 组中的线粒体结构基本完整。见图3、表4。
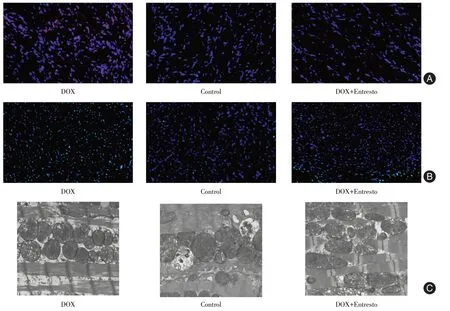
图3 Entresto 保护心肌细胞免受DOX 诱导的氧化应激和线粒体损伤Fig. 3 Entresto protects cardiomyocytes from oxidative stress and mitochondrial damage induced by DOX
表4 ROS 荧光强度和凋亡细胞百分比量化Tab.4 Quantification of ROS fluorescence intensity and percentage of apoptotic cells ±s

表4 ROS 荧光强度和凋亡细胞百分比量化Tab.4 Quantification of ROS fluorescence intensity and percentage of apoptotic cells ±s
注:与Control组比较,*P < 0.001;与DOX组比较,#P < 0.01
项目ROS荧光强度凋亡率 (%)对照组(n=8)22 ± 2 5 ± 1 DOX组(n = 8)65 ± 4*42 ± 3*DOX+Entresto组(n = 8)35 ± 3#16 ± 2#
2.5 Entresto 改善DOX 诱导的H9c2 细胞氧化应激和线粒体损伤与对照组相比,DOX 组H9c2 细胞中ROS 的荧光强度和细胞凋亡数量显著增加(P< 0.001),和线粒体膜电位明显降低(P< 0.001)。与DOX 组相比,Entresto+DOX 组H9c2 细胞中的ROS 水平和凋亡细胞数目显著降低(P< 0.05),和线粒体膜电位显著增加(P< 0.05)。见图4、表5。
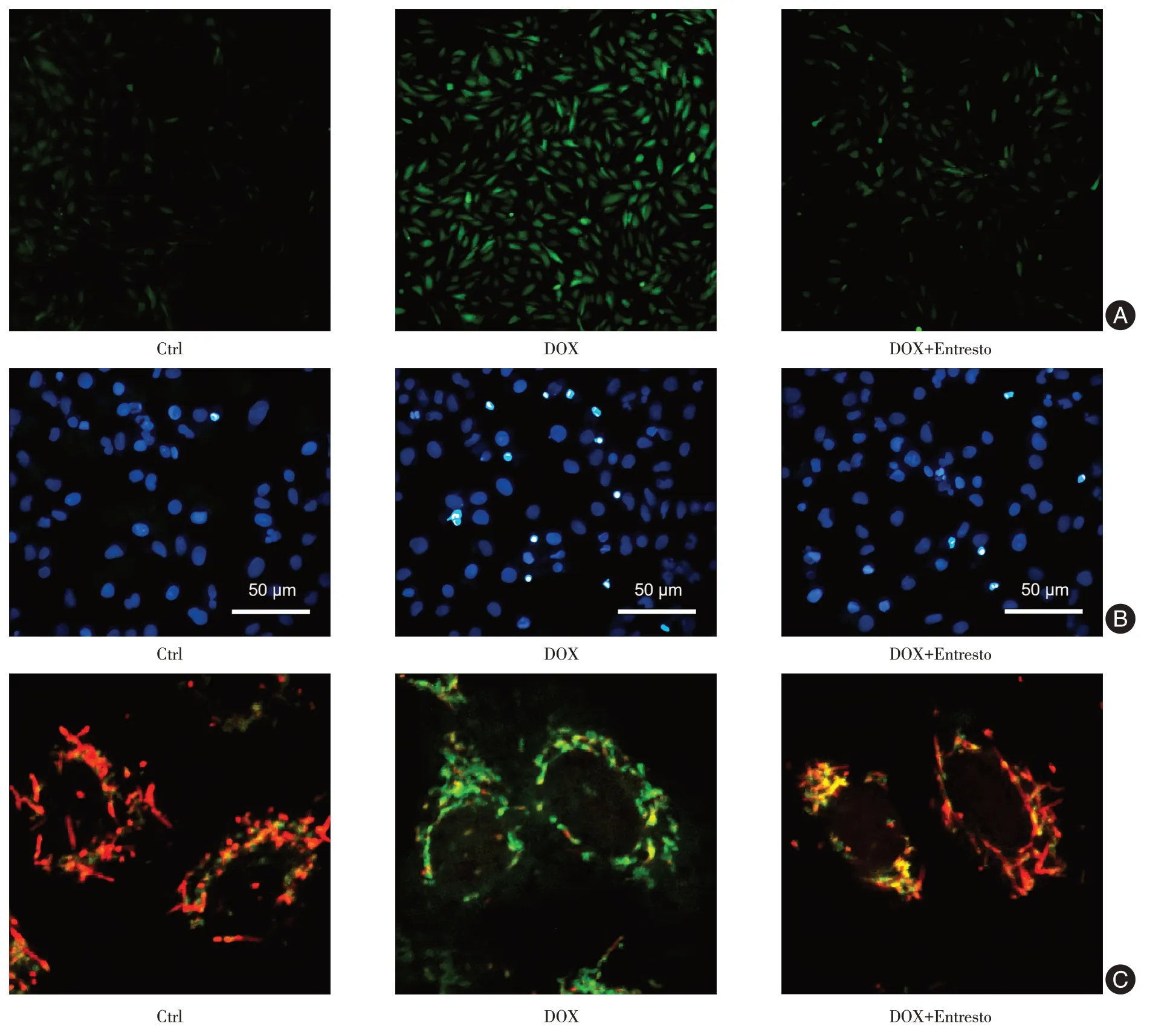
图4 Entresto 改善DOX 诱导的H9c2 细胞氧化应激和线粒体损伤Fig.4 Entresto improves oxidative stress and mitochondrial damage induced by DOX in H9c2 cells
表5 Entresto 改善DOX 诱导的H9c2 细胞氧化应激和线粒体损伤Tab.5 Entresto improves oxidative stress and mitochondrial damage induced by DOX in H9c2 cells ±s
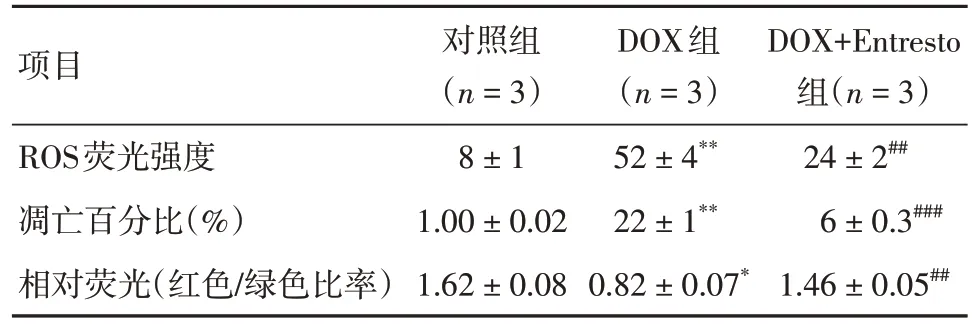
表5 Entresto 改善DOX 诱导的H9c2 细胞氧化应激和线粒体损伤Tab.5 Entresto improves oxidative stress and mitochondrial damage induced by DOX in H9c2 cells ±s
注:对对照组比较,*P < 0.01,**P < 0.001;与DOX 组比较,#P <0.01,##P < 0.001
项目ROS荧光强度凋亡百分比(%)相对荧光(红色/绿色比率)对照组(n = 3)8 ± 1 1.00 ± 0.02 1.62 ± 0.08 DOX组(n = 3)52 ± 4**22 ± 1**0.82 ± 0.07*DOX+Entresto组(n = 3)24 ± 2##6 ± 0.3###1.46 ± 0.05##
2.6 Entresto 激活SIRT1/PGC-1α/MFN2 信号通路DOX+Entresto 组心室组织中的SIRT1、PGC-1α、MFN2 蛋白水平显著高于DOX 组(P< 0.05)。Entresto+DOX组H9c2细胞中SIRT1、PGC-1α、MFN2蛋白水平较DOX 组显著增加(P< 0.05)。见图5、表6-7。

图5 Entresto 激活SIRT1/PGC-1α/MFN2 信号通路Fig. 5 Entresto activates SIRT1/PGC-1α/MFN2 signal pathway
表6 Western blot 检测小鼠心室组织中的SIRT1、PGC-1α、MFN2 蛋白水平Tab.6 Western blot was used to detect the protein levels of SIRT1, PGC-1α and MFN2 in mouse ventricular tissues ±s
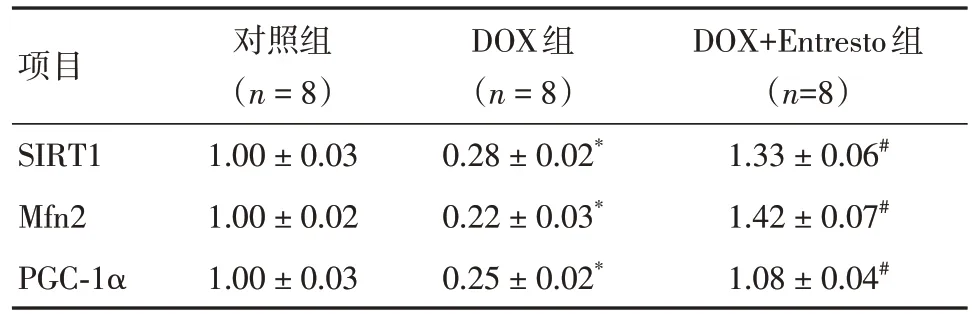
表6 Western blot 检测小鼠心室组织中的SIRT1、PGC-1α、MFN2 蛋白水平Tab.6 Western blot was used to detect the protein levels of SIRT1, PGC-1α and MFN2 in mouse ventricular tissues ±s
注:与对照组比较,*P < 0.001;与DOX组比较,#P < 0.001
项目SIRT1 Mfn2 PGC-1α对照组(n = 8)1.00 ± 0.03 1.00 ± 0.02 1.00 ± 0.03 DOX组(n = 8)0.28 ± 0.02*0.22 ± 0.03*0.25 ± 0.02*DOX+Entresto组(n=8)1.33 ± 0.06#1.42 ± 0.07#1.08 ± 0.04#
表7 Western blot 检测H9c2 细胞中的SIRT1、PGC-1α、MFN2 蛋白水平Tab.7 Western blot was used to detect the protein levels of SIRT1, PGC-1α and MFN2 in H9c2 cells ±s

表7 Western blot 检测H9c2 细胞中的SIRT1、PGC-1α、MFN2 蛋白水平Tab.7 Western blot was used to detect the protein levels of SIRT1, PGC-1α and MFN2 in H9c2 cells ±s
注:与对照组比较,*P < 0.001;与DOX组比较,#P < 0.001
项目SIRT1 Mfn2 PGC-1α对照组(n = 3)1.00 ± 0.03 1.00 ± 0.02 1.00 ± 0.03 DOX组(n = 3)0.14 ± 0.02*0.20 ± 0.03*0.25 ± 0.02*DOX+Entresto组(n = 3)1.56 ± 0.06#1.12 ± 0.07#1.13 ± 0.04#
3 讨论
DOX 化疗不可避免地给肿瘤患者带来一些剂量相关的心脏毒副作用[2-3]。因此,迫切需要寻找有效的药物来预防DOX 引起的心脏毒性。这项研究的主要发现是Entresto 在小鼠模型中保护DOX 诱导的心脏毒性。在最近的研究[11-12]中,已报道Entresto 对心血管系统的潜在保护作用。例如,Entresto 通过激活PI3K/Akt 通路和调节细胞凋亡来保护实验性大鼠心脏免受缺血/再灌注损伤[11]。此外,Entresto 逆转高血压性肥厚型心肌病模型心脏结构和功能[12]。然而,关于Entresto 对抗DOX 诱导的心肌损伤有益作用的报道仍然有限。因此,本研究探索了Entresto 对DOX 诱导的心肌损伤保护作用的潜在分子机制。
DOX 化疗破坏了身体的正常稳态。有报道称,DOX 暴露诱导的心脏毒性可能是心脏膜脂质过氧化增加后的继发性事件,导致心脏毒性相关标志物的泄漏[13]。我们的结果表明,DOX 刺激的小鼠血清中CK、CK-MB、LDH 的释放明显高于对照组。Entresto 预处理减少了这些心肌酶的释放,改善了DOX 诱导的心肌损伤。ROS 产生是触发心肌细胞凋亡的早期事件,可导致心肌细胞凋亡或坏死[14]。本研究表明,DOX 刺激后H9c2 心肌细胞内ROS 积累显著增加,表明氧化应激与DOX 诱导的心脏毒性密切相关。Entresto预处理可降低H9c2心肌细胞ROS 的表达水平。研究[15]发现,DOX 治疗可以显著降低内源性抗氧化酶的活性,导致内源性ROS 的积累,最终导致不同程度的组织或细胞损伤。因此,Entresto 可能通过降低氧化应激来改善DOX 诱导的心肌细胞毒性。
DOX 引起的心脏毒性不仅与过度氧化应激有关,还与细胞凋亡密切相关[16]。维持线粒体稳态的能力对维持心肌细胞的正常功能具有重要作用。在DOX 诱导的心肌病中,线粒体形态、动力学和线粒体能量代谢变得紊乱[17]。DING 等[7]发现,线粒体融合蛋白(MFN2)表达上调通过介导线粒体融合、减少细胞损伤和抑制DOX 心脏毒性来增强线粒体氧化代谢。在本研究中,我们发现DOX 给药后,心室组织中ROS 生成增加,线粒体膜电位去极化,电镜下内外膜结构不完整。这些线粒体变化可能与MFN2 的下调有关。SIRT1/PGC-1α 轴是哺乳动物细胞中线粒体生成的主要信号通路[18]。研究[19]表明,SIRT1 可以调节线粒体稳态以增强线粒体功能,或通过中间因子PGC-1α调节MFN2 表达。在这项研究中,DOX 刺激降低了SIRT1、PGC-1α 和MFN2 的表达;这一结果与之前的研究一致,在这些研究中,DOX 降低了H9c2和新生大鼠心肌细胞中SIRT1 和MFN2 的表达[20]。因此,Entresto 可能通过激活SIRT1/PGC-1α/MFN2信号通路改善DOX 的心脏毒性。
综上所述,本研究表明Entresto 通过抑制ROS介导的氧化应激和凋亡来改善DOX 诱导的心脏毒性,其机制可能与SIRT1/PGC-1α/MFN2 信号转导通路有关。我们的结果表明,Entresto 具有潜在的心脏保护作用,有望成为降低肿瘤化疗心脏毒性的有效药物。
【Author contributions】LIU Jieqiong performed the experiments and wrote the article. LI Ke and SUI Qian performed the experiments.HUANG Fang and CAO Yongqing revised the article.YAO Yali designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
