高同型半胱氨酸经TRPC6/NF-κB诱导肾小球足细胞铁死亡的机制
2024-03-11李小琴汪乐新马小军李娜卢冠军张智涵张鹏程
李小琴 汪乐新 马小军 李娜 卢冠军, 张智涵 张鹏程
1宁夏医科大学总医院泌尿外科 (银川 750004);2宁夏医科大学临床医学院 (银川 750004);3吴忠市人民医院护理部 (宁夏吴忠 751100);4浙江中医药大学附属第三医院 (杭州 310000)
慢性肾脏病(chronic kidney diseases,CKD)是一种以肾功能进行性损害为特征的疾病,已成为全球关注的主要健康问题[1],其具有不可逆、进行性且早期症状不明显等特点,是导致终末期肾病(end-stage renal disease, ESRD)和肾功能衰竭的主要病因之一[2]。同型半胱氨酸(homocysteine,Hcy)是一种源自蛋氨酸代谢而来的含硫氨基酸,主要在肾脏代谢;Hcy 的积累即高同型半胱氨酸血症(high homocysteine,HHcy),被认为是CKD 发生发展的罪魁祸首[3-4]。它主要通过触发氧化应激、内质网应激和炎症反应等方式促进CKD 的发生发展,随时间推移可能导致ESRD[4-5]。课题组前期已证实HHcy 会造成肾损伤[6-7]。但目前为止还没有降低Hcy 的有效策略。因此,明确Hcy 引起肾损伤的致病机制,对预防或治疗与Hcy 相关的ESRD 至关重要。
足细胞是肾脏滤过屏障中独特的终末分化上皮细胞,足细胞功能的丧失被认为是肾小球疾病早期发展的关键因素。近年来,广受关注的瞬时受体电位-6 通道(TRPC6)是一种广泛表达在足细胞的非选择性高通透Ca2+通道[8],越来越多的研究[9-11]证实TRPC6 与肾小球疾病的发病密切相关,TRPC6 是一种重要的足细胞膜蛋白且对维持足细胞的正常生理功能至关重要。据报道[12]称,TRPC6过度激活可导致足细胞和系膜细胞损伤,而氧化应激是导致肾小球细胞中TRPC6 异常开放发生细胞损伤的主要原因;然而,TRPC6 是否参与了Hcy引起肾损伤的发病机制尚不清楚。
铁死亡是一种与铁离子相关的氧化死亡方法,主要以细胞内活性氧(ROS)堆积、过度的氧化反应和膜脂质过氧化反应为特征的非细胞凋亡形式的细胞死亡,它主要受Xc-系统(主要为SLC7A11)以及谷胱甘肽过氧化物酶4(GPX4)的调节[13],SLC7A11 和GPX4 活性降低导致细胞抗氧化能力下降和脂质ROS 积累,进而发生铁死亡[14-15]。很多CKD 患者都存在不同程度的铁代谢和脂质代谢紊乱。考虑到Hcy 对肾脏的损害以及Hcy、TRPC6、铁死亡之间的潜在联系,我们推测TRPC6 和铁死亡可能参与了Hcy 诱导的足细胞损伤。因此,本研究以TRPC6 的分子调控为切入点,从肾小球足细胞铁死亡的视角阐明Hcy 致病机制,为进一步研究CKD 的发生与发展提供了必要的实验基础。
1 材料与方法
1.1 主要试剂和仪器小鼠肾足细胞株(MPC-5)购自中国华拓生物;Hcy 细粉购买于美国Sigma;DMEM 培养基和胎牛血清均购买于美国Gibco 公司;TRPC6、GPX4、SLC7A11 购买于美国Abcam;NFκb 购自中国Affinity;兔二抗购买于中杉金桥;MDA 检测试剂盒购买于南京建成;蛋白质提取试剂盒购自中国凯基生物;总RNA 提取试剂盒购买于北京TianGen;反转录试剂盒、荧光PCR 试剂盒均购自日本TaKaRa;TRPC6 上下游引物由上海生工合成;TRPC6 干扰片段购自上海吉玛公司;Lipofectamine2000 助转剂购于美国invirogen;凋亡检测试剂盒购于美国BD;全自动酶标仪和凝胶化学发光成像分析仪来自美国Bio-Rad;普通 PCR 扩增仪和实时荧光定量PCR 仪购于德国Analytik Jena;电转、电泳仪来自美国,BioRad;流式细胞仪来自美国,BD;激光共聚焦购自美国Zeiss;超净工作台为中国安泰公司;CO2培养箱、微型离心机和高速冷冻离心机购自美国Eppendorf;BS1105 型精密天平购于德国Sartorius 公司。
1.2 细胞干预及分组在 DMEM 培养基中加入10%胎牛血清,将其置于37 ℃、5% CO2浓度的培养箱中,连续2 d 进行传代,计算对数增长并选择第3 - 4 代进行试验。参考相关文献[7],80 μmol/L 的Hcy 浓度为最佳干预浓度。因此,待细胞长到70%时,用80 μmol/L Hcy 干预作为Hcy 组,对照组不作任何处理,待干预达48 h 后采集细胞,进行下一步实验。
1.3 细胞转染与分组参考LipofectamineTM2000说明书转染si-TRPC6 和si-NC 到肾足细胞。在转染前1 d,向6 孔板中每个孔接种2 × 105个细胞,待培养至70%汇合时。 a 液:将250 μL DMEM 与5 μL si-TRPC6 均匀混合。b 液:250 μL DMEM 与6 μL LipofectamineTM2000 均匀混合,放置5 min 后,轻轻混合a、b 液,室温20 min。慢慢地将a/b 混合液添加到培养液中,添加普通的新鲜培养基到3.5 mL,摇动均匀,在37 ℃的温度箱中放置6 ~ 8 h,将转染液吸走,换上普通的培养液,在48 h 后采集细胞,进行下一步实验。
1.4 qRT-PCR 检测TRPC6 基因参考总RNA 试剂盒说明书,逐步提取每一组细胞的总RNA,然后反转录成cDNA。借助NCBI 网站查出鼠源TRPC6和GAPDH 基因序列,引物交给上海生工生物有限公司设计和合成;TRPC6 上游引物:5′-CTGATCCTCAGATCATCTCT-3′;下游引物:5′-GAGTAAAGGTTGAACATTCC-3′;PCR 在以下条件下进行:在95 ℃下30 s,在95 ℃下5 s,在59.2 ℃下34 s,共计45 个循环,每个样品重复3 次。以GAPDH 为内参,采用相对定量法(2-ΔΔCT法)计算TRPC6 的相对表达量。
1.5 Western blot 检测TRPC6、GPX4、SLC7A11、NF-κB 蛋白表达吸弃培养瓶中细胞培养液,用PBS 漂洗细胞2 次,将细胞收集到离心管中,在预冷4 ℃离心机5 000 r/min,离心5 min,吸弃上层液;参考凯基试剂盒说明进行总蛋白质的提取,BCA 方法测定其含量,加入200 mL loading buffer,震荡摇匀,95 ℃沸腾10 min;根据蛋白质分子的大小,用SDS-PAGE 在8%和12%的凝胶上离析,离析开的蛋白质按分子大小裁剪并转移到PVD膜上,用5%的脱脂牛奶在25 ℃下封闭120 min,PBST 液漂洗3次,每次10 min;参考抗体说明书用通用抗体稀释液按1∶1 000 配制TRPC6、GPX4、SLC7A11、NFκb 抗体稀释液,将洗好的 PVD 膜放入一抗孵育盒内,4 ℃冰箱恒温摇床过夜,次日将PVD 膜浸泡于PBST 内清洗3 次,10 min/次;后按1∶5 000 比例配制兔二抗稀释液,25 ℃摇床孵120 min。后PBST 漂洗3 次,10 min/次。在避光情况下,使用ECL 发光A 液、B 液按1∶1 配制,将膜浸泡于发光液内10 s 后,通过凝胶成像系统可视化蛋白质条带。使用Image Lab 对蛋白条带进行半定量,以β-action 作为内参对照。
1.6 免疫荧光检测TRPC6 蛋白表达将状态良好的肾足细胞培养于20 mm 激光共聚焦培养皿内,Hcy 刺激48 h 后自培养箱内取出;吸去培养基,用4 ℃ PBS 清洗细胞,室温摇床慢摇5 min,共3 次,弃PBS;用体积分数4%多聚甲醛固定两组细胞0.5 h,PBS 摇床慢摇3 次,每次5 min,吸去PBS;每个培养皿加入100 μL 山羊血清,室温封闭30 min;吸去山羊血清,加入相对的TRPC6 一抗抗体(1∶400),在4 ℃条件下避光孵育12 h 后取出,室温条件下放置0.5 h,PBS 清洗3 次,每次5 min,在避光条件下,每个皿加入100 μL荧光二抗(1∶100),37 ℃孵育1 h后PBS清洗;避光条件下,加入100 μL DAPI 染核5 min 后PBS 漂洗;后每个皿滴入100 μL防荧光淬灭剂封固,把染色后的细胞放于暗盒内,在激光共聚焦显微镜下将细胞调至视野范围内进行观察照相。
1.7 细胞流式术检测细胞凋亡水平胰酶消化采集足细胞,制备细胞悬液,用PBS 清洗2 次,每次5 min,12 000 r/min 离心5 min,用500 μL 1×Annexinv 结合细胞悬液,加入5 μL Annexinv-FITC和PI 染色并标记单染管,双染管,空白管,在单染管只加PI,双染管加Annexinv-FITC 和PI,空白对照管不加,放置20 min 后在流式细胞仪上测定细胞凋亡水平。设置双参数散点图(PI:纵坐标,Annexinv-FITC:横坐标),划分4 个部分,即左上方为机械性损伤细胞率,而右上方为凋亡较晚的细胞率;左下方为正常活体细胞率,右下方为凋亡较早的细胞,以右上方细胞比率+右下方细胞比率计算细胞凋亡率。
1.8 MDA 检测采集各组细胞的上清液,标记,14 000 r/min 离心5 min,取上层液,严格参考MDA试剂盒说明书测定各组细胞中MDA 含量。
1.9 统计学方法使用prism 9.0 软件进行数据的统计分析,计量数据显示为均数±标准差,使用独立样本t检验分析两组细胞间的差异,使用单因素方差分析(One-way analysis of variance,ANOVA)分析多组细胞间的差异。当P< 0.05 为差异有统计学意义。
2 结果
2.1 高同型半胱氨酸诱导肾小球足细胞铁死亡同Control 组比较,Hcy 组GPX4、SLC7A11 表达水平均降低(P< 0.05),同时Hcy 组凋亡率增加、MDA 表达水平增高,两组比较均差异有统计学意义(P< 0.05)。综合分析,Hcy 可引起氧化自由基的累积,是足细胞发生铁死亡的重要依据之一(图1 和表1)。
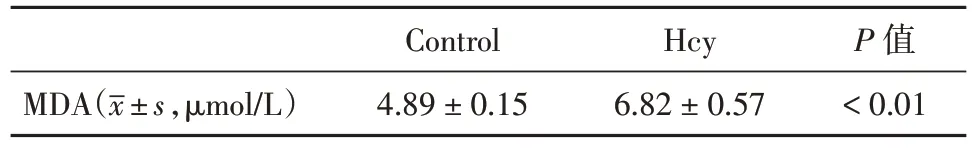
表1 两组间MDA 水平的比较Tab.1 Comparison of MDA levels between the two groups
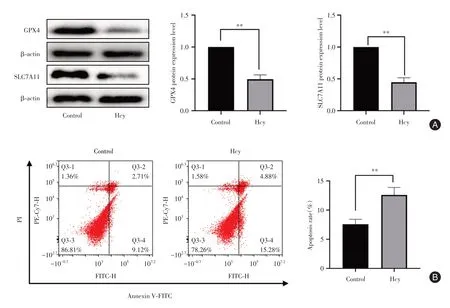
图1 高同型半胱氨酸致足细胞铁死亡Fig.1 High homocysteine induced iron death in podocytes
2.2 高同型半胱氨酸诱导了肾小球足细胞中TRPC6及NFκb的表达同Control组对比,足细胞中的TRPC6蛋白及mRNA表达量均升高(P< 0.05);Western blot 结果表明,与对照组相比,NF-κb 信号通路蛋白表达增加(P< 0.05)。上述结果提示:Hcy 上调了TRPC6 及NF-κb 的表达(图2)。
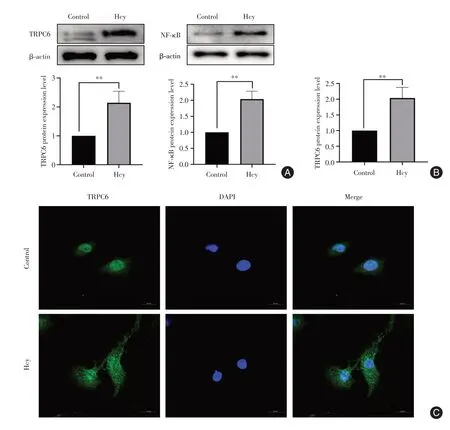
图2 Hcy 上调TRPC6 及NF-κB 的表达Fig.2 Homocysteine increasing the expression of TRPC6 and NF-κB
2.3 转染TRPC6 干扰片段后TRPC6 mRNA 表达情况为进一步研究TRPC6 在肾小球足细胞铁死亡中的作用,将TRPC6 干扰片段及TRPC6 NC 转染后分组为Control、si-NC及si-TRPC6(si-TRPC6-1、si-TRPC6-2、si-TRPC6-3)组,通过qRT-PCR 检测TRPC6 mRNA 表达量,结果提示:与Control 组比较,si-NC 的TRPC6 mRNA 表达没有差异;与si-NC组相对比,si-TRPC6(si-TRPC6-1、si-TRPC6-2、si-TRPC6-3)组中TRPC6 的mRNA 表达水平降低,其中si-TRPC6-3 干扰效果最强(P< 0.05),后续则选择si-TRPC6-3 干扰片段用于实验,这也提示干扰TRPC6 的模型构建成功(图3)。
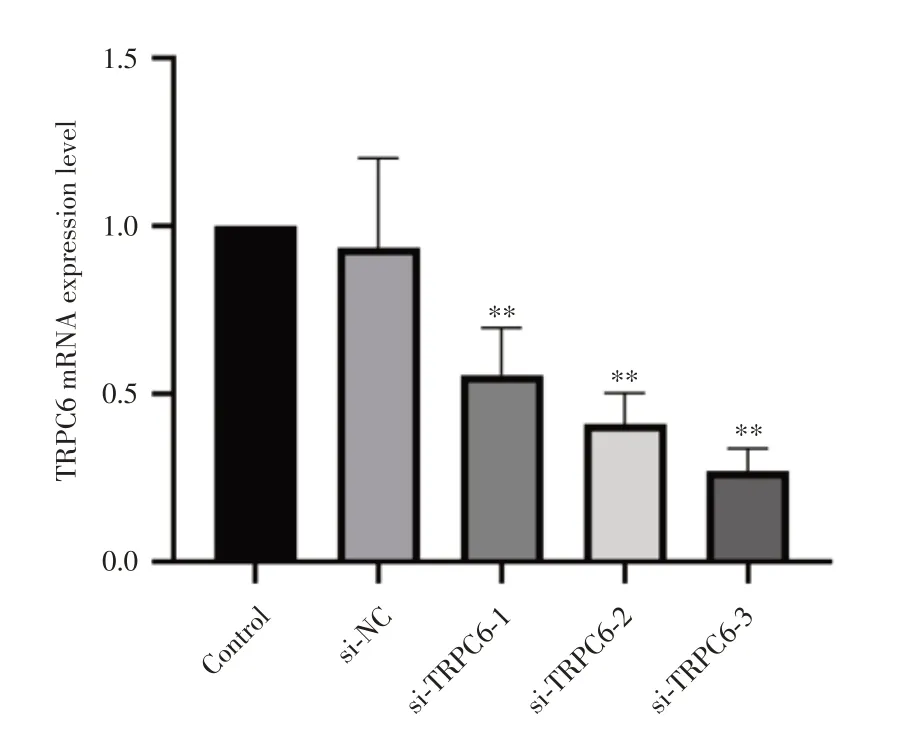
图3 转染干扰TRPC6 后TRPC6 mRNA 的表达Fig.3 Expression of TRPC6 mRNA after transfection interferes with TRPC6
2.4 转染TRPC6 干扰片段后铁死亡相关蛋白、TRPC6 及NF-κb 的表达情况为了揭示TRPC6/NF-κb 是否参与Hcy 诱导足细胞发生铁死亡的过程,细胞转染TRPC6 干扰片段及TRPC6 NC 后给予Hcy 干预,Western blot 分组为Control、Hcy、si-NC+Hcy、si-TRPC6+Hcy,采用Western blot 检测铁死亡相关蛋白、TRPC6及NF-κb的表达,结果提示:与Hcy组相比,si-NC+Hcy 组的GPX4、ALC7A11、TRPC6以及NF-κB 表达均无差异;与si-NC+Hcy 组相对比,si-TRPC6+Hcy 组中铁死亡相关蛋白:GPX4、ALC7A11 表达增加(P< 0.05);TRPC6 及NF-κb 蛋白表达减低(P< 0.05);流式细胞术检测转染干扰TRPC6 后细胞凋亡水平,结果提示:与Hcy 组对比,si-NC+Hcy 组中凋亡率无明显差异;与si-NC+Hcy 组相比,si-TRPC6+Hcy 组中凋亡水平有所下降(P< 0.05),提示TRPC6/NF-κb 参与了Hcy 诱导肾足细胞发生铁死亡的过程(图4)。
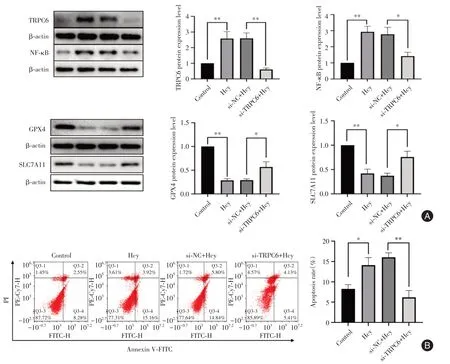
图4 TRPC6/NF-κB 参与了Hcy 诱导的肾小球足细胞铁死亡Fig.4 TRPC6/NF-κB is involved in Hcy induced renal podocyte iron death
3 讨论
肾功能的损害已影响了全世界超过10%的人口,大多数肾脏疾病的特征是肾小球滤过屏障的破坏。而足细胞是构成肾脏滤过屏障的主要部分,其受损破坏了肾小球滤过屏障的完整性,进而引起蛋白尿和肾脏损害。HHcy 已被认为是ESRD进展和与ESRD 相关的心血管并发症发展的独立危险因素[3-4]。有研究[16]报道,在ESRD 患者中,发生HHcy 的概率高达85% ~ 100%。课题组前期已经证实HHcy 会造成肾小球足细胞损伤[6-7],但Hcy在肾脏疾病中的复杂机制尚未被完全阐明。因此,本研究旨在探讨Hcy 诱导肾小球足细胞的损伤机制并寻求新的治疗靶点来缓解肾脏疾病的进展。
HHcy 最初被报道为动脉粥样硬化的危险因素[17]。后来,大量的流行病学和临床病例对照研究[18-19]发现血浆Hcy 水平与心血管疾病之间存在显著的正相关关系。有学者回顾此类研究发现肾脏病患者血清肌酐和Hcy 浓度之间也存在明显的正相关[20]。虽然很多证据提示HHcy 与CKD 致病机制密切相关,但是其在CKD 发生和发展中的作用总是缺少令人信服的证据。研究[21]显示,HHcy可以直接作用于肾小球细胞,引起肾小球功能障碍,进而导致ESRD,并且氧化应激、内质网应激、炎症等参与了Hcy 引起肾损害的过程,特别是氧化应激越来越受到关注。已有研究[22]提示Hcy 主要通过触发局部组织或细胞中的氧化应激来参与足细胞的自噬与凋亡,但Hcy 诱导足细胞铁死亡的方式至今未见相关报道。铁死亡是一种铁离子依赖性的氧化死亡方式,主要以细胞内ROS 堆积,过度的氧化反应和膜脂质过氧化反应为特征的非细胞凋亡形式的细胞死亡。目前研究表明,铁死亡主要受Xc-系统以及谷胱甘肽过氧化物酶4(GPX4)调节[23]。其发生的主要原因是谷胱甘肽(GSH)合成减少以及GPX4 活性被抑制。GSH 是GPX4 发挥活性的关键辅助因子,而半胱氨酸是GSH 合成的重要原料,主要来源于Hcy 代谢。如果GPX4 的表达下调,细胞对铁死亡更敏感;而GPX4 的功能活性与Hcy 代谢密切相关。本实验采用80 μmol/L Hcy 刺激肾小球足细胞48 h 后,检测发现SLC7A11、GPX4 表达下调,这提示Hcy 可以引起足细胞发生铁死亡。而MDA 是脂质的最终过氧化产物,它的表达量能够反映机体内ROS的含量,是机体氧化应激损伤的一个重要指标。于是我们通过检测两组间MDA 水平发现Hcy 组MDA 水平较对照组明显增加。这些实验结果表明Hcy 可能通过触发氧化应激引起ROS 累积,进而诱导足细胞发生铁死亡。
TRPC6 是一种Ca2+渗透性阳离子通道,它是构成肾脏足细胞裂隙膜结构的重要蛋白之一,并且在维持肾小球基底膜正常滤过功能中发挥重要作用[8]。该通道已被证明是肾脏疾病期间足细胞消耗的主要参与者[24-26]。REISER 等[25]研究表明,TRPC6 在遗传性肾小球硬化、微小病变及膜性肾脏疾病中的表达明显升高。另有报道[26]称TRPC6高表达导致大鼠足细胞损伤及蛋白尿增加。以上证据表明TRPC6 在足细胞损伤中起着关键作用。因此抑制TRPC6 的表达水平可能会成为未来有效保护足细胞的重要方法。然而,TRPC6 在Hcy 致足细胞铁死亡中的作用及机制目前尚不清楚。据研究[27]发现,TRPC6 是一个氧化还原敏感通道,它是ROS 致肾脏损害的新靶点[28],其作用机制与Ca2+内流引起肾功能损害密切相关。在动物模型和人类受试者中,ROS 的过量产生和TRPC6 通道的功能障碍都与肾损伤有关[28-30]。有文献报道TRPC6 敲低后,ROS 和细胞内Ca2+水平均降低,且可减少肾性蛋白尿[29];且越来越多的证据表明,TRPC6 在足细胞中的表达和功能受到ROS 的控制[29-30]。笔者推测TRPC6 可能参与了Hcy 诱导足细胞发生铁死亡的过程,为验证这一假说,本研究检测了 TRPC6 在Control 组和Hcy 组的表达,发现与Control 组比较,Hcy 组TRPC6 蛋白及mRNA 呈现高表达,提示Hcy上调了TRPC6的表达。进而我们通过Xc-系统-GPX4轴探讨TRPC6 在Hcy 诱导肾小球足细胞发生铁死亡的作用机制,本实验构建了3 个TRPC6 的干扰片段并转染足细胞,我们选择了干扰效率最好的si-TRPC6-3 进行下一步实验;在Hcy 刺激的同时加入TRPC6 干扰片段,Western blot 结果显示si-TRPC6+Hcy 组较si-NC+Hcy 组比较,铁死亡相关蛋白SLC7A11 和GPX4 表达增加,凋亡率下降,而与Hcy 组比较,转染阴性对照组对诱导的足细胞凋亡率及铁死亡相关蛋白无明显影响。以上研究提示,干预TRPC6 可减轻Hcy 引起的足细胞铁死亡。此外,NFκB 是机体炎性反应的关键信号通路,有文献[31]报道TRPC6可调节NF-κB 信号来增强星形胶质细胞的凋亡;另有学者[32]报道了NF-κB 可能参与了肾损伤。故我们检测了Hcy 组NF-κB 蛋白的表达,结果提示,较对照组相比,Hcy 组NF-κB 蛋白表达增加;干扰TRPC6 后NF-κB 表达降低,表明在Hcy 诱导足细胞发生铁死亡的过程中,TRPC6 可能具有调控NF-κB 的作用。MA 等人[28]通过系统性综述TRPC6 在糖尿病肾病中足细胞损伤的作用时,也证实了这一结果;他发现线粒体ROS 能增加NFκB 的活化,NF-κB 可促进TRPC6 的表达,而TRPC6 升高则又加剧Ca2+超载,正反馈性加重肾小球足细胞的损伤。
综上所述,本研究首次证实了Hcy 可能通过触发氧化应激诱导肾小球足细胞发生铁死亡,并证明了TRPC6/NF-κB 参与了Hcy 诱导肾小球足细胞铁死亡这一过程。这些发现可能为临床防治Hcy 导致的肾脏损伤提供新的药物作用靶点和新的治疗思路,并有助于我们进一步阐明CKD 的发病机制。另外,ROS 调控TRPC6 介导的Ca2+信号仍需进一步的研究来确定潜在的分子机制,希望ROS/TRPC6 通路将为CKD 的治疗提供新的治疗策略。
【Author contributions】LI Xiaoqin made experimental operation,data collation , statistical analysis and paper writing. WANG Lexing made study guidance and paper revision. MA Xiaojun and LI Na made proofreading of data and articles. LU Guanjun, ZHANG Zhihan and ZHANG Pengcheng designed the project. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
