WD重复域蛋白5在宫颈癌组织中的表达及其与患者临床病理特征的关系
2024-03-11魏丕喜邓玉赵彩玲徐柳张敏
魏丕喜 邓玉 赵彩玲 徐柳 张敏
山东第一医科大学附属人民医院(济南 271199)
宫颈癌(cervical cancer, CA)以侵袭性细胞生长和转移为特征,发病率逐年上升[1]。在过去的几十年里,得益于HPV 疫苗接种和筛查策略的结合,CA 的发病率和病死率在世界大部分地区都有所下降[2-3]。但是,由于肿瘤转移、复发,晚期CA的生存率仍然很低[4-5]。因此,研究CA 发生发展的分子机制,可靠有效的分子标志物,以及更有效的方法来阻碍和控制肿瘤细胞的转移和增殖,促进肿瘤细胞的凋亡是至关重要的。WD40 重复结构域蛋白在人类蛋白质组中广泛表达,并在信号转导、转录调控、DNA 损伤感知与修复、细胞凋亡、细胞生长与分裂、表观遗传调控、免疫调控以及不同疾病的发生与维持等多种生物活动中发挥着重要作用[6]。WD 重复域蛋白5(WD repeat-containing protein 5,WDR5)是WD40 蛋白家族的成员,不仅在脊椎动物的发育中起着重要作用,而且在多器官肿瘤的发生和发展中也起着重要作用[7]。但WDR5 在CA 进展中的机制尚不明确。本研究通过对CA 组织中WDR5 水平的测定,探讨其与临床病理特征的关系,为CA 临床中的研究提供新的方向。
1 资料与方法
1.1 研究对象纳入2018 年1 月至2020 年3 月山东第一医科大学附属人民医院接收的CA 患者(105 例)为研究对象,收集新鲜CA 组织标本和非癌症的邻近宫颈组织样本(距离肿瘤边缘> 5 cm),并由有经验的妇科病理学家诊断。所有临床病理诊断均由两名病理学家根据世界卫生组织(WHO)分类指南确认。纳入标准:(1)均经病理学检查确诊;(2)术前所有入组患者均未接受化疗或放疗;(3)患者均知情、同意。排除标准:(1)有子宫切除史、放疗或化疗史、免疫抑制剂史或其他肿瘤史;(2)严重的系统性疾病或精神疾病的患者;(3)临床病历不完整的;(4)妊娠期或哺乳期患者。本研究经医院伦理委员会审核(编号:JN2018091)。
1.2 方法
1.2.1 免疫组织化学染色检测WDR5表达CA组织切片在85 °C 的烤箱中水平和垂直烘烤60 min,然后脱蜡、脱苯、水化。抗原提取后,用磷酸盐缓冲盐水(phosphate-buffered saline, PBS)清洗3 次,在3%的H2O2溶液中孵化以淬灭内源性过氧化物酶活性后,将样品与正常山羊血清孵化20 min,在室温下阻断非特异性结合。随后,将样品与WDR5抗体(货号:CSB-PA097823,武汉益普生物科技有限公司)在4 ℃下孵育过夜。用PBS 清洗后,将样品与二抗在室温下孵育30 min,用3,3-二氨基盐酸联苯胺(DAB)和苏木精进行染色。最后,用盖玻片覆盖进行显微镜观察。
由两位经验丰富的病理学家使用显微镜在随机选择的5 个代表性区域进行观察。评分标准是基于染色强度和被染色细胞的百分比。表达分数按照以下公式计算:染色细胞的百分比分数(0,无染色;1,< 25 个阳性染色细胞;2,25% ~ 50%的阳性染色细胞;3,> 50%的阳性染色细胞)×染色强度得分(0,无染色;1,微弱;2,中等;3,强烈)。表达分数被分为阴性(0-2)或阳性(≥ 2)。最终得分是上述两个指标的乘积。总分< 4 为阴性,总分在4 ~ 9 为阳性。
1.2.2 Western blot法检测组织中WDR5水平使用组织蛋白提取试剂提取蛋白质。蛋白浓度采用试剂盒(北京索莱宝科技有限公司,货号:PC0020)测定。蛋白质经10% SDS-PAGE 凝胶分离并电转到聚偏二氟乙烯膜上。膜在室温下用5%的脱脂牛奶阻断2 h,然后在4 ℃下用一级抗体孵育过夜:抗WDR5(1∶1 000,货号:600-401-FY0,艾美捷科技有限公司),抗GAPDH(1∶1 000,货号:ab8245,深圳海思安生物技术有限公司)。然后将膜与辣根过氧化物酶(HRP)结合的二抗(货号:ZB-2301,南京赛泓瑞生物科技有限公司)在室温下孵育1 h,蛋白质用ECL 化学发光法进行可视化,并用Image J进行量化。GAPDH被用作内部对照,WDR5相对水平=目的蛋白/内参灰度值。
1.3 预后随访患者均于治疗后随访36 个月。第1 次随访在治疗后1 个月进行,然后每3 个月进行1 次电话或门诊联系。记录并计算患者的总生存率。
1.4 统计学方法使用IBM SPSS Statistics 22.0 进行统计分析。计数资料采用例(%)表示,采用χ2检验进行分析;计量资料以(±s)表示,两组之间的统计学显著性通过t检验;生存分析采用Kaplan-Meier 法;患者预后影响因素通过Cox 回归进行分析。P< 0.05为差异有统计学意义。
2 结果
2.1 数据库分析利用GEPIA 数据库进行验证,发现WDR5 在CA 组织中表达升高(P< 0.05),见图1A。WDR5 阳性表达患者的总生存期与阴性表达比较差异无统计学意义(P> 0.05)。见图1B。

图1 数据库分析CA 中WDR5 的表达及与总生存时间的关系Fig.1 Database analysis of WDR5 expression in cervical cancer and its relationship with overall survival time
2.2 CA 组织及癌旁组织WDR5 阳性表达率比较105 例CA 组织标本中,WDR5 的阳性表达率(WDR5 阳性例数/癌组织总例数)为68.57%(72/105)高于癌旁组织22.86%(24/105),差异有统计学意义(χ2= 44.211,P< 0.05),见图2。

图2 WDR5 在CA 组织及癌旁组织中的表达(过氧化物酶-抗过氧化物酶法,× 400)Fig.2 Expression of WDR5 in cervical and paracancer tissues (peroxide-antiperoxidase method × 400)
2.3 CA 组织及癌旁组织中WDR5 表达水平比较相较于癌旁组织(1.00 ± 0.11),WDR5 的表达量在CA 组织(4.66 ± 0.98)中较高,差异有统计学意义(t =38.030,P< 0.05)。见图3。

图3 WDR5 在CA 及癌旁组织中的表达Fig.3 The expression of WDR5 in CA and adjacent tissues
2.4 临床病理特征WDR5 表达量与分化程度、TNM 分期、淋巴结转移有关(P< 0.05),见表1。
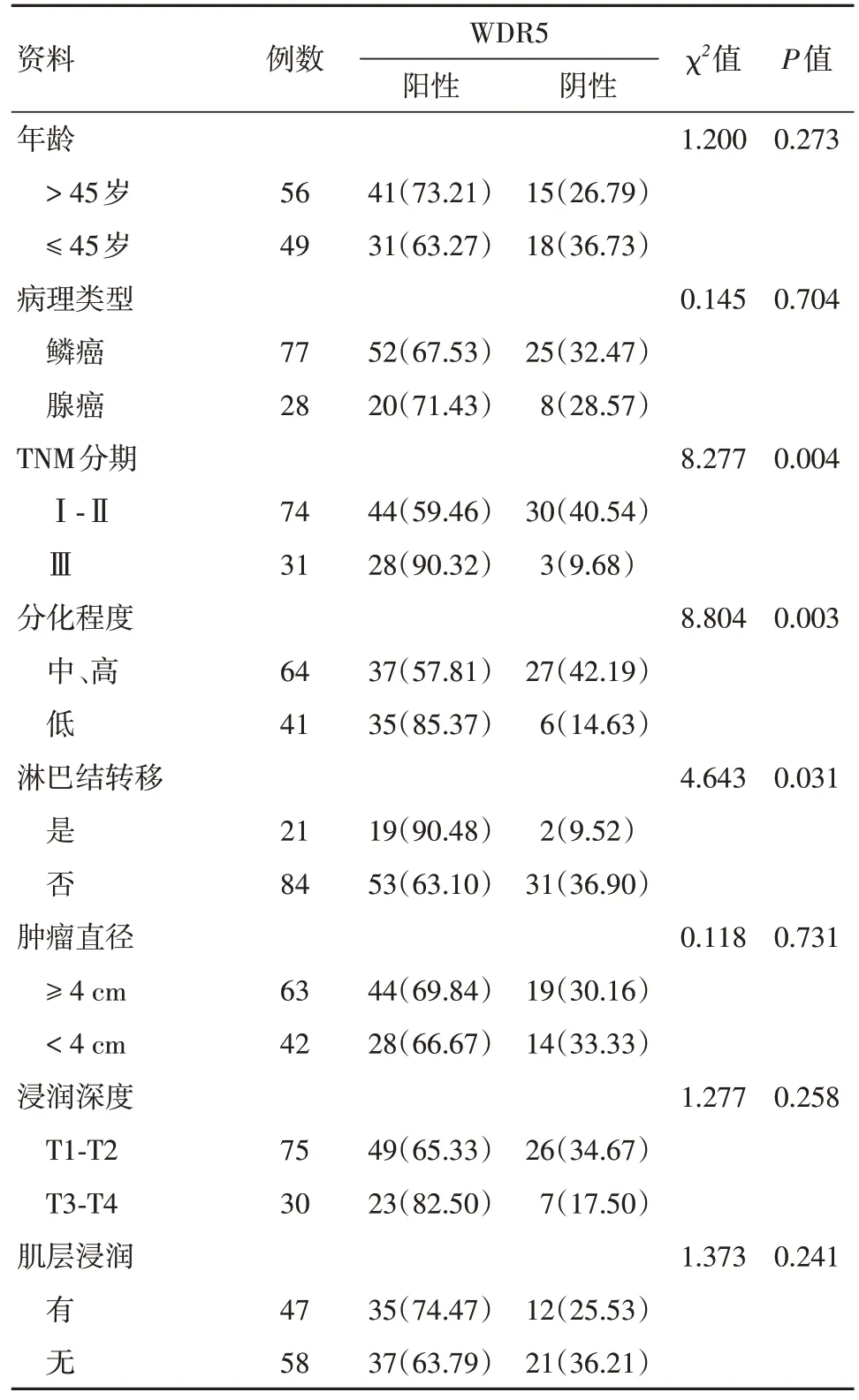
表1 临床病理特征Tab.1 Clinicopathological characteristics 例(%)
2.5 生存分析CA 患者3 年随访期间死亡28 例,无失访病例。WDR5 阳性表达的生存率65.28%(47/72)低于阴性表达90.91%(30/33),差异有统计学意义(Log rank χ2= 6.732,P= 0.009)。见图4。
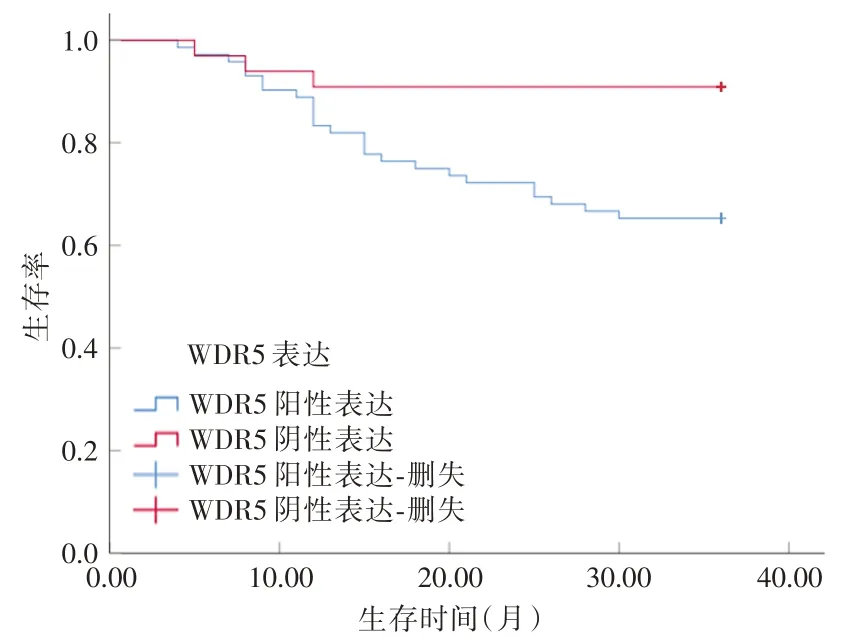
图4 CA 组织中WDR5 阳性表达与阴性表达患者的生存曲线Fig.4 Survival curves of patients with positive and negative WDR5 expression in cervical cancer tissues
2.6 Cox 回归分析经多因素Cox 回归分析,TNM 分期、WDR5、分化程度、淋巴结转移均是患者预后的影响因素(P<0.05),见表2。

表2 Cox 回归分析Tab.2 Cox regression analysis
3 讨论
CA 发病率仅次于乳腺癌、结直肠癌、肺癌[8]。据世界卫生组织不完全统计,CA 全球每年有超过50 万例新发病例,每年造成约30 万例死亡,其中85%发生在发展中国家,且发病率逐年增加,发病年龄逐年降低,严重影响妇女的生存质量[9-11]。CA 的发生由社会因素、遗传易感性因素、生理因素、生物学因素等多种因素共同引起的,是一个多阶段、多步骤的复杂过程[12-13]。目前,手术联合放化疗是CA 治疗的重要手段,但术后复发仍是CA患者预后不良的重要原因[14-16]。肿瘤细胞的局部侵袭和转移是肿瘤进展的重要途径。然而,目前临床对肿瘤侵袭转移机制的认识仍十分有限,进一步阐明肿瘤细胞的靶向调控机制将为CA 的治疗提供新的方向[17]。因此,寻找与其关系密切的生物标志物十分重要。
WDR5 是组蛋白甲基转移酶复合物SET1/MLL的一个重要组成部分,它主要催化组蛋白3 赖氨酸4 甲基化。组蛋白3 赖氨酸4 甲基化是最重要的表观遗传修饰之一,其主要功能是增强底物的转录和表达[18]。WDR5 已被发现在胰腺导管腺癌、肺腺癌、前列腺癌、膀胱癌、胆管癌、乳腺癌等多种实体肿瘤中过表达,促进肿瘤发生[19-22]。此外,更多的证据表明,WDR5 除了调节组蛋白3 赖氨酸4 甲基化外,还可以促进基因转录,例如与原癌基因(C-myc)结合从而调节转录[23]。C-myc 是一种众所周知的肿瘤驱动癌蛋白,在超过一半的人类恶性肿瘤中过表达。据估计,多达1/3 的癌症死亡归因于异常的c-Myc 表达,包括CA[24]。研究[25]显示,WDR5 通过与c-Myc 的直接相互作用增强c-Myc 在染色体上的招募,从而促进了胆管癌的上皮-间充质转化和转移。因此,推测WDR5 在CA 的发展过程中也扮演重要角色。
与既往研究结果一致[26],本研究中WDR5 水平在CA 组织中较高。且其与TNM 分期、淋巴结转移、分化程度有关,上述结果表明,WDR5 在CA中显示出促进肿瘤的作用,WDR5 在细胞增殖、肿瘤发生和恶性进展中起着重要作用,提示WDR5可作为重要的癌基因和新的CA 生物标志物。推测其作用机制可能是WDR5 通过与c-Myc 互相作用,促进CA 细胞的增殖、转移等,从而影响CA 的发展进程,但其在CA 疾病中的具体作用机制尚需进一步完善实验方案进行深入研究。WDR5 阳性表达的3 年生存率较低,这一观察结果表明,WDR5 可能是CA 患者有希望的预后生物标志物,控制WDR5 表达可能是CA 治疗的一个有前途的靶点。本研究中TNM 分期、WDR5、分化程度、淋巴结转移均是患者预后的影响因素,进一步证明WDR5 作为癌基因发挥作用,影响肿瘤患者的预后和生存。因此,它可以作为癌症患者精准治疗的潜在靶点。这些数据也表明WDR5 是一种新的CA 预后生物标志物。
综上所述,WDR5 在CA 组织中的表达高于邻近正常组织,WDR5 的上调与某些临床特征和较差的生存率相关。总之,本研究结果表明,WDR5在CA 中充当致癌基因,因此有可能作为诊断和预后的生物标志物以及治疗靶点。但本次研究样本量有限,且为单中心研究。未来,将开展分子及细胞研究,全面分析WDR5 在CA 中的作用机制,进一步探索和明确其作用机制。
【Author contributions】WEI Pixi performed the experiments and wrote the article. DENG Yu performed the experiments. ZHAO Cailing and XU Liu revised the article. ZHANG Min designed the study and reviewed the article. All authors read and approved the final manuscript as submitted.
【Conflict of interest】The authors declare no conflict of interest.
