三种地宝兰属植物叶片解剖结构及光合特性的比较研究
2024-03-10许爱祝江海都浦乾琨韦霄韦宇静罗亚进柴胜丰
许爱祝 江海都 浦乾琨 韦霄 韦宇静 罗亚进 柴胜丰
摘 要: 為探讨地宝兰属植物的叶片解剖结构及光合特性,该研究对狭域濒危种贵州地宝兰(Geodorum eulophioides)及广布种地宝兰(G. densiflorum)、大花地宝兰(G. attenuatum)的叶片解剖结构、光合日变化、光响应曲线、CO2响应曲线、叶绿素含量等指标进行测定。结果表明:(1)3种地宝兰属植物的叶肉细胞没有海绵组织和栅栏组织分化,气孔仅分布于下表皮;与地宝兰和贵州地宝兰相比,大花地宝兰具有更大的叶片厚度和较小的气孔密度,表现出更适应弱光环境的结构特征。(2)3种地宝兰属植物的净光合速率(Pn)日变化均呈“双峰型”曲线,其光合“午休”主要由非气孔限制引起;Pn和水分利用效率(WUE)日均值大小均表现为大花地宝兰>地宝兰>贵州地宝兰,表明贵州地宝兰积累光合产物的能力更弱,对干旱环境的适应能力可能更差。(3)3种地宝兰属植物均为阴生植物,地宝兰的光补偿点(LCP)最小、光饱和点(LSP)最大,对光强适应范围较宽;大花地宝兰具有较高的最大净光合速率(Pmax)和表观量子效率(AQY),其光合能力较强;贵州地宝兰的Pmax和潜在最大净光合速率(Amax)最小,其光合能力和对CO2的利用能力更弱。(4)地宝兰和大花地宝兰的叶绿素a(Chl a)、叶绿素b(Chl b)和总叶绿素(Chl)含量均显著(P<0.05)高于贵州地宝兰。(5)3种地宝兰属植物的叶片厚度、叶肉厚度、叶绿素含量与Pmax间存在显著(P<0.05)相关性。综上认为,与地宝兰和大花地宝兰相比,贵州地宝兰的光合能力和适应性较差,这可能与其濒危有很大关系;适当遮阴和增加CO2浓度有利于3种地宝兰属植物的光合作用。该研究结果为贵州地宝兰濒危原因的分析及3种地宝兰属植物种质资源保育提供了参考依据。
关键词: 地宝兰属, 气孔特征, 光合日变化, 光响应曲线, CO2响应曲线, 叶绿素
中图分类号: Q945
文献标识码: A
文章编号: 1000-3142(2024)01-0113-13
Comparative study on leaf anatomical structures
and photosynthetic characteristics of
three Geodorum species
XU Aizhu1,2, JIANG Haidu2, PU Qiankun3, WEI Xiao2, WEI Yujing2,
LUO Yajin4, CHAI Shengfeng2*
( 1. College of Tourism and Landscape Architecture, Guilin University of Technology, Guilin 541006, Guangxi, China; 2. Guangxi Institute of
Botany, Guangxi Zhuang Autonomous Region and Chinese Academy of Sciences, Guilin 541006, Guangxi, China; 3. College of
Pharmacy, Guilin Medical University, Guilin 541004, Guangxi, China; 4. Guangxi Yachang Orchid National
Nature Reserve Management Center, Baise 533209, Guangxi, China )
Abstract: To explore leaf anatomical structures and photosynthetic characteristics of Geodorum plant, the anatomical structure of leaves, daily variation of photosynthesis, light response curve, CO2 response curve, chlorophyll content and other indexes of the narrowly endangered Geodorum eulophioides and widely spread G. densiflorum and G. attenuatum were measured. The results were as follows: (1) Three species of Geodorum did not have spongy and fenestrated tissue differentiation in their chloroplasts, and stomata were distributed only in the lower epidermis. Compared with G. densiflorum and G. eulophioides, G. attenuatum had a greater leaf thickness and smaller stomatal density, exhibiting structural characteristics that were more adaptable to low light environments. (2) The daily changes of net photosynthetic rate (Pn) of three species of Geodorum showed a “bimodal” curve, and the photosynthetic “lunch break” was mainly caused by non-stomatal limitation. The daily mean values of Pn and water use efficiency (WUE) showed that G. attenuatum > G. densiflorum > G. eulophioides, which indicated that G. eulophioides had a weaker ability of accumulating photosynthesis products, and its adaptive capacity to the arid environment was probably poorer. (3) Three species of Geodorum were all shade plants. G. densiflorum had the smallest light compensation point (LCP) and the largest light saturation point (LSP), and had a wider range of adaptation to light intensity; G. attenuatum had a high maximum net photosynthetic rate (Pmax) and apparent quantum efficiency (AQY), and its photosynthetic capacity was stronger; G. eulophioides had the smallest Pmax and the potential maximum net photosynthetic rate (Amax), and its photosynthetic capacity and CO2 utilization capacity were weaker. (4) The chlorophyll a (Chl a), chlorophyll b (Chl b) and total chlorophyll (Chl) contents of G. densiflorum and G. attenuatum were significantly (P<0.05) higher than those of G. eulophioide. (5) There were significant (P<0.05) correlations between the leaf thickness, mesophyll thickness, chlorophyll content, and Pmax of three species of Geodorum. It was concluded that the photosynthetic capacity and adaptability of G. eulophioides were poorer compared with G. densiflorum and G. attenuatum, which might be greatly related to its endangerment; appropriate shading and increased CO2 concentration favored photosynthesis in three species of Geodorum. The results of this study provide a reference for the analysis of the endangered causes of G. eulophioides and the conservation of germplasm resources of three Geodorum species.
Key words: Geodorum, stomatal characteristics, daily variation of photosynthesis, light response curve, CO2 response curve, chlorophyll
光合作用是大部分植物进行物质积累的基础,也是植物生长的重要生理过程,其特征可预先确定和解释植物所需的重要生态需求(Adamec,1997)。植物在生长过程中的竞争力和适应力等综合生存能力和环境因子间的相互作用可揭示其内在规律(Zhang et al.,1999),光合能力的强弱能很大程度上反映植物在种群中的竞争地位和适应能力。研究濒危植物的光合作用及其影响因素,是正确评估最优栖息地条件的重要方法(Smith et al.,1993),能够判断其生长所需的最适宜光照、水分等环境条件,选择最优的栽培地(Smith & Houpis,2004)。将濒危植物和广布近缘种作为对照进行光合特性比较研究,能更好地揭示濒危植物的内在濒危机制。濒危植物与近缘非濒危植物相比,具有较低的光合速率、水分利用率和生物量积累(Ge et al.,2003)。Wei等(2018)研究表明,不管是野外种群还是栽培种群,濒危种金花茶(Camellia nitidissima)的光合、呼吸、蒸腾等生理代谢速率均低于同属广布种茶树(C. sinensis),并且金花茶喜欢潮湿、遮阴的环境,不喜欢强烈的阳光直射,而茶树在半阴和强光的地方都能很好地生长。裂叶沙参(Adenophora lobophylla)的光合速率、呼吸速率、蒸腾速率及水分利用率等均低于广布近缘种泡沙参(A. potaninii)(祖元刚等,1999)。另外,有研究表明,植物的叶片解剖结构受长期自然环境的影响,叶片中的表皮细胞厚度、栅栏组织和海绵组织等叶片解剖结构的变化影响着植物的光合调控(Evans & Loreto,2000; Chartzoulakis et al.,2002; Bacelar et al.,2004),并且植物对光的适应性主要由叶片解剖结构进行调整(Niinemets & Tenhunen,1997)。濒危植物辐花苣苔(Oreocharis esquirolii)的柵栏组织厚度和海绵组织厚度等均显著低于非濒危植物紫花粗筒苣苔(O. elegantissima)和都匀马铃苣苔(O. duyunensis),其叶绿素含量及最大净光合速率(Pmax)等光合能力也整体低于2种同属植物(欧明烛等,2023)。可见,濒危植物对外部环境极为敏感,具有生存能力、适应性相对较低以及光合能力较弱等特点。因此,探究濒危植物与其同属广布种的光合特性和生理结构之间的差异,对于阐明其濒危机制及开展合适的保育措施具有重要意义。
地宝兰属(Geodorum)隶属于兰科(Orchida-ceae)树兰族(Trib. Epidendreae),是典型的多年生地生兰类群,该属在全世界分布,约有10种,在我国发现5种,主要分布在我国华南和西南地区。地宝兰属植物具有一定的观赏价值和药用价值(Keerthiga & Anand,2014)。贵州地宝兰(G. eulophioides)特产于我国,仅分布于中国云南、贵州、广西三地交界处,生长于海拔600 m的灌丛或中等荫蔽度林下,分布范围十分狭窄且数量十分有限,被《中国物种红色名录》和《IUCN濒危物种红色名录》列为极危(CR)等级。地宝兰(G. densiflorum)为地宝兰属的广布种,主要分布于中国华南和西南地区、越南、老挝、柬埔寨、泰国、马来西亚、印度尼西亚等地,生长于海拔1 500 m以下的疏林下、路边、草坡,是该属分布最广且数量最多的物种;大花地宝兰(G. attenuatum)产于中国海南、云南和广西南部,越南、老挝、缅甸也有分布,生于海拔800 m以下的林下或林缘,该物种的分布范围大于贵州地宝兰。与广布种地宝兰和大花地宝兰相比,极危种贵州地宝兰的分布范围十分狭窄,生境有一定差异,这可能与其对光环境的需求和适应性不同有关。目前,对该属植物的研究大多集中在野外调查(魏海燕等,2018; 张央等,2022)和繁殖技术(胡琦敏,2007;蓝玉甜等,2014)等方面,未见其叶片解剖结构和光合特性方面的报道。因此,本研究以贵州地宝兰、地宝兰和大花地宝兰为对象,通过对3种地宝兰属植物的叶片解剖结构和光合特性的比较研究,拟解决以下问题:(1)狭域濒危种贵州地宝兰的光合能力是否低于广布种地宝兰和大花地宝兰;(2)地宝兰属植物的光合能力是否与其叶片解剖结构、叶绿素含量有关。以期为濒危种贵州地宝兰濒危机制的阐明提供参考,为该属植物种质资源保育和引种栽培提供理论依据。
1 材料与方法
1.1 试验地概况和材料处理
试验地位于广西桂林市广西植物研究所内(110°17′ E、25°01′ N),海拔180 m,属于中亚热带季风气候区。该区域具有较好的气候条件,阳光充足、雨量丰沛,年平均气温为19.4 ℃,最热月平均温度为28.5 ℃左右,最冷月平均温度为8.3 ℃左右,年平均降雨量约为1 974 mm,年平均相对湿度为73%~79%,年平均日照时数为1 670 h左右。试验苗选取成年植株栽植于内径21 cm、深18 cm的塑料花盆中,每盆栽植2~3株,选取长势较好的植株做试验苗,栽培基质为林下表层土壤,pH值5.34、有机质含量1.26%、全氮1.53 g·kg-1、全磷1.09 g·kg-1、全钾14.11 g·kg-1。经野外调查发现,3种地宝兰属植物均在70%~80%荫蔽度的林下长势良好,为此将3种地宝兰植株于6月初放入透光率为20%的遮阴棚中,4个月后进行各项指标的测量。
1.2 方法
从试验苗中每种选取至少3株长势一致的植株,选取叶色浓绿、健康成熟的上部外围叶片用于叶片解剖结构和光合特性的测定。
1.2.1 叶片解剖结构参数的测定[HTSS] 选取光合测定后的叶片,剪取叶片中脉至叶缘(1 cm × 1 cm),用2.5%戊二醛溶液固定,磷酸缓冲液冲洗,依次进行脱水、临界点干燥及镀金,每个植株的每个观测部位(叶上表皮、叶下表皮、叶片横切)分别制备3个样品,利用真空电子扫描电镜VEGA3 TESCAN进行拍照观察,每个样品随机观察10个视野,测定叶片厚度(leaf thickness,LT),叶肉厚度(mesophyll thickness,MT),上、下表皮细胞厚度,气孔密度,气孔长,气孔宽和气孔面积,每个物种3个重复。
1.2.2 光合作用日进程变化的测定[HTSS] 选择在10月(秋季)上旬天气晴朗的条件下进行测定,采用Li-6400XT便携式光合作用测量系统(Li-Cor, Lincoln, Nebraska, USA)测定3种地宝兰属植物叶片的气体交换参数,并利用自然光和空气CO2浓度进行测定。选取健康成熟的叶片,9:00—18:00每间隔1.5 h进行1次测定,每个叶片重复测定3次,取平均值。测定叶片净光合速率(Pn,μmol·m-2·s-1)、蒸腾速率(Tr,mmol·m-2·s-1)、气孔导度(Gs,mol·m-2·s-1)、胞间CO2浓度(Ci,μmol·mol-1)、气孔限制值(Ls=1-Ci/Ca)、水分利用率(WUE,μmol·mmol-1)等光合参数及光合有效辐射(PAR,μmol·m-2·s-1)、空气温度(Ta,℃)和空气相对湿度(RH,%)等环境因子参数。每个物种测定3株。
1.2.3 光合-光响应曲线的测定[HTSS] 选择晴天于8:00—12:00进行测量,测量前叶片先在600 μmol·m-2·s-1光强下诱导30 min(仪器自带的红蓝光源)以充分活化光合系统。使用开放气路,设空气流速为0.5 L·min-1,叶片温度为28 ℃,CO2浓度为400 μmol·mol-1。设定光强梯度为1 500、1 200、1 000、800、600、400、200、150、100、50、20、0 μmol·m-2·s-1。每个物种测定3株。以光量子通量密度(photosynthetic photon flux density,PPFD)为横轴、净光合速率(Pn)为纵轴绘制光合-光响应曲线,光合参数的计算依据叶子飘(2010)的直角双曲线修正模型。
1.2.4 光合-CO2响应曲线的测定[HTSS] 于上午8:00—12:00进行测量,测量前对待测叶片进行诱导。设空气流速为0.5 L·min-1,叶片温度为28 ℃。根据1.2.2光响应曲线测定的光饱和点附近的光强设为固定光强800 μmol·m-2·s-1,CO2浓度梯度设为400、300、200、150、100、50、400、400、600、800、1 000、1 200、1 500、2 000 μmol·mol-1(用CO2钢瓶控制浓度)。测定时在每个CO2浓度下平衡 150~180 s,系统自动记录不同 CO2浓度下的净光合速率(Pn)。每个物种测定3株。参考叶子飘(2010)的计算方法,采用直角双曲线修正模型拟合做出Pn-Ci曲线图,并计算光合-CO2响应参数。
1.2.5 光合色素含量的测定[HTSS] 将以上进行光合测定后的叶片用打孔器取20片1 cm2的小圆片,并剪碎装入25 mL容量瓶,用95%乙醇定容,暗条件放置24 h后分别在665、649 、470 nm吸光度下测定提取液的吸光值,根据公式(李合生,2000)计算出叶绿素a(Chl a)、叶绿素b(Chl b)、总叶绿素(Chl)和类胡萝卜素(Car)的含量及叶绿素a与叶绿素b的比值(Chl a/b)、类胡萝卜素与总叶绿素的比值(Car/Chl)。每个物种测定3株。
1.3 数据分析
利用Excel 2016软件对上述试验结果进行处理,采用SPSS 26.0软件进行单因素方差分析,用Duncan法进行多重比较,并对叶片解剖结构特征、叶绿素含量与光合特征参数进行相关性分析,用Origin 9.2软件绘图,利用光合计算4.1.1软件的直角双曲线修正模型(叶子飘,2010)拟合并计算光响应曲线和CO2响应曲线的光合参数。
2 结果与分析
2.1 环境因子的日变化
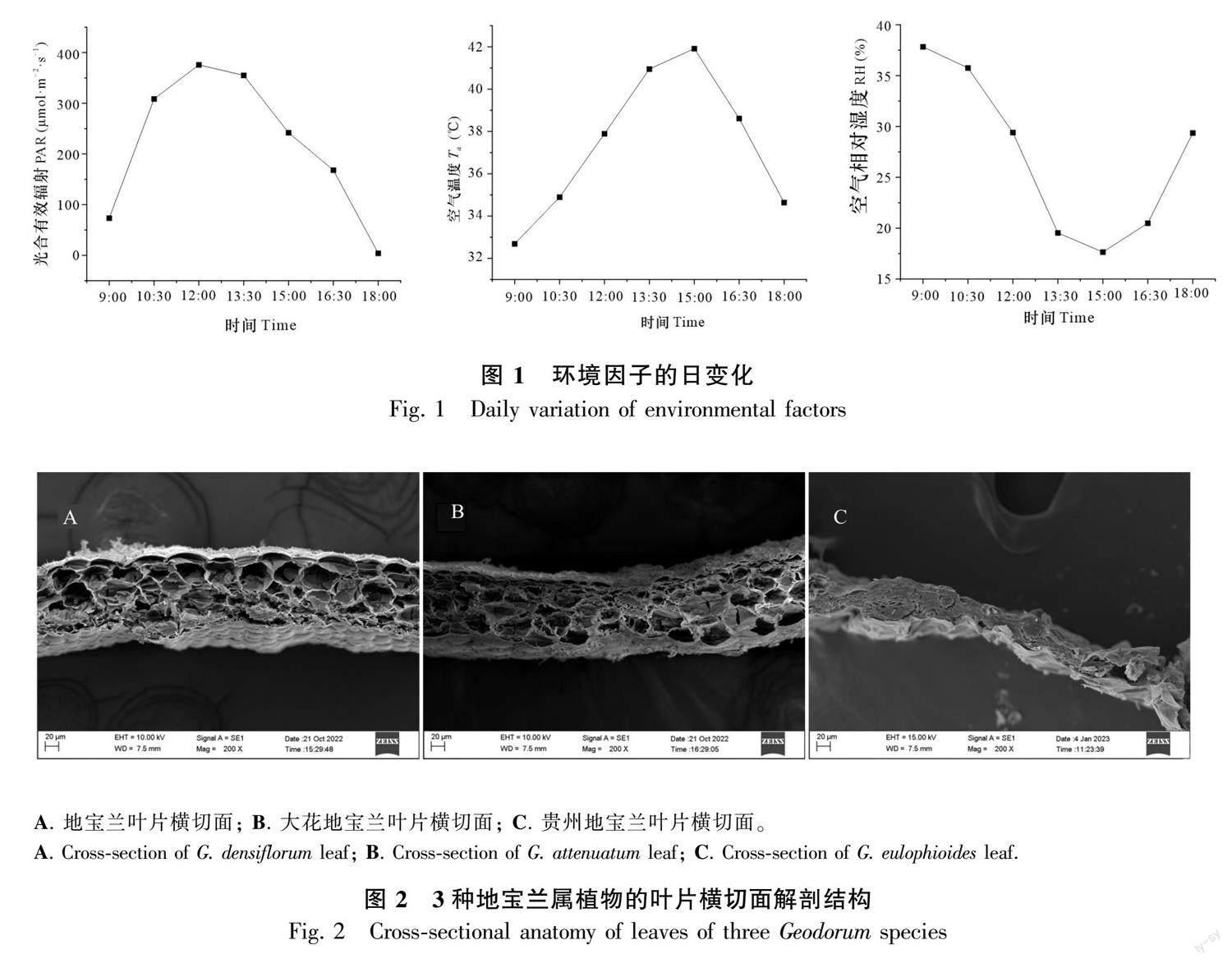
3种地宝兰属植物环境因子的日变化如图1所示。PAR随着时间的推移先上升后下降,最大值出现在12:00,为375.79 μmol·m-2·s-1;Ta与PAR变化趋势相似,均为先升后降,峰值出现在15:00,此时Ta为41.91 ℃;RH则与Ta和PAR的变化趋势相反,为先下降后上升,在15:00时RH达到最低,仅为17.67%。
2.2 叶片解剖结构
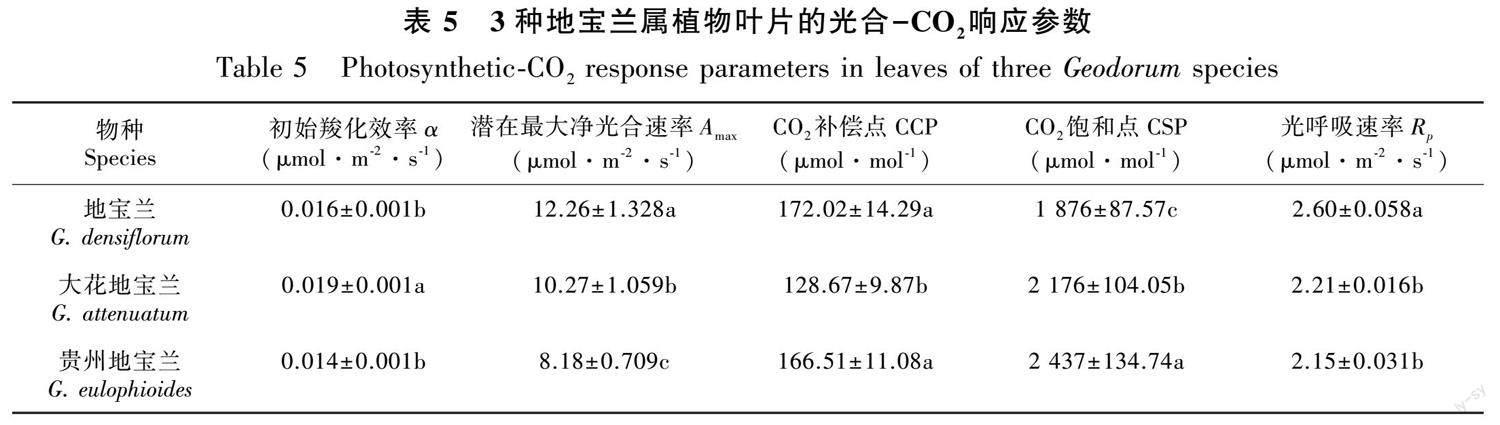
2.2.1 叶片解剖结构特征[HTSS] 地宝兰、大花地宝兰和贵州地寶兰的叶片横切面结构如图2所示,叶片均由上表皮、下表皮、叶肉组织和叶脉组成,上、下表皮均由单层细胞组成,上表皮的细胞厚度比下表皮细胞大,叶肉细胞没有分化出海绵组织和栅栏组织。地宝兰和大花地宝兰的叶片厚度、上、下表皮细胞厚度和叶肉厚度均显著(P<0.05)大于贵州地宝兰(表1)。
2.2.2 叶片气孔特征[HTSS] 通过对3种地宝兰属植物叶片上、下表皮的正面观察可知(图3),气孔仅分布在叶片的下表皮,气孔和保卫细胞呈梭子形,表皮细胞形状呈方形或圆形。地宝兰的气孔密度显著(P<0.05)大于大花地宝兰和贵州地宝兰;3种地宝兰属植物的气孔长、气孔宽及气孔面积之间均无明显差异(表2)。
2.3 光合参数日变化
3种地宝兰的净光合速率(Pn)均呈“双峰型”曲线,Pn均在13:30时出现低值,表现出光合“午休”现象(图4:A);日均Pn大小表现依次为大花地宝兰>地宝兰>贵州地宝兰(表3)。气孔导度(Gs) 和蒸腾速率 (Tr) 的日变化趋势与Pn基本一致,均在13:30时出现低值(图4:B,C);大花地宝兰的日均Gs和日均Tr显著(P<0.05)高于地宝兰和贵州地宝兰(表3)。3种地宝兰的胞间CO2浓度(Ci)均呈“W”型变化趋势,在13:30时出现峰值,低值分别出现在12:00和16:30(图4:D);日均Ci间差异不显著(P>0.05)(表3)。3种地宝兰的气孔限制值(Ls)和水分利用率(WUE)的日变化亦呈现“双峰型”曲线(图4:E,F);日均Ls间差异不显著(P>0.05),而大花地宝兰的日均WUE显著(P<0.05)高于贵州地宝兰(表3)。
2.4 光合-光响应参数
3种地宝兰属植物光合-光响应曲线拟合的决定系数(R2)均在0.95以上,曲线的拟合效果良好,随着光量子通量密度(PPFD)的增加,Pn存在差异,Pn的大小表现依次为大花地宝兰>地宝兰>贵州地宝兰 (图5)。地宝兰、大花地宝兰、贵州地宝兰的最大净光合速率(Pmax)分别为4.09、5.75、3.89 μmol·m-2·s-1,大花地宝兰的Pmax显著(P<0.05)高于地宝兰和贵州地宝兰。如表4所示,地宝兰的光补偿点(light compensation point, LCP)最低(6.63 μmol·m-2·s-1)、光饱和点(light saturation point, LSP)最高(877 μmol·m-2·s-1),其对光强的利用范围最大。贵州地宝兰和大花地宝兰的暗呼吸速率(Rd)显著(P<0.05)高于地宝兰,而不同物种间表观量子效率(AQY)则无显著差异(P>0.05)。
2.5 光合-CO2响应参数
如图6所示,当CO2浓度在50~600 μmol·mol-1范围内,3种地宝兰属植物的Pn呈直线上升,当CO2浓度大于800 μmol·mol-1后,Pn的大小表现依次为地宝兰>大花地宝兰>贵州地宝兰。大花地宝兰的初始羧化效率(α)显著(P<0.05)大于地宝兰和贵州地宝兰,而后两者间差异不显著(P>0.05)。3种地宝兰属植物的潜在最大净光合速率(Amax)和光呼吸速率(Rp)之间均存在显著差异(P<0.05),并且Amax和Rp的大小均表现为地宝兰>大花地宝兰>贵州地宝兰(表5)。3种地宝兰属植物的CO2补偿点(carbon dioxide compensation point, CCP)和CO2饱和点(carbon dioxide saturation point, CSP)均存在明显差异,CCP的大小依次为地宝兰>贵州地宝兰>大花地宝兰,CSP的大小依次为贵州地宝兰>大花地宝兰>地宝兰。
2.6 叶片光合色素含量及比例
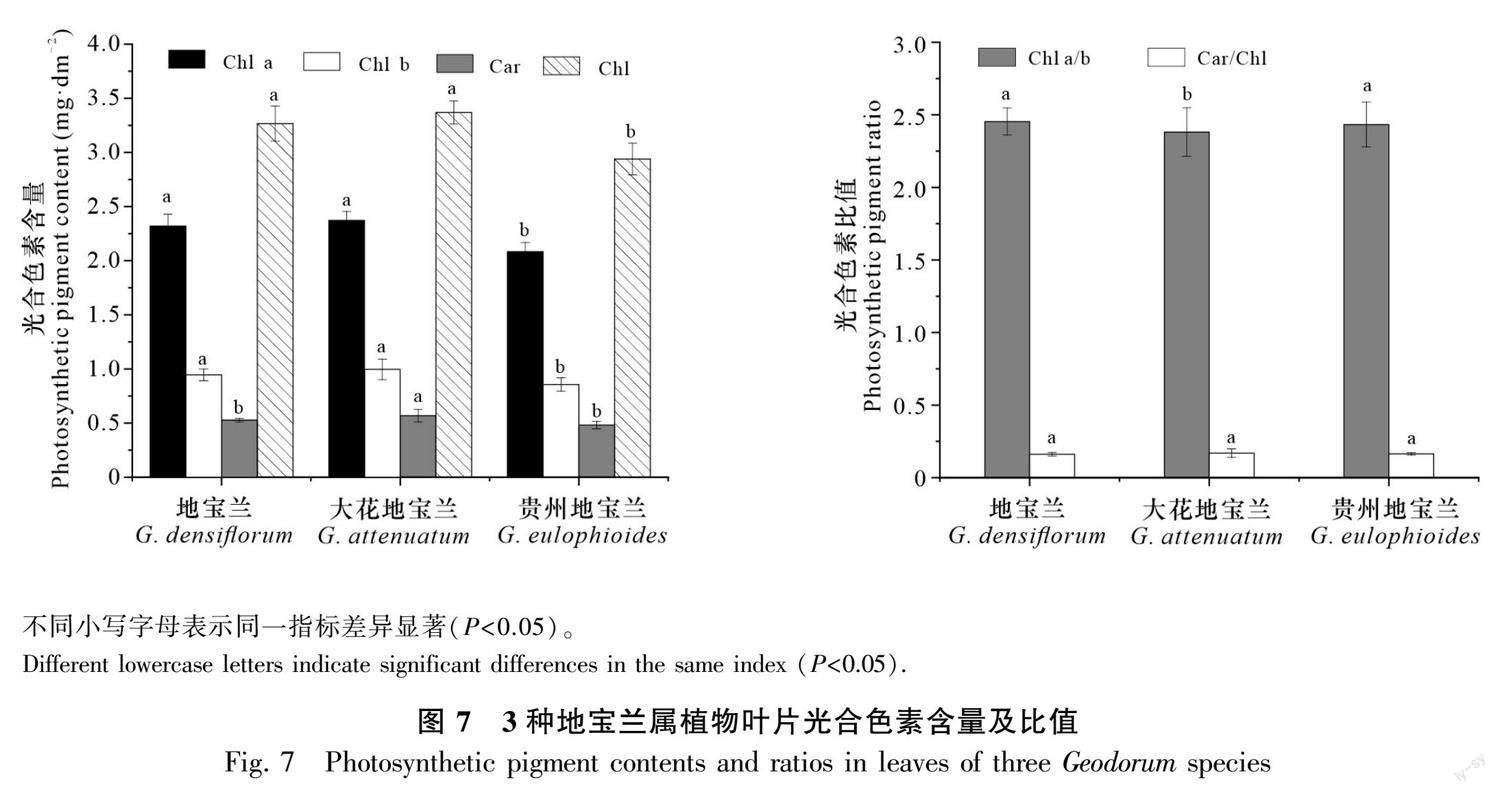
3种地宝兰属植物叶绿素a(Chl a)、叶绿素b(Chl b)、类胡萝卜素(Car)和总叶绿素(Chl)含量的大小依次为大花地宝兰>地宝兰>贵州地宝兰,并且地宝兰和大花地宝兰的叶绿素含量均显著(P<0.05)大于贵州地宝兰(图7)。大花地宝兰的Chl a/b值显著(P<0.05)低于地宝兰和贵州地宝兰,Car/Chl值在3种地宝兰间无显著性差异(P>0.05)。
2.7 叶片解剖结构特征、叶绿素含量与光合特征参数的相关性
如表6所示,叶片厚度(LT)和叶肉厚度(MT)与Gs、Pmax、Chl呈显著(P<0.05)或极显著(P<0.01)正相关,而气孔密度(SD)和气孔面积(SA)与光合特征参数之间均不存在显著相关性(P>0.05);Chl与Pn、 Gs 、Tr、Pmax呈显著(P<0.05)正相关。
3 讨论与结论
在植物生长过程中, 叶片对环境变化敏感且可塑性较大,叶片结构特征受长期适应自然环境的影响(Aasamaa et al., 2001)。本研究中,3种地宝兰属植物的叶片解剖结构相似,气孔均只在下表皮有分布,这将有利于保持水分、减少蒸腾(陈健辉等,2018);没有分化出海绵组织和栅栏组织,这与叶庆生等(1992)和李凤(2010)对兰科植物墨兰(Cymbidium sinense)和五唇兰(Phalaenopsis pulcherrima)的叶片结构研究结果一致。叶片厚度增大,能够促进叶片吸收更多的光能,提高光能利用率(宋碧玉等,2017),贵州地宝兰的叶片厚度和叶肉厚度均显著(P<0.05)小于地宝兰和大花地宝兰,这可能是其光合能力较弱的原因之一。较低的气孔密度及较大的气孔是植物在弱光环境下生长的特性(盛洁悦等,2020)。本研究中,大花地宝兰具有较低的气孔密度和较大的气孔面积,说明其更能适应弱光环境。
光合作用日变化中的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(Tr)等是反映植物对环境适应能力的重要指标。光合作用减弱是气孔还是非气孔因子限制,可以通过Ci的变化判断(Sharma et al.,1995)。3种地宝兰属植物的Pn均呈“雙峰型”变化趋势,并且Pn的下降伴随Ci的增加,说明光合“午休”现象是由非气孔限制因素引起的(Farquhar & Shatrkey,1982;Larcher,2003)。本研究中,3种地宝兰属植物对午间水分下降时的气孔调节相似,在中午高温强光环境下通过调整Gs来最大限度固定大气中的CO2,并尽可能减少水分流和减弱强辐射高温环境对植株的影响。净光合速率的大小体现植物物质积累的能力,也对植物的生长速度及在群落中的优劣势地位有影响(丁圣彦和宋永昌,1999)。本研究中,贵州地宝兰的日均Pn显著低于大花地宝兰,其积累光合产物的能力较弱,将不利于其生长,可能在群落竞争中处于劣势。WUE能反映叶片水分消耗与物质积累的关系(吴延娟等,2020)。本研究中,贵州地宝兰的日均WUE最低,表明其消耗等质量的水而积累的干物质最少,其对干旱环境的适应能力可能相对较差。
植物的光合参数反映不同植物对光环境的响应对策,可探讨植物对环境的适应能力(Yokoya et al.,2007)。Pmax越高,固碳能力越强,也有利于有机物的积累(Mahmud et al.,2018;Vincenza et al.,2018)。大花地宝兰的Pmax(5.75 μmol·m-2·s-1)显著大于地宝兰和贵州地宝兰(分别为4.09、3.89 μmol·m-2·s-1),说明大花地宝兰积累有机物的能力高于地宝兰和贵州地宝兰。LCP和LSP反映植物光适应的生态幅度范围,LCP与LSP相差越大,植物对光的适应范围也越大(张旺锋等,2005)。
3种地宝兰属植物的LCP均小于20 μmol·m-2·s-1,LSP均小于1 000 μmol·m-2·s-1,是典型的阴生植物特征(蒋高明,2004),但地宝兰对光照强度的适应范围更宽,这可能是其作为广布种的原因之一。AQY可以判断植物对弱光利用能力的大小,其值越大,对弱光利用能力越强(Richardson & Berlyn,2002)。大花地宝兰的AQY大于地宝兰和贵州地宝兰,表明大花地宝兰对弱光的利用能力高于其他两种地宝兰,这也证实了叶片解剖结构表现出的大花地宝兰更能适应弱光环境的结论。Rd反映植物在黑暗条件下消耗有机物的能力(Gyimahr & Nakao,2007;Pastur et al.,2007),相比之下,贵州地宝兰进行暗呼吸作用消耗有机物的能力高于地宝兰和大花地宝兰。本研究结果与3种地宝兰属的分布情况基本一致,地宝兰可见于光照较强的路边、草坡上,在郁闭度较高的林下也有分布,适应范围较广,大花地宝兰在郁闭度为中等至较高的林下都有分布,而贵州地宝兰的适应范围相对较窄,同时贵州地宝兰的光合能力较差,对环境的适应能力较低,这可能是其分布更狭窄和濒危的重要原因。
植物光合作用主要由光反应和碳反应组成。碳反应的主要原料为CO2,由于空气中的CO2浓度很低,往往供应不足,因此CO2是植物光合作用的重要限制因素。提高CO2浓度能够增加CO2与羧化酶活性位点的结合来提高Pn(李丽霞等,2016)。本研究中,地宝兰的Amax明显高于大花地宝兰和贵州地宝兰,说明地宝兰对CO2的利用能力较强; 但是大花地宝兰的初始羧化效率(α)显著大于地宝兰和贵州地宝兰,表明大花地宝兰对低CO2浓度的利用能力较强。3种地宝兰属植物的Pmax远低于其Amax,表明光饱和条件下的光合速率受到限制的主要因素是CO2供应不足。本研究中,3种地宝兰属植物的CSP均较高,在1 876~2 437 μmol·m-2·s-1范围内,可见3种地宝兰属植物对CO2的利用范围较宽。CCP反映植物利用低浓度CO2的能力,其值越低,表示植物利用低CO2浓度能力和积累干物质能力越强(陈旅等,2016)。3种地宝兰属植物的CCP在128.67~172.02 μmol·mol-1范围内,其中大花地宝兰的CCP最低,进一步说明大花地宝兰更能适应低CO2浓度的生境。可见适当提高CO2浓度有利于3种地宝兰属植物的生长发育。
植物的光合能力与叶绿素含量密切相关,叶绿素不仅能捕捉和传递光能,也可作为光能的转换器(Wittmann et al.,2001;胡根海等,2010)。本研究中,3种地宝兰属植物的叶绿素含量与其Pmax呈显著正相关,说明叶绿素含量是决定其光合能力的重要因子。3种地宝兰属植物的Chl a/b值在[HJ2.08mm]2.381~2.454 mg·g-1范围内,数值均低于3,属于阴生植物(Lichtenthaler et al.,1981;Hoflacher & Bauer,1982)。叶绿素含量与Chl a/b值能够反映植物的耐阴性,叶绿素含量越高、Chl a/b值越小,植物越具有较强的耐阴性,能更有效利用光能(Huang et al.,2016;张朝铖等,2019)。综合来看,大花地宝兰有较高的叶绿素含量和较低的Chl a/b值,因此大花地宝兰的耐阴性和光合能力较强,其次是地宝兰,贵州地宝兰耐阴性和光合能力较弱。
綜上所述,在20%生长光强下,3种地宝兰属植物均存在光合“午休”现象且主要由非气孔限制因素引起的。大花地宝兰的光合作用能力较强,地宝兰对光强的适应范围更宽,而贵州地宝兰的光合能力及适应环境能力都较差。叶片厚度、叶肉厚度和叶绿素含量可能是影响3种地宝兰属植物光合能力的重要因子。本研究表明,贵州地宝兰具有光合能力较弱、适应性相对较低等特点,这可能是导致其濒危的重要原因,适当的遮阴和增加CO2浓度可以提高3种地宝兰属植物的光合作用。
参考文献:
AA SAMAA K, SOBER A, RAH1 M, 2001. Leaf anatomical characteristic associated with shoot hydraulic conductance, stomatal conductance and stomatal sensitivity to changes of leaf water status in temperate deciduous trees [J]. Aust J Plant Physiol, 28(8): 765-774.
ADAMEC L, 1997. Photosynthetic characteristics of the aquatic carnivorous plant Aldrovanda vesiculosa [J]. Aquat Bot, 59(3/4): 297-306.
BACELAR EA, CORREIA CM, MOUTINHO-PEREIRA JM, et al., 2004. Sclerophylly and leaf anatomical traits of five field-grown olive cultivars growing under drought conditions [J]. Tree Physiol, 24 (2): 233-239.
CHARTZOULAKIS K, PATSKAS A, KOFIDIS G, et al., 2002. Water stress affects leaf anatomy, gas exchange, water relations and growth of two avocado cultivars [J]. Sci Hortic, 95(1): 39-50.
CHEN JH, MIAO SY, HUANG HF, et al., 2018. Comparative study on leaf structures of five mangrove plants [J]. Guihaia, 38(5): 655-664. [陳健辉, 缪绅裕, 黄惠芳, 等, 2018. 五种红树植物叶片结构的比较研究 [J]. 广西植物, 38(5): 655-664.]
CHEN L, YANG TX, WEI AZ, et al., 2016. Comparative study on photosynthetic characteristics of different Zanthoxylum bungeanum varieties [J]. Acta Agric Boreal-Sin, 31(4):153-161. [陈旅, 杨途熙, 魏安智, 等, 2016. 不同花椒品种光合特性比较研究 [J]. 华北农学报, 31(4): 153-161.]
DING SY, SONG YC, 1999. Comparison of photosynthetic physiological ecology of dominant species in a successional series of evergreen broadleaf forest in Tiantong, Zhejiang [J]. Acta Ecol Sin, 19(3): 30-35. [丁圣彦, 宋永昌, 1999. 浙江天童常绿阔叶林演替系列优势种光合生理生态的比较 [J]. 生态学报, 19(3): 30-35.]
EVANS JR, LORETO F, 2000. Acquisition and diffusion of CO2 in higher plant leaves [J]. Photosynthesis: physiology and metabolism, 14: 321-351.
FARQUHAR GD, SHATRKEY TD, 1982. Stamatal conductance and photosynthesis [J]. Ann Rev Plant Physiol, 33: 317-345.
GE Y, CHANG J, LI WC, et al., 2003. Effect of soil moisture on the gas exchange of Changium smyrnioides and Anthriscus sylvestris [J]. Biol Plant, 47: 605-608.
GYIMAH R, NAKAO T, 2007. Early growth and photosynthetic responses to light in seedlings of three tropical species differing in successional strategies [J]. New For, 33(3):217-236.
HOFLACHER H, BAUER H, 1982. Light acclimation in leaves of the juvenile and adult life phases of ivy (Hedera helix) [J]. Physiol Plant, 56(2): 177-182.
HU GH, WANG ZW, WANG QL, et al., 2010. Differences in chlorophyll content changes between Gossypium barbadense and Gossypium hirsutum [J]. J Biol, 27(4): 31-34. [胡根海, 王志伟, 王清连, 等, 2010. 海岛棉与陆地棉叶绿素含量变化的差异研究 [J]. 生物学杂志, 27(4): 31-34.]
HU QM, 2007. Study on the fast propagation technology of aseptic sowing and morphogenesis of proto-bulbs in Geodorum densiflorum [D]. Guilin: Guangxi Normal University. [胡琦敏, 2007. 地宝兰无菌播种快繁技术及原球茎的形态发生研究 [D]. 桂林: 广西师范大学.]
HUANG CJ, WEI G, JIE YC, et al., 2016. Effect of shade on plant traits, gas exchange and chlorophyll content in four ramie cultivars [J]. Photosynthetica, 54(3): 390-395.
JIANG GM, 2004. Plant physiological ecology [M]. Beijing: Higher Education Press. [蒋高明, 2004. 植物生理生态学 [M]. 北京: 高等教育出版社.]
KEERTHIGA M, ANAND SP, 2014. A review on ethnomedicinal, phytochemical and pharmacological studies of Geodorum densiflorum (Lam.) Schltr., an endangered orchid [J]. J Res Biol, 4(8): 1543-1548.
LAN YT, WEI XL, HUANG L, et al., 2014. Research on aseptic seeding and rhizome propagation technology of wild Geodorum eulophioides [J]. J Anhui Agric Sci, 42(2): 395-397. [蓝玉甜, 韦新莲, 黄岚, 等, 2014. 野生贵州地宝兰无菌播种及根状茎繁育技术研究 [J]. 安徽农业科学, 42(2): 395-397.]
LARCHER W, 2003. Physiological plant ecology: ecophysiology and stress physiology of functional groups [M]. Berlin: Springer Science & Business Media.
LI F, 2010. Photosynthetic physiological characteristics of two ecotypes of the endemic East Asian species of Phalaenopsis pulcherrima [D]. Haikou: Hainan University. [李凤, 2010. 东亚特有种五唇兰两种生态型的光合生理特性研究 [D]. 海口: 海南大学.]
LI HS, 2000. Principles and techniques of plant physiological and biochemical experiments [M]. Beijing: Higher Education Press: 134-263. [李合生, 2000. 植物生理生化实验原理和技术 [M]. 北京: 高等教育出版社: 134-263.]
LI LX, LIU JM, LIAO XF, et al., 2016. Effect of Drepanostachyum luodianense photosynthesis on characteristic of response to CO2 [J]. J NE For Univ, 44(8): 18-23. [李丽霞, 刘济明, 廖小锋, 等, 2016. 小蓬竹光合作用对CO2的响应特征 [J]. 东北林业大学学报, 44(8): 18-23.]
LICHTENTHALER HK, BUSCHMANN C, DLL M, et al., 1981. Photosynthetic activity, chloroplast ultrastructure, and leaf characteristics of high-light and low-light plants and of sun and shade leaves [J]. Photosynth Res, 2: 115-141.
MAHMUD K, MEDLYN BE, DUURSMA RA, et al., 2018. Inferring the effects of sink strength on plant carbon balance processes from experimental measurements [J]. Biogeosciences, 15(13): 4003-4018.
NIINEMETS , TENHUNEN JD, 1997. A model separating leaf structural and physiological effects on carbon gain along light gradients for the shade-tolerant species Acer saccharum [J]. Plant, Cell Environ, 20(7): 845-866.
PASTUR GM, LENCINAS MV, PERI PL, et al., 2007. Photosynthetic plasticity of Nothofagus pumilio seedlings to light intensity and soil moisture [J]. For Ecol Manage, 243: 274-282.
RICHARDSON AD, BERLYN GP, 2002. Spectral reflectance and photosynthetic properties of Betula papyrifera (Betulaceae) leaves along an elevational gradient on Mt. Mansfield, Vermont, USA [J]. Am J Bot, 89(1): 88-94.
SHARMA PN, TRIPATHI A, BISHT SS, 1995. Zinc requirement for stomatal opening in cauliflower [J]. Plant physiology, 107(3): 751-756.
SHENG JY, CUI WX, ZHANG EJ, et al., 2020. Morphological structure observation and photosynthetic characteristics analysis of taro leaf [J]. J Biol, 37(2): 61-64. [盛潔悦, 崔文雪, 张二金, 等, 2020. 芋叶形态结构观察及光合特征分析 [J]. 生物学杂志, 37(2): 61-64.]
SMITH M, HOUPIS JLJ, 2004. Gas exchange responses of the wetland plant Schoenopleclus hallii to irradiance vapor pressure deficit [J]. Aquat Bot, 79: 267-275.
SMITH M, WU Y, GREEN O, 1993. Effect of light and water-stress on photosynthesis and biomass production in Boltonia decurrens (Asteraceae), a threatened species [J]. Am J Bot, 80: 859-864.
SONG BY, ZHOU LY, PU GL, et al., 2017. Effects of pruning on photosynthesis and leaf anatomical characteristics of Chimonanthus praecox [J]. J Hunan Agric Univ (Nat Sci Ed), 43(5): 533-538. [宋碧玉, 周兰英, 蒲光兰, 等, 2017. 修剪对蜡梅光合作用和叶片解剖特征的影响 [J]. 湖南农业大学学报 (自然科学版), 43(5): 533-538.]
VINCENZA V, VITTORIA D, CARLO A, et al., 2018. Comparative analysis of photosynthetic and respiratory parameters in the psychrophilic unicellular green alga Koliella antarctica, cultured in indoor and outdoor photo-bioreactors [J]. Physiol Mol Biol Plants Int J Funct Plant Biol, 24(6): 1139-1146.
WEI HY, LI XF, AN MT, et al., 2018. Status of resources and analysis of causes of endangerment of the critically endangered plant Geodorum eulophioides in Guizhou [J]. J Mount Agric Biol, 37(3): 44-48. [魏海燕, 李曉芳, 安明态, 等, 2018. 贵州极危植物贵州地宝兰资源现状与濒危原因分析 [J]. 山地农业生物学报, 37(3): 44-48.]
WEI X, JIANG YS, JIANG SY, et al., 2008. Photosynthetic characteristics of an endangered species Camellia nitidissima and its widespread congener Camellia sinensis [J]. Photosynthetica, 46 (2): 313-314.
WITTMANN C, ASCHAN G, PFANZ H, 2001. Leaf and twig photosynthesis of young beech (Fagus sylvatica) and aspen (Populus tremula) trees grown under different light regime [J]. Basic Appl Ecol, 2(2): 145-154.
WU TJ, TIAN MP, XIE XL, 2020. Comparative study on photosynthetic characteristics of different Rehmannia glutinosa species [J]. Mod Trad Chin Med Materia Med-World Sci Technol, 22(8): 2899-2906. [吴廷娟, 田梦平, 谢小龙, 2020. 不同地黄品种光合特性的比较研究 [J]. 世界科学技术—中医药现代化, 22(8): 2899-2906.]
YE QS, PAN RC, QIU CX, 1992. Studies on the leaf structure and photosynthesis of Cymbidium sinense [J]. J Integr Plant Biol, 34(10): 771-776. [叶庆生, 潘瑞炽, 丘才新, 1992. 墨兰叶片结构及光合作用的研究 [J]. J Integr Plant Biol, 34(10): 771-776.]
YE ZP, 2010. A review on modeling of responses of photosynthesis to light and CO2 [J]. Chin J Plant Ecol, 34(6): 727-740. [叶子飘, 2010. 光合作用对光和CO2响应模型的研究进展 [J]. 植物生态学报, 34(6): 727-740.]
YOKOYA NS, NECCHI O, MARTINS AP, et al., 2007. Growth responses and photosynthetic characteristics of wild and phycoerythrin-deficient strains of Hypnea musciformis (Rhodophyta) [J]. J Appl Phycol, 19(3): 197-205.
ZHANG CC, JIANG Q, WU Z, et al., 2019. Study and evaluation of shade tolerance characteristics of four ornamental grasses [J]. Acta Pratac Sin, 28(7): 60-72. [张朝铖, 蒋倩, 吴志, 等, 2019. 4种观赏草的耐阴特性研究及評价 [J]. 草业学报, 28(7): 60-72.]
ZHANG WF, FAN DY, XIE ZQ, et al., 2005. Seasonal photosynthetic response of young Cathaya argyrophylla trees to growth light intensity in an endangered plant [J]. Biodivers Sci, 13(5): 387-397. [张旺锋, 樊大勇, 谢宗强, 等, 2005. 濒危植物银杉幼树对生长光强的季节性光合响应 [J]. 生物多样性, 13(5): 387-397.]
ZHANG WH, ZU YG, MA KM, 1999. Analysis on the fractal character of distribution patterns of Adenophora lobophylla and A. potaninnii [J]. Chin J Plant Ecol, 23(1): 31-39.
ZHANG Y, LI Z, AN MT, et al., 2022. Ecological niche characteristics and interspecific relationships of very small populations of wild plants of Geodorum eulophioides community [J]. J Plant Resour Environ, 31(3): 1-10. [张央, 李志, 安明态, 等, 2022. 极小种群野生植物贵州地宝兰群落生态位特征及种间关系 [J]. 植物资源与环境学报, 31(3): 1-10.]
ZU YG, ZHANG WH, YAN XF, et al., 1999. Conservation biology of endangered plant Adenophora lobophylla [M]. Beijing: Science Press. [祖元刚, 张文辉, 阎秀峰, 等, 1999. 濒危植物裂叶沙参保护生物学[M]. 北京: 科学出版社.]
( 责任编辑 邓斯丽 )
收稿日期: 2023-08-12
基金项目: 国家重点研发计划项目(2022YFF1300700); 国家林业和草原局科技发展中心项目(KJZXSA202307); 广西林业科技推广示范项目(桂林科字 [2021]第28号); 桂林市创新平台和人才计划项目(20210102-3)。
第一作者: 许爱祝(1996-),硕士研究生,主要研究方向为珍稀植物保育及其园林应用,(E-mail)1353177848@qq.com。
* 通信作者: 柴胜丰,博士,研究员,主要从事珍稀濒危植物保育及可持续利用研究,(E-mail)sfchai@163.com。
