改进核酸筛查混检阳性池再检模式的探讨
2024-03-09侯云冯秋霞李蓓张龙穆杨忠思焦淑贤
侯云 冯秋霞 李蓓 张龙穆 杨忠思 焦淑贤
(青岛市中心血站,山东 青岛 266071)
经过近10 年的运行和探索,国内核酸检测(nucleic acid testing,NAT)技术应用于血液筛查极大地提高了血液安全性。 目前NAT 系统主要分为混样和单人份检测2 种系统,其中以混样(6 或8人份)检测系统居多[1]。 混样检测系统现行判定规则为:献血者标本混检为阳性池再拆分为阳性的标本判定为不合格;再拆分为阴性的池中所有标本判定为合格标本,全部予以放行[2]。 目前国内核酸混检阳性、再拆分阴性的献血者标本占有一定的比例[3],我国是乙型肝炎高流行国家,普通人群的乙型肝炎病毒(hepatitis B virus,HBV)感染率约为10%,常为低载量病毒携带者,且存在大量的隐匿性乙型肝炎病毒感染(occult HBV infection,OBI)[4-5]。 有学者认为核酸混检阳性、再拆分阴性的标本可能存在HBV 低病毒载量漏检的风险[6-8],因此对此类标本如何进一步评估处置已成为业内关注的焦点。 本研究通过回顾分析本站近5 年核酸混检HBV 阳性池的CT 值分布区间与拆分率的相关性,以CT 值为依据制定混检HBV 阳性池再检实验方案,探讨再检方案的应用效果,为进一步优化核酸混检HBV 阳性池再检模式提供数据支持。
1 材料与方法
1.1 研究对象
2017 年1 月—2021 年12 月与2022 年3 月—2023 年3 月本站应用Cobas S201 核酸检测系统检测的无偿献血者标本,献血者均符合国家《献血者健康检测要求》。 每位献血者采血后留取3 管标本,每管留取5 mL,分别用于血型(EDTA 抗凝)酶免(分离胶)和核酸(带分离胶,EDTA 抗凝)检测。运送时标本放置于冷藏储存箱,温度控制在2 ~8℃,4 h 内离心,72 h 内完成检测。
1.2 试剂与仪器
1)Cobas S201 检测系统及Cobas MPX 2.0 检测试剂(批号:H18062,G16014,E31914),Cobas S201检测方法是PCR 荧光法,推荐使用6 混样检测模式,每个标本检测量为167 μL 血浆,目前是国内血液核酸筛查领域的主流设备之一。 2)Panther 检测系统及其检测试剂Elite(批号:705173),Panther 检测方法是TMA 化学发光法,是单人份检测模式,每个标本检测量为500 μL 血浆,目前国外多采用集中化单人份检测系统。
1.3 方法
1.3.1 Cobas S201 检测系统
初检6 人份混检阴性池的标本判为NAT 合格;初检6 人份混检阳性池的标本再进行拆分试验,拆分试验为阴性的标本判定为NAT 合格,拆分试验为阳性的标本判定为NAT 不合格。 混检和拆分阳性标本的判定以CT 值的大小判定,CT 值<60判定为阳性。
1.3.2 Panther 检测系统
初检单人份标本联检阴性标本判为NAT 合格;初检单人份标本联检阳性标本判定为NAT 不合格,再对该标本进行鉴别试验,鉴别试验无论为阳性还是阴性判定该标本为NAT 不合格。 联检和鉴别阳性标本的判定以S/CO 值判定,S/CO≥1.00判为阳性。
1.3.3 检测模式
2017 年1 月—2021 年12 月标本应用Cobas S201 检测系统,依据混样检测系统判定规则直接判定结果;2022 年3 月—2023 年3 月标本先进行Cobas S201 检测系统6 人份混样检测,对于混检阳性池标本再进行Cobas S201 检测系统拆分检测,同步进行Panther 检测系统的联检,2 种检测方法同阳或同阴,以任1 结果判定标本;2 种检测方法1阳/1 阴,以阳性结果判定标本(本站2 套检测系统通过15189 系统比对验证通过[9],可以同步发布结果)。
1.4 统计学分析
采用SPSS17.0 软件进行统计分析,组间比较采用卡方检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 NAT 混样检测结果
2017—2021 年本站采用混样检测方法共检测465 922 份无偿献血者标本(77 654 个池),见表1。
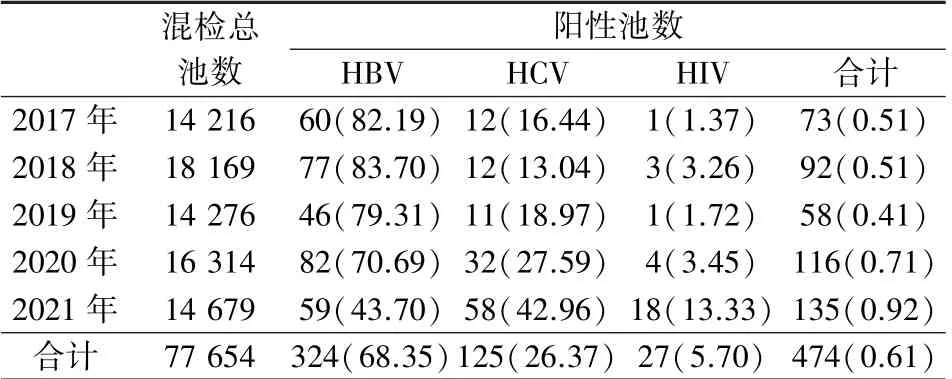
混检总池数阳性池数HBVHCVHIV合计2017 年 14 216 60(82.19) 12(16.44) 1(1.37) 73(0.51)2018 年 18 169 77(83.70) 12(13.04) 3(3.26) 92(0.51)2019 年 14 276 46(79.31) 11(18.97) 1(1.72) 58(0.41)2020 年 16 314 82(70.69) 32(27.59) 4(3.45) 116(0.71)2021 年 14 679 59(43.70) 58(42.96) 18(13.33) 135(0.92)合计77 654 324(68.35)125(26.37) 27(5.70) 474(0.61)
2.2 HBV NAT 混检阳性池拆分结果
2017—2021 年HBV NAT 混检阳性池总共为324 个,每年的拆分率大体一致,只有2021 年略有下降,见表2。

拆分阳性拆分阴性2017 年(n=60)30(50.00)30(50.00)2018 年(n=77)47(61.04)30(38.96)2019 年(n=46)25(54.35)21(45.65)2020 年(n=82)44(53.66)38(46.34)2021 年(n=59)21(35.59)38(64.41)合计167(51.54)157(48.46)
2.3 HBV NAT 混检阳性池CT 值分布区间与拆分率的相关性
拆分阳性和拆分阴性2 组中,36 <CT 值≤40区间池数占比最高分别为80.83%(135/167)、66.24%(104/157);CT 值≤36 区间池数占比分别为13.77%(23/167)、0.63%(1/157);CT 值>40 区间池数占比分别为5.39%/(9/167)、33.12%(52/157),且2 组中36<CT 值≤40 区间与其它2 区间池占比比较有差异(χ2值分别为257.03、152.05,均为P <0.05),3 个区间池的拆分率有差异(P<0.05),见表3。
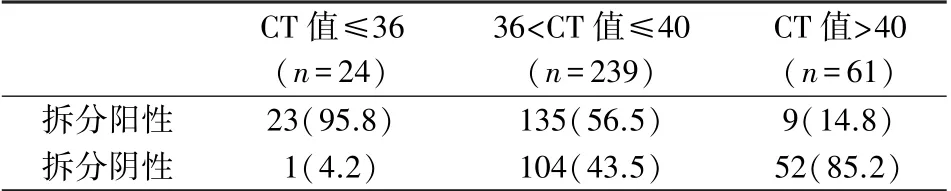
CT 值≤36(n =24)36<CT 值≤40(n =239)CT 值>40(n =61)拆分阳性23(95.8)135(56.5)9(14.8)拆分阴性1(4.2)104(43.5)52(85.2)
2.4 Cobas S201 混检阳性池拆分与Panther 联检符合情况
2022 年3 月—2023 年3 月NAT 混检标本111 620份,HBV NAT 混检阳性池有65 个。 CT 值≤36 区间的5 个阳性池,经Cobas s201 拆分和Panther 联检同时阳性,符合率为100%;CT 值>40区间的12 个阳性池,经Cobas s201 拆分和Panther联检同时阴性,符合率为100%;36<CT 值≤40 区间的48 个阳性池,2 种检测方法的符合率为81.25%,见表4。

Panther 联检阳性阴性合计Cobas s201 拆分∗阳性24529阴性41519合计282048
2.5 Cobas S201 混检阳性池拆分与Panther 联检不一致情况
2022 年3 月—2023 年3 月HBV NAT 混检阳性池48 个(36<CT 值≤40 区间),Cobas s201 首次拆分和Panther 联检结果一致的有39 个。 有9 份标本Cobas S201 首次拆分和Panther 联检结果不一致,其中有3 份标本Cobas S201 首次拆分阳性,同步Panther 联检阴性;有2 份标本Cobas S201 首次拆分阳性,同步Panther 联检首次阴性,再次联检阳性;有4 份标本Cobas S201 首次拆分为阴性,同步Panther 联检为阳性,这4 份标本中有3 份再次Cobas S201 单检为阳性,但是有1 份Cobas S201 再单检仍然阴性,见表5。
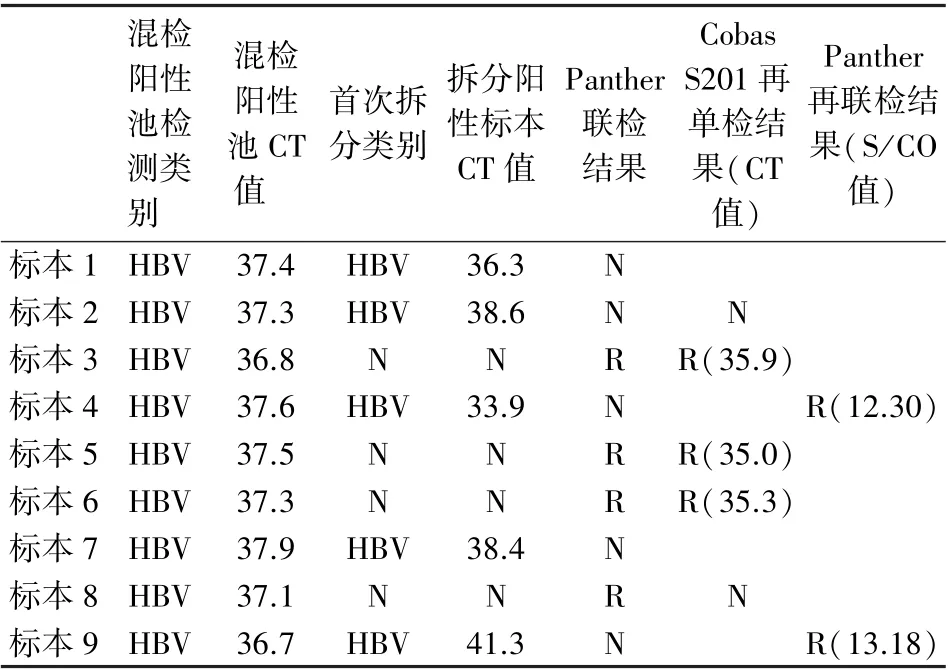
混检阳性池检测类别混检阳性池CT值首次拆分类别拆分阳性标本CT 值Panther联检结果Cobas S201 再单检结果(CT值)Panther再联检结果(S/CO值)标本1 HBV 37.4HBV36.3N标本2 HBV 37.3HBV38.6NN标本3 HBV 36.8NNRR(35.9)标本4 HBV 37.6HBV33.9NR(12.30)标本5 HBV 37.5NNRR(35.0)标本6 HBV 37.3NNRR(35.3)标本7 HBV 37.9HBV38.4N标本8 HBV 37.1NNRN标本9 HBV 36.7HBV41.3NR(13.18)
3 讨论
近年来国内外的研究数据表明,不同血液筛查方案探讨的关键点在于降低HBV 传播风险,而低病毒载量的HBV 感染是血液筛查中最为主要的风险[10-11]。 由于血清学检测无法检出隐匿性感染、不能显著缩短病毒检测的“窗口期”等缺点,因此HBV 的检测需要具有较高灵敏度的NAT 作为保证[12-13]。 目前国内采供血机构采用的NAT 系统以混样检测系统居多,对于混样检测系统初检阳性池拆分1 次阴性即放行的策略,虽然符合试剂判定规则,却低估了可能的漏检风险[14]。 因此,对HBV NAT 混样检测阳性池再拆分阴性的标本进行再检模式的探讨尤为重要。
2017—2020 年每年的HBV 阳性池占比都明显高于HCV 和HIV 阳性池,这与京津冀14 家血站核酸混样检测实验室报道的HBV 检出率明显高于HCV 和HIV 相一致[1]。 每年高比例的HBV NAT混检阳性池数可能与我国属于病毒性肝炎高流行地区有关[15],这进一步提示对于我国核酸混样检测系统中HBV 阳性池的再检要高度重视。
2017—2021 年5 年间HBV NAT 混检阳性池为324 个,拆分阴性池为157 个,占比48.46%,略高于无锡地区和东莞地区报道的40.20% 和38.75%[16-17],这充分说明目前国内应用NAT 混样系统存在一定比例的混检阳性、拆分阴性的标本。对于此类标本依据目前的判定规则是检测合格,但有研究显示混检阳性再拆分阴性的标本存在漏检的风险[18],这提示对拆分阴性的标本中存在的风险要予以重视。 成都地区报道了在19 562 份标本中发现了1 份HBV NAT 混检阳性,但初次拆分阴性、2 次拆分阳性标本[19]。 国家临检中心也建议需要考虑对初次拆分阴性的标本进行2 次拆分后再予以放行的改进型策略[7]。 可见对此类标本重复检测是1 种提高病毒检出率的有效方法,但对于重复检测标准,业内仍未统一标准。
本站采用的Cobas S201 核酸混样检测系统,其判定结果的唯一参数是每个池的CT 值。 有研究发现CT 值(HBV)是影响HBV NAT 阳性池拆分成功的主要因素,并将CT 值(HBV)≤37 作为拆分阴性池重复拆分标准,其中CT 值为36.5 时,敏感性为37.90%,特异性为98.00%;CT 值为39.3 时,敏感性为95.00%,特异性为16.30%[17]。 本研究结果显示混检池随着CT 值分布区间增大拆分率呈下降趋势,这与陈少彬等[16]报告的当HBV 反应性混检池的CT 值>36 时,随着数值增大拆分阳性率呈下降趋势相一致。 另外,拆分阳性和拆分阴性2 组中,36<CT 值≤40 区间池数占比最高,且2 组中该区间与其它2 区间池占比比较有差异,因此针对此区间HBV NAT 混检阳性池的标本,需要着重注意该区间标本的拆分率,尤其是该区间拆分阴性标本的再检情况。
本研究结果显示CT 值≤36 和CT 值>40 区间HBV NAT 混检阳性池经Cobas S201 拆分和Panther 联检符合率为100%,说明该区间的HBV NAT混检阳性池可以通过拆分结果直接判定标本,不需要另1 种检测方法的确认,既保证了血液安全又节约了再检成本。 但36<CT 值≤40 区间2 种检测方法的符合率为81.25%,48 个HBV NAT 混检阳性池经Cobas S201 首次拆分和Panther 联检结果一致的有39 个,有9 份标本Cobas S201 首次拆分和Panther 联检结果不一致。 周磊等[14]应用混检系统和单人份检测系统同时检测4 份不确定标本亦出现类似现象。 可能的原因为:1)这9 份标本中HBV病毒载量非常低,检出重复率不高,与临界检出限附近的低浓度病毒颗粒在血浆中呈现泊松分布,此时检测到病毒的可能性概率是不确定的有关;2)可能由于HBV 核酸序列发生突变,导致核酸检测试剂的靶向探针捕获不到DNA 序列,或者结合不稳定,造成2 个检测系统结果不一致,检出重复率低;另外本研究是Cobas S201 和Panther 系统同步检测,基本排除不同系统因为标本储存条件导致检测实验结果重复性不佳的原因。 9 份标本中有4 份标本Cobas S201 首次拆分为阴性,同步Panther 联检为阳性,这4 份标本中有3 份再次Cobas S201 单检为阳性,但是有1 份Cobas S201 再单检还是阴性。 可见这9 份标本中有4 份标本若只进行混样检测拆分阴性1 次即放行的策略,至少会有3 份(33.33%)标本漏检的风险,依据本研究制定的判定标准:9 份标本全部判定为不合格,遗憾的是本实验未深入对该9 份标本进行核酸定量的研究。
目前国内对于NAT 混检阳性再拆分阴性标本的确认试验已有报道:1)对该类标本可以进行2 次拆分的试验流程,出现≥1 次阳性结果都判定为不合格[7]。 该流程操作简单,可行性高,适用于单套检测系统的再判定,但需注意留取足量的检测标本;2)应用超高速离心技术与靶向病毒基因区段符合的高灵敏度巢式PCR 检测相结合的超离体系对标本进行病毒核酸的确认[20],该试验流程技术复杂,要求配套设备多,多数需要公司配合完成;3)可对该类献血者进行追踪,至少追踪2 次,间隔6 个月,通过不同的核酸检测系统进行确证,出现≥1次反应性结果都判定为不合格;同时补充乙肝核心抗体(抗-HBc)或乙肝“2 对半”检测,如抗-HBc 阳性,则可以初步判断为OBI[21],该试验流程持续时间长,需要献血者的高度配合,难度高。 本试验方案的优势在于:1)充分利用本站另1 套核酸检测系统,再检试验方便可行;2)不需要额外的标本采集,充分保证了核酸标本的检测时间以及核酸报告的发布时效;3)以前期数据为研究基础,可以有针对性的选取拆分阴性的标本(36<CT 值≤40 区间),有的放矢的缩小检测范围,即降低了漏检风险,又最大程度的节约了试剂和人力成本。
综上所述,目前NAT 混检阳性、再拆分阴性的献血者标本占有一定的比例,为避免此类标本因为病毒载量低引起漏检的风险,可以CT 值为依据有针对性的选取拆分阴性的标本进行再检。 本研究依此方法1 年检测标本111 620 份,按照本研究制定的判定规则至少避免3 份HBV NAT 混检阳性标本的漏检,同时兼顾节约成本和实验便利性。 然而,本研究仅为单中心、小样本量研究,将来可联合HBV 感染相关标志物开展多中心、大样本量的研究,从而为拆分或鉴别无反应性标本处置提供指导,最大限度降低输血HBV 残余风险。
