玉米逆境胁迫响应基因ZmTPR1 的表达和功能分析
2024-03-09曹丽茹梁小菡马晨晨叶飞宇庞芸芸李伟亚鲁晓民
曹丽茹,梁小菡,马晨晨,叶飞宇,庞芸芸,李伟亚,张 新,鲁晓民
(1.河南省农业科学院粮食作物研究所,河南 郑州 450002;2.神农种业实验室,河南 郑州 450002)
玉米(Zea mays)是重要的粮食、饲料和工业原料[1]。近十几年玉米产量一直稳步增长,但其对干旱的敏感性也在逐年增加[2-3]。作为起源于亚热带的作物,玉米喜温喜湿[4]。近年来,水资源短缺、极端天气增加、干旱环境频繁出现,我国北方和西南主要玉米种植区经常受到干旱胁迫,对玉米产量构成巨大威胁[2,5]。为了应对干旱、高温等非生物胁迫,植物进化出了各种机制来减轻胁迫对其造成的不利影响[6-7]。植物的叶绿体在这个过程中发挥了重要的作用:叶片中叶绿体含量和密度更高的植物拥有更高的光合效率,光合色素分解的更少;叶绿体还可以调节植物叶片的渗透压,降低植物的水分损失,增强植株对干旱环境的抗性[8]。
四肽重复(Tetratricopeptide repeat,TPR)蛋白家族属于螺旋重复蛋白(Helical-repeat proteins)超家族,这个超家族还包括五肽重复蛋白(Pentatricopeptide repeat,PPR)和八肽重复蛋白(Octotricopeptide repeat,OPR)家族,在植物光合器官的生物合成和功能运行方面发挥重要的作用[9]。叶绿体最初是由蓝藻进入异养真核生物细胞形成共生关系进化而来的,蓝藻内共生体转化为叶绿体细胞器,因此,叶绿体还保留着一部分自己的基因组和基因表达机制[10]。然而在进化过程中,叶绿体基因组的许多基因都整合到了宿主细胞的核基因组中,因此,叶绿体的基因表达和蛋白质合成受到核基因的调控。TPR 蛋白是一类从细胞质进入叶绿体的蛋白质,主要参与辅助蛋白质进入叶绿体、参与叶绿体基因表达、辅助光合作用复合体的组装与稳定,以及参与叶绿素的生物合成等过程[9]。例如:叶绿体外膜和内膜上的转运子(TOC 和TIC)可以通过直接识别前体蛋白或识别伴侣蛋白与前体蛋白的复合体帮助叶绿体蛋白进入叶绿体[11]。TPR家族蛋白也参与植物响应生物和非生物胁迫过程,并发挥重要的作用。对拟南芥(Arabidopsis thalianaL.)中TTL1(Tetratricopeptide-repeat thioredoxin-like 1)基因进行研究发现,当TTL1基因缺失突变时,植株对渗透胁迫和盐胁迫的耐受性下降,根部发育减缓,种子萌发和幼苗生长过程中的渗透反应减弱,表明TPR 家族基因可能参与响应多种胁迫过程[12]。另外,拟南芥中TPR蛋白MET1(Methyltransferase 1)参与了光系统Ⅱ的形成和重新装配[13]。目前,尚未见玉米中TPR 基因在逆境胁迫下的功能研究。因此,挖掘更多TPR 家族中能够响应胁迫的基因对提高玉米在胁迫环境中的耐受性具有重要意义。
前期对正常浇水、干旱胁迫和复水处理的玉米幼苗叶片和根进行了转录组测序[14]。在此基础上,发现了一个响应干旱胁迫和复水处理的基因ZmTPR1,对该基因进行生物信息学分析,并探究其在不同组织及逆境胁迫下的表达模式,利用CRISPR-Cas9 技术敲除拟南芥中的同源基因AtTPR1,分析干旱胁迫条件下纯合突变体植株的表型和生理生化指标,初步探究该基因的功能,为培育抗旱玉米品种提供基因资源。
1 材料和方法
1.1 试验材料
供试玉米材料为抗旱玉米自交系郑36 和敏旱玉米自交系B73,CRISPR-Cas9载体为PKI1.1R。
1.2 ZmTPR1基因的生物信息学分析
使用植物基因组数据库Ensembl Plants(http:∕∕plants.ensembl.org∕index.html)查 找ZmTPR1(Zm00001d044594)基因的基因组DNA、外显子-内含子结构、cDNA 以及其所编码的蛋白质氨基酸序列 。 利 用 在 线 网 站 SMART(http:∕∕smart.embl-heidelberg.de∕)预测ZmTPR1基因编码蛋白质的保守结构域。通过在线网站Expasy Protparam(http:∕∕web.expasy.org∕protparam∕)分析ZmTPR1 蛋白的相对分子质量、理论等电点、亲水系数、不稳定系数以及氨基酸组成成分。使用在线网站PSORT(http:∕∕psort1.hgc.jp∕form.html)预测ZmTPR1 蛋白的亚细胞定位。
通过在线网站NCBI(https:∕∕www.ncbi.nlm.nih.gov∕)获取玉米、野生稻(Oryza brachyantha)、高粱(Sorghum bicolor)、谷子(Setaria italica)、狗尾草(Setaria viridis)、黍(Panicum hallii)和柳枝稷(Panicum virgatum)等物种的ZmTPR1 同源蛋白氨基酸序列,并利用线上软件MEME(https:∕∕meme-suite.org∕meme∕tools∕meme)分析蛋白质的保守基序,使用MEGA 软件ClustalW 比对后,使用NJ(Neighbor-joining)法构建系统发育进化树。最后使用在线网站PlantCARE(http:∕∕bioinformatics.psb.ugent.be∕webtools∕plantcare∕html∕)分析ZmTPR1基因启动子区域2 000 bp内的顺式作用元件。
1.3 组织表达分析样品的采集
选取田间正常生长的玉米自交系B73,取三叶期的幼根、幼茎、幼叶以及成熟期的根、茎、叶、雄穗、雌穗等组织的样品,通过荧光定量PCR(Real-time quantitative PCR,qRT-PCR)检测ZmTPR1基因表达情况。
1.4 非生物胁迫处理试验
选取玉米自交系郑36 和B73 饱满的籽粒,于温室(28 ℃,16 h 光照∕8 h 黑暗)中培养。当幼苗生长14 d 后,选择长势一致整齐的三叶期幼苗进行各种胁迫处理,其中B73 仅进行干旱胁迫处理。干旱(D)胁迫:利用20%PEG-6000(Hoagland 营养液+20%PEG-6000)进行处理;高温(H)胁迫:将温度升高至42 ℃进行处理;盐(Cl)胁迫:利用200 mmol∕L的NaCl 进行处理;缺氮(N)胁迫:使用缺乏铵态氮的Hoagland 营养液进行处理。分别在处理后0、4、8、12、24、32、36、48、52、60、72、84 h 及恢复(R)处理后的12、24、36 h对叶片进行取样,采用qRT-PCR检测ZmTPR1基因表达水平。
1.5 RNA的提取、cDNA的合成和基因表达分析
取0.1 g 玉米组织样品,在液氮中磨碎,用TRIzol 法提取试剂盒(Invitrogen)提取样品总RNA。使用浓度测定仪检测其浓度和纯度,用1%琼脂糖凝胶电泳检测总RNA 的质量。取1µg 总RNA 使用Prime-ScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)反转录成cDNA,并稀释至100 g∕L,用于qRT-PCR扩增。
根据目的基因的保守性,使用NCBI 设计特异性引物(Zm00001d044594-上游引物:CCAGCAACAAGCCGTCAAAGA;Zm00001d044594-下游引物:CGGCTTTTGTTTCCACGTCT)。以100 g∕L 的cDNA为模板进行qRT-PCR 扩增,反应体系包括10µL 的酶(Hieff qPCR SYBR Green Master Mix No Rox,翊圣公司),0.4µL的上、下游引物,1µL的cDNA,8.2µL的ddH2O。以玉米18S rRNA(18S-上游引物:CCTGCGGCTTAATTGACTC;18S-下游引物:GTTAGCAGGCTGAGGTCTGG)为内参基因。反应程序:95 ℃预变性5 min,95 ℃变性10 s、60 ℃退火30 s,40 个循环。采用2-△△CT法计算基因的相对表达量[15],每个处理3个生物学重复。
1.6 基于CRISPR-Cas9拟南芥tpr1突变体的获取和抗旱性检测
根据ZmTPR1基因序列寻找拟南芥中的同源基因(AtTPR1,AT1G48280),参考TSUTSUI等[16]的方法构建CRISPR-Cas9 载体。首先通过CRISPRdirect网站(http:∕∕crispr.dbcls.jp∕)在线分析sgRNA 结构,寻找靶点位置,然后通过CCTOP 网站(https:∕∕cctop.cos.uni-heidelberg.de∕)评估脱靶情况,筛选靶点,最终将位于AtTPR1基因第1 个外显子的79—98 bp 碱基序列作为靶点,设计sgRNA 引物,靶点相邻基序(Protospacer adjacent motif,PAM)为CGG(图1)。sgRNA上游引物:5'-ATTGCCTAGAGCACAAGACGATAA-3';下游引物:5'-AAACGGATCTCGTGTTCTGCTATT-3'。分别取5 µL 100 µmol∕L 上、下游引物进行100 ℃、5 min 退火,然后自然冷却至室温,同时用AarⅠ限制性内切酶酶切CRISPR-Cas9 载体PKI1.1R,凝胶回收后使用T4 连接酶将靶点序列连接到PKI1.1R载体上,并将其转化至大肠杆菌DH5α感受态细胞中,用Spec 抗性平板筛选阳性克隆,最后将阳性质粒转化农杆菌GV3101。

图1 sgRNA靶向AtTPR1基因编码区的位置Fig.1 Location of sgRNA targeting the coding region of AtTPR1 gene
经PCR 验证后将阳性菌落使用花序侵染法侵染野生型拟南芥植株(Col-0),并收获成熟种子T0。使用潮霉素抗性培养基筛选出阳性幼苗后继续种植并收获,即为T1种子。直至筛选到纯合的T3种子,分别命名为Attpr1-1、Attpr1-2、Attpr1-3。
将野生型和Attpr1-1、Attpr1-2、Attpr1-3 突变体种子播种在1∕2MS培养基上生长5 d,然后移栽至营养土中继续生长,待长出第5片真叶时,对植株进行干旱胁迫处理(土壤含水量45%),观察植株的表型差异。
1.7 生理生化指标的测定
在野生型和Attpr1-1、Attpr1-2、Attpr1-3 突变体干旱胁迫处理后0、3、5 d 对叶片进行取样,测定叶绿素(Chl)含量、净光合速率(Pn)、相对含水量(RWC)、丙二醛(MDA)含量、过氧化物酶(POD)和超氧化物歧化酶(SOD)活性。Chl 含量采用95%乙醇法测定;叶片的RWC 通过称质量法测定;Pn 采用开放式红外气体分析系统(Li-COR6400,Lincoln,NE,USA)测定;MDA 含量用硫代巴比妥酸法测定;SOD 活性采用NBT 法测定;POD 活性采用愈创木酚法测定。
2 结果与分析
2.1 玉米逆境胁迫响应基因ZmTPR1在干旱-复水处理下的表达分析
对前期转录组数据[14]进行分析发现,ZmTPR1基因受干旱诱导上调表达,复水后表达量稍微下降(图2)。进一步利用qRT-PCR 试验验证转录组数据的准确性,发现qRT-PCR试验结果与转录组数据结果类似,ZmTPR1基因均在干旱胁迫5 d表达量大幅升高,复水后有所降低。推测ZmTPR1基因在玉米干旱胁迫响应中起着重要的作用。

图2 ZmTPR1基因在干旱-复水处理下的表达分析Fig.2 Expression level of ZmTPR1 gene under drought and rehydration
2.2 ZmTPR1基因的生物信息学分析
对ZmTPR1基因序列进行分析,发现该基因位于玉米的第3 号染色体,编码区长1 266 bp,有6 个外显子,编码421 个氨基酸(图3A)。对ZmTPR1 蛋白的保守结构域进行预测,发现ZmTPR1 具有一段卷曲螺旋(Coiled coil)结构域(图3B)。

图3 ZmTPR1基因结构(A)及其编码蛋白质的保守结构域(B)Fig.3 ZmTPR1 gene structure(A)and conserved domain(B)of ZmTPR1 protein
利用Expasy Protparam 网站对ZmTPR1基因编码的氨基酸序列进行理化性质分析,发现ZmTPR1蛋白分子式为C2010H3280N604O619S12;分子质量为46.2 ku;理论等电点为9.94;带负电荷的残基(Asp+Glu)总数为43,带正电残基(Arg+Lys)总数为61,为碱性蛋白质;亲水系数为-0.533,为亲水性蛋白质;不稳定系数为65.27,属于不稳定蛋白质。对ZmTPR1蛋白的氨基酸组成成分进行分析(表1),发现Ser(S)含量最多,占11.9%;其次为Ala(A),占11.4%;Cys(C)含量最少,占0.5%。

表1 ZmTPR1蛋白的氨基酸组成Tab.1 Amino acid composition of ZmTPR1 protein
探究蛋白质的亚细胞定位对研究蛋白质的功能至关重要。本研究对ZmTPR1蛋白的亚细胞定位进行预测(表2),发现该蛋白质分布在线粒体上的概率为0.714,分布在叶绿体上的概率为0.286,推测ZmTPR1基因可能在线粒体或叶绿体中发挥功能。

表2 ZmTPR1蛋白的亚细胞定位预测Tab.2 Subcellular localization prediction of ZmTPR1 protein
2.3 ZmTPR1蛋白系统进化及保守基序分析
对玉米、野生稻、高粱、谷子、狗尾草、黍和柳枝稷中的ZmTPR1 同源蛋白进行系统进化分析,发现与ZmTPR1 进化距离最近的是高粱中的同源蛋白,即亲缘关系最近;与野生稻和柳枝稷的进化距离最远,即亲缘关系最远(图4A)。对上述7 个物种TPR1蛋白的保守基序进行分析,发现这7个物种含有6 个相似的保守基序(图4B—C),说明它们之间可能存在某种相似的生物学功能。除此之外,野生稻的TPR1 蛋白的保守基序距离N 端较近,这可能是导致其和玉米亲缘关系较远的原因。

图4 ZmTPR1蛋白与其他物种同源蛋白的进化树(A)及保守基序位置分布(B)和序列(C)Fig.4 Evolutionary tree(A),distribution(B)and sequences(C)of conserved motifs of ZmTPR1 protein
2.4 ZmTPR1基因启动子区顺式作用元件分析
对ZmTPR1基因ATG 上游2 000 bp的启动子区域的顺式元件进行预测(表3),发现在ZmTPR1基因启动子区域存在多个胁迫响应元件,该区域除了常见的顺式作用元件,如29 个参与光响应的元件(1个AE-box、14 个G-Box、1 个GATA-motif、2 个Ibox、6个Sp1、4个TCCC-motif、1个TCT-motif),还包含了14 个茉莉酸甲酯(MeJA)结合位点(7 个TGACG-motif、7 个CGTCA-motif),7 个参与干旱诱导的MYB 结合位点(1个CCAAT-box、6个MBS),13个参与脱落酸(12 个ABRE)、赤霉素(1 个GAREmotif)等植物激素响应的顺式作用元件,以及3个和缺氧诱导相关的顺式作用元件(2 个ARE、1 个GCmotif),这说明ZmTPR1基因可能参与玉米对植物激素、干旱等胁迫的响应。
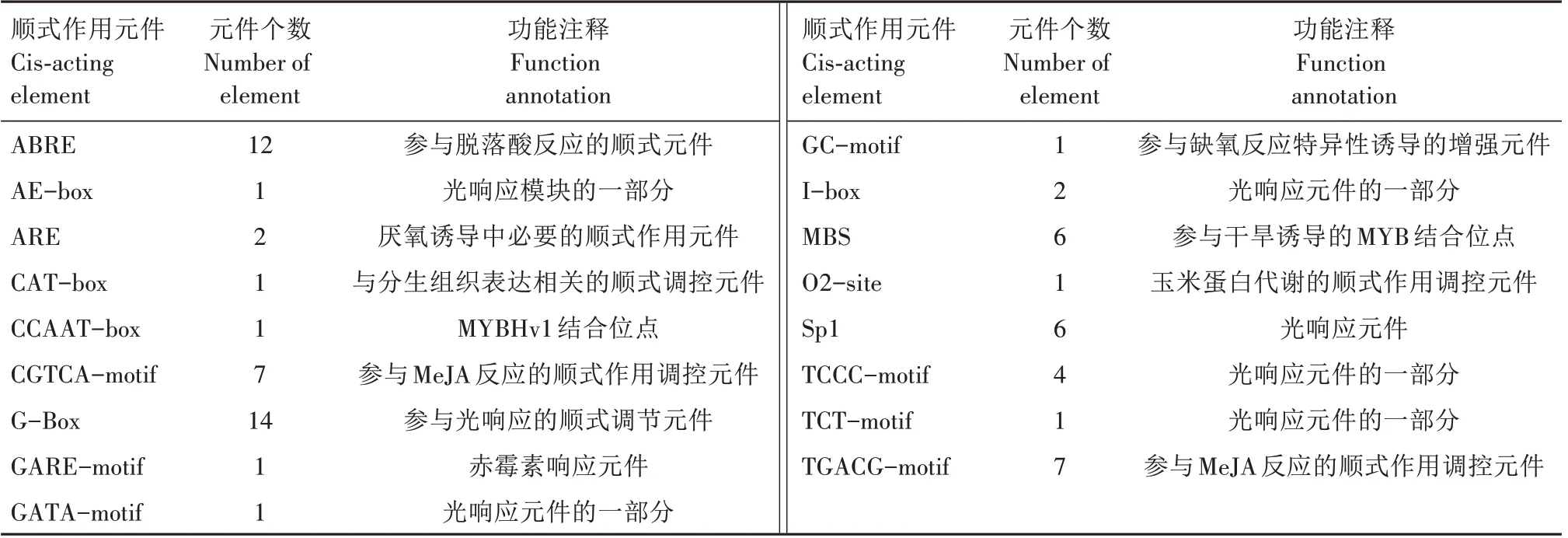
表3 ZmTPR1基因启动子区顺式元件分析Tab.3 Cis-acting element analysis in ZmTPR1 gene promoter region
2.5 ZmTPR1基因在玉米不同组织中的表达分析
对ZmTPR1基因在玉米三叶期的幼根、幼茎、幼叶以及成熟期的根、茎、叶、雄穗、雌穗等组织中的表达情况进行分析(图5),发现该基因在所有检测的组织中均有表达,但在不同时期、不同组织中的表达情况存在明显差异。其中,在幼茎的表达量最高,在幼叶和幼根中的表达量次之,在雄穗中的表达量最低。

图5 ZmTPR1基因在玉米不同组织中的表达分析Fig.5 Expression level of ZmTPR1 gene in different tissues of maize
2.6 ZmTPR1基因在非生物胁迫条件下的表达分析
为探讨ZmTPR1基因在逆境胁迫下的表达模式,对ZmTPR1基因在干旱、高温、盐和缺氮胁迫下的表达量进行分析(图6),发现在4 种胁迫处理后,ZmTPR1基因的表达量均显著或极显著上调。在干旱处理后,ZmTPR1基因的表达量总体上呈先升高后降低的趋势,在24 h 达到最高,随后逐渐降低,并在复水后继续缓慢下降,但均极显著高于0 h(图6A)。在高温胁迫处理后,ZmTPR1基因的表达量总体上呈先升高后降低的趋势,在36 h 达到最高,随后逐渐降低,并在复水后继续缓慢下降,但均极显著高于0 h(图6B)。在盐胁迫处理条件下,ZmTPR1基因表达量总体上先缓慢上升,在48 h 达到最高,随后逐渐降低,并在复水后继续缓慢下降,但均极显著高于0 h(图6C)。在缺氮胁迫处理后,ZmTPR1基因表达量在36 h时达到峰值,较0 h极显著提高约2 倍,其余时间(24 h 除外)及胁迫条件解除后表达量均显著或极显著低于0 h(图6D)。以上结果表明,干旱、高温、盐和缺氮胁迫均可诱导ZmTPR1基因的表达,暗示ZmTPR1基因可能在植物响应非生物胁迫的过程中发挥着重要的作用。
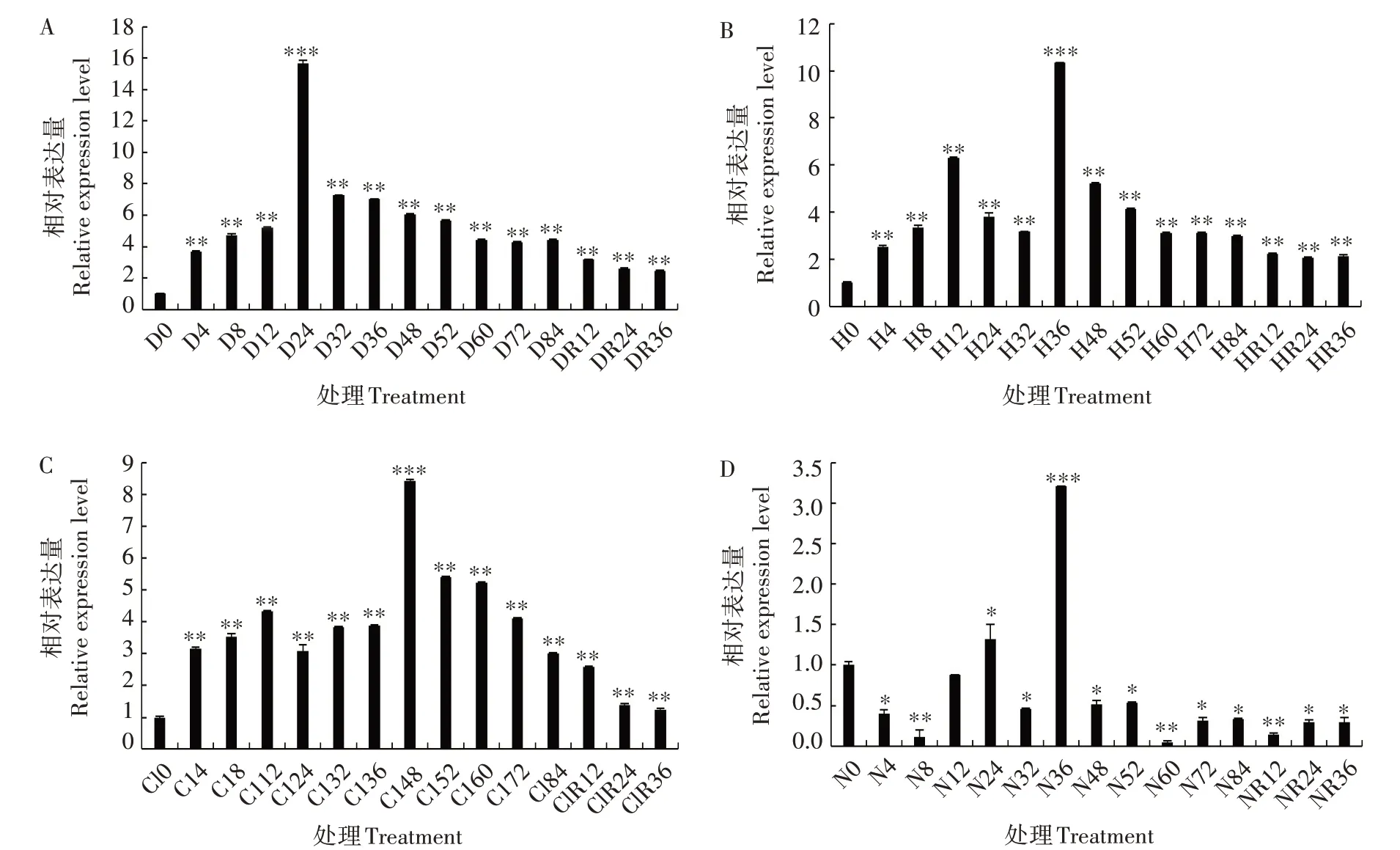
图6 ZmTPR1基因在干旱(A)、高温(B)、盐(C)和缺氮(D)胁迫下的表达分析Fig.6 Expression level of ZmTPR1 gene under drought(A),high temperature(B),NaCl(C)and nitrogen deficiency(D)stresses
2.7 不同基因型自交系中ZmTPR1基因在干旱胁迫条件下的表达分析
由于干旱胁迫可以诱导ZmTPR1基因的表达,为了进一步探究ZmTPR1基因与玉米材料抗旱性之间是否有关系,对不同抗旱能力玉米自交系中ZmTPR1基因在干旱胁迫条件下的表达模式进行分析(图7),发现ZmTPR1基因在郑36 和B73 中的相对表达量在干旱胁迫后都持续上升,在24 h 时达到了最高;干旱胁迫处理后,ZmTPR1基因在郑36 中的相对表达量始终极显著高于B73,在处理24 h时,郑36 中ZmTPR1基因相对表达量达到B73 的3 倍。可见,ZmTPR1基因的表达水平与玉米材料的抗旱性存在十分紧密的关系。

图7 ZmTPR1基因在干旱胁迫下的表达模式分析Fig.7 Analysis of ZmTPR1 expression pattern under drought stress
2.8 拟南芥Attpr1突变体的抗旱性鉴定
由图8A 可知,干旱胁迫处理前,Attpr1-1、Attpr1-2 和Attpr1-3 突变体表型与野生型没有明显差异;干旱胁迫处理3 d,突变体生长受到抑制,叶片出现明显萎蔫,而野生型只有轻微萎蔫;干旱胁迫处理5 d,野生型出现叶片失水萎蔫,而突变体则出现严重萎蔫,叶片失绿,甚至枯死。说明缺失AtTPR1基因使拟南芥植株的抗旱性下降,对干旱胁迫更加敏感。
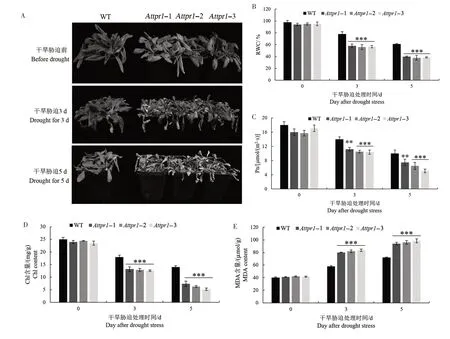
图8 拟南芥Attpr1突变体在干旱胁迫下的表型和生理指标分析Fig.8 Seedling phenotypes and physiological indices of Attpr1 mutants under drought stress
由图8B可知,干旱胁迫处理前,野生型RWC与突变体没有明显差异;干旱胁迫处理3 d,野生型RWC 降为78%,而Attpr1-1、Attpr1-2 和Attpr1-3 突变体分别为58%、56%和57%;干旱胁迫处理5 d,Attpr1-1、Attpr1-2 和Attpr1-3 突变体RWC 分别为40%、38%和39%,极显著低于野生型(61%)。
由图8C 可知,干旱胁迫处理前,野生型与突变体的Pn 无显著差异;随着干旱胁迫处理时间的延长,野生型和突变体的Pn 均呈下降趋势,与野生型相比,突变体Pn 下降幅度更大。对于Chl 含量来说,干旱胁迫处理前,野生型与突变体无显著差异;随着干旱胁迫处理时间延长,野生型和突变体的Chl 含量均呈下降趋势,但突变体下降幅度大于野生型(图8D)。
由图8E 可知,在干旱胁迫处理前,野生型和突变体的MDA含量没有显著差异;随着干旱胁迫处理时间的延长,野生型和突变体的MDA含量均呈上升趋势,但突变体上升幅度大于野生型。在干旱胁迫处理3 d,野生型MDA 含量达到58µmol∕g,Attpr1-1、Attpr1-2、Attpr1-3 突变体MDA 含量分别为80、82、83 µmol∕g,极显著高于野生型;在干旱胁迫处理5 d,突变体MDA 含量依然极显著高于野生型。由图8F—G 可知,在干旱胁迫处理前,野生型和突变体的POD、SOD 活性均没有显著差异;随着干旱胁迫处理时间的延长,野生型和突变体的MDA含量均呈上升趋势,但突变体上升幅度小于野生型。干旱胁迫处理3 d,Attpr1-1、Attpr1-2 和Attpr1-3 的POD活性分别较野生型降低16%、15%和16%,SOD活性分别降低31%、32%和29%;干旱胁迫处理5 d,Attpr1-1、Attpr1-2 和Attpr1-3 突变体POD 活性比野生型分别降低17%、17%和15%,SOD活性分别降低20%、21%和18%。
综上所述,AtTPR1基因的缺失降低了拟南芥植株的RWC、Pn、Chl 含量和POD 活性、SOD 活性,提高了MDA含量,进而降低了抗旱性。
3 结论与讨论
TPR 属于螺旋重复蛋白超家族,该家族成员均含有TPR 基序,该基序通常串行排列,每个基序都能折叠成2~3 个反平行的α-螺旋,重复的基序通常形成一个α-螺线管的结构域,作为与DNA 或其他蛋白质相互作用的结合支架[17-18]。前人研究发现,许多TPR 蛋白参与光合作用器官叶绿体的生物合成,光合作用是一个十分复杂的过程,需要脂质、色素分子、金属辅助因子以及数十种蛋白质协同合作发挥作用[19]。而TPR蛋白几乎参与了叶绿体合成和光合作用的所有步骤,并在某些方面发挥了至关重要的作用,包括辅助蛋白质进入叶绿体,调节叶绿体内的基因表达,组装和稳定光合作用复合体,以及参与合成叶绿素[9]。例如:拟南芥中的TPR 蛋白Pyg7 定位于叶绿体基质类囊体膜,参与光系统Ⅰ(PSⅠ)的组装过程[20]。虽然目前对TPR 蛋白的研究已经有了一些进展,但对玉米中的TPR 家族研究报道较少,且功能未知,需要进一步研究。
本研究从玉米转录组数据中发现了一个受干旱胁迫上调表达的TPR基因,将其命名为ZmTPR1,并对其进行了初步探究。经分析发现,ZmTPR1 蛋白具有一段卷曲螺旋结构,符合螺旋重复蛋白的结构特征,其分别有0.714 和0.286 的概率定位在线粒体和叶绿体上。研究发现,在100 多个真核生物的TPR 蛋白中,预测有1∕5 到1∕6 的成员定位在叶绿体上[21],说明本研究对ZmTPR1 蛋白的亚细胞定位预测结果较准确。拟南芥中的SG1(Slow-greening 1)编码一个定位在叶绿体的含有四肽重复序列的蛋白质,SG1的缺失会打乱与叶绿体发育、光合作用和叶绿素生物合成相关基因的表达水平,证明SG1 蛋白是拟南芥叶绿体发育所必需的[22]。对ZmTPR1基因启动子区域的顺式作用元件进行预测,发现该基因启动子区域除了含有常规的与光响应有关的元件外,还含有参与干旱、MeJA、脱落酸、赤霉素等胁迫环境和激素响应的元件,说明该基因可参与玉米对植物激素、干旱等胁迫的响应。
为进一步探究ZmTPR1基因是否参与植物响应逆境胁迫,本研究对三叶期玉米幼苗进行干旱、高温、盐和缺氮胁迫,发现在4 种非生物胁迫下ZmTPR1基因的表达量均显著或极显著升高,其中干旱胁迫后ZmTPR1基因表达量升高最明显,说明ZmTPR1基因可能在植物响应上述胁迫尤其是干旱胁迫的过程中发挥着重要的作用。另外,ZmTPR1基因在干旱胁迫处理下不同抗旱类型玉米自交系郑36 和B73 中的表达模式结果表明,ZmTPR1基因的表达量均有所上升,但在郑36中的相对表达量始终高于B73,该结果佐证了ZmTPR1基因帮助玉米响应干旱胁迫,并预示ZmTPR1基因表达量与玉米抗旱能力呈正相关。本研究还在拟南芥中将ZmTPR1的同源基因敲除,观察缺失突变体Attpr1-1、Attpr1-2 和Attpr1-3 在干旱胁迫后的表型和生理指标变化,发现干旱胁迫后缺失突变体比野生型植株萎蔫的更严重,缺失突变体的RWC、Chl含量、Pn、POD和SOD活性均较野生型极显著降低,MDA含量极显著升高,说明缺失AtTPR1基因使拟南芥植株的抗旱性下降。本研究结果为进一步研究玉米TPR家族基因的功能奠定基础,同时为培育抗旱玉米品种提供基因资源。
