地质实验测试中高品位铁的测定
2024-03-09王长萍蔡万山
王长萍,蔡万山
(甘肃有色金属地质勘查局白银矿产勘查院,甘肃 白银 730900)
0 引言
当前,地质实验测试中全铁的测定主要采用火焰原子吸收法[1],其优点为前处理简单、仪器分析速度快,但仅满足于较低含量(0.001%~10.000%)的样品,10%以上品位的样品只能通过稀释来进行测定,而稀释会增加误差。通过长期工作经验发现,其测试结果往往与国家标准方法GB/T 6730.65—2009《全铁含量的测定三氯化钛还原重铬酸钾滴定法》的结果存在较大误差。而国家标准方法重铬酸钾法(即氯化亚锡-氯化汞-重铬酸钾法)也存在试剂种类、添加方式、样本中杂质含量、污染环境(汞)等诸多因素限制[2]。因此,目前普遍在探索使用不含汞的试验方法,以降低对环境的污染和对操作人员身体健康的损害。本实验介绍了一种新型的铁元素测定法,即SnCl2-TiCl3-K2Cr2O7滴定法[3],该方法具有保护环境、简便快速、节省试剂和测定时间短等优点。
1 实验部分
1.1 试剂和仪器设备
本方法实验用水均为去离子水,试剂为分析纯。
(1)60 g/L氯化亚锡溶液:在电子天平上称取6 g SnCl2·2H2O,将其溶解于20 mL的浓HCL中,加入蒸馏水稀释定容至100 mL。
(2)硫磷混酸:将200 mL浓硫酸缓慢倒入500 mL蒸馏水中,并不断搅拌。等其冷却后,再加入300 mL浓磷酸,将其搅拌均匀。
(3)250 g/L钨酸钠溶液:将25 g钨酸钠溶解在少量的蒸馏水中,加入浓磷酸5 mL,再加入蒸馏水稀释定容至100 mL。
(4)(1+19)三氯化钛溶液:准确抽取15%~20%的三氯化钛溶液1 mL,用(1+9)HCI稀释至20 mL,添加液态石蜡进行保护。
(5)2 g/L二苯胺磺酸钠溶液。
(6)6 mol/L浓盐酸。
(7)K2Cr2O7标准液:将在150 ℃烘箱中烘干2 h的K2Cr2O7(AR或基准试剂)称取一定量后溶解在蒸馏水中,将其转移至1000 mL容量瓶中,加入蒸馏水稀释、定容,随后将其摇匀待用。
(8)样品:本次实验采用有证国家标准物质:GBW07162(全铁(T(Fe)):4.68%±0.15%);GBW07163(全铁(T(Fe)):8.40%±0.03%);GBW07164(全铁(T(Fe)):11.40%±0.14%);GBW07165(全铁(T(Fe)):19.6%±0.2%);GBW07264(全铁(T(Fe)):20.99);Fe-75-03(全铁(T(Fe)):26.66%);GBW07166(全铁(T(Fe):29.6%);72-Fe-02(全铁(T(Fe)):39.62%)。
(9)ME204E电子天平:梅特勒托利多上海有限公司。
(10)GHP600P电热板:奥普乐石墨电热板。
(11)移液管、滴定管、烧杯、容量瓶:天津玻璃仪器厂。
1.2 实验方法
在电子天平上准确称量0.15~0.20 g铁矿石试样置于100 mL烧杯中,加入少量蒸馏水湿润样品,随后加入10~20 mL浓盐酸,置于电热板加热溶解10~20 min,使样品完全溶解后,取下冷却至室温,加入60 g/mL SnCl2溶液滴至淡黄色后,加蒸馏水稀释至100 mL。滴加250 g/L钨酸钠溶液15滴,再加入(1+19)三氯化钛溶液直至溶液颜色转变为蓝色,然后缓慢加入重铬酸钾的标液使溶液最终变为无色(不计读数)。快速移取10 mL硫磷混酸加入无色溶液,并滴加5滴2 g/mL二苯胺磺酸钠,随后立即滴加配制好的K2Cr2O7标准液,直到溶液变为蓝紫色,并保持稳定不再变色。记录滴定所用K2Cr2O7标准液体积,通过公式计算得到试样中铁含量。
1.3 实验原理
本次实验采用新型无汞的SnCl2-TiCl3联合还原测Fe方法[4],基本原理为将已经经过前处理并满足实验需要的样品用浓盐酸加热分解,反应方程式为:
在样品完全分解后,在剩余的少量溶液中加入SnCl2溶液,SnCl2可以将溶液中的大部分Fe3+还原为Fe2+,溶液颜色从红棕色变为淡黄色。之后用钨酸钠作为滴定指示剂,利用TiCl3将剩下的少部分Fe3+还原为Fe2+,再加1~2滴三氯化钛溶液,将钨酸钠还原成蓝色。最后加入少许重铬酸钾溶液,使剩余三氯化钛氧化,直至溶液无色。在此过程中,发生的反应为:
至此,溶液中的Fe3+基本全部还原成Fe2+,再加入硫磷混酸,并用二苯胺磺酸钠溶液作为指示剂,用K2Cr2O7标准液滴定,直到溶液颜色呈紫色并稳定,即为指示终点。在酸性溶液中:
针对在实验中持续产生的Fe3+(黄色)影响最终测定结果的问题,目前最常使用的办法是加入磷酸,磷酸与Fe3+反应会生成无色磷酸铁络合物,有效减少Fe3+(黄色)对结果的干扰,以便准确观察最终的滴定终点。由于Fe(HPO4)2-的生成,Fe3+的浓度大幅下降,避免了Fe3+氧化二苯磺酸钠而过早改变溶液颜色导致提前到达滴定终点的问题,使滴定分析过程更为准确[5]。
根据记录的滴定使用的K2Cr2O7标准液体积(V),通过计算可以得到本次实验铁矿石样品中铁元素的含量,具体计算式为:
2 结果与讨论
2.1 实验结果
按照实验方法,进行了六次分析试验,测定得到六份试样的全铁(T(Fe))含量,结果如表1所示。
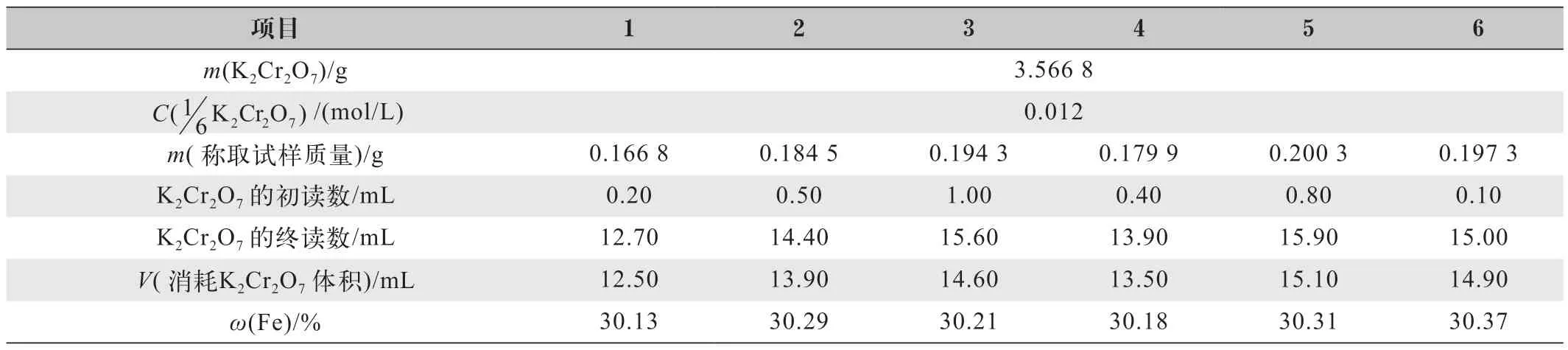
表1 GBW07823测定结果
2.2 准确度和精密度
本次试验准确度分析依据DZ/0130.3—2006《地质矿产实验室测试质量管理规范》第三部分:岩石矿物样品化学成分分析,标准物质的分析结果相对误差允许限(YB)与分析结果和标准值的相对误差(RE)进行比较判定。通过数据统计判定,本次试验六次分析结果全部合格且相对误差较小,说明本方法具有较高的准确度,结果如表2所示。
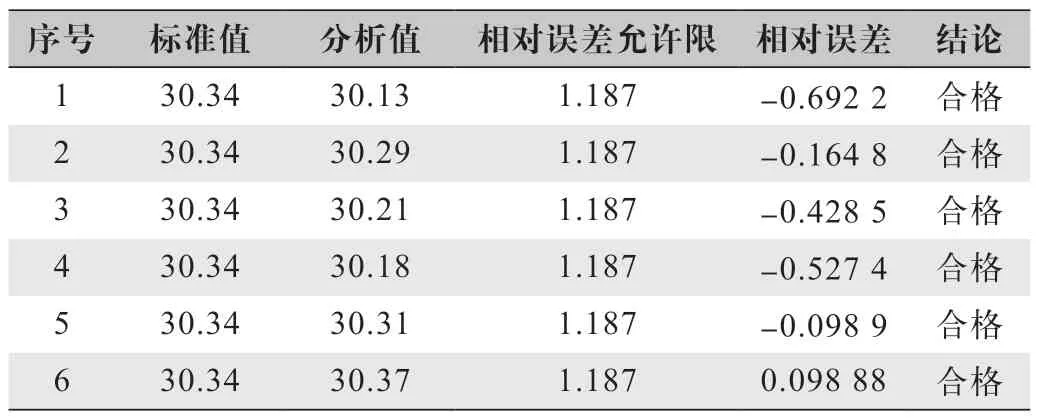
表2 准确度分析表
式(3)~式(4)中:C为全铁(T(Fe))重复分析相对偏差允许限系数1.00;X0为标准物质的标准值。
精密度采用计算六次分析结果的相对标准偏差来进行判定。通过计算,本次试验六次分析结果的相对标准偏差RSD=0.30%<1.50%,表明此方法有较好的精密度,结果如表3所示。

表3 精密度分析表
式中:S为多次测量值的标准偏差;为多次测量值的平均值。
2.3 方法比对
本次试验方法与国家标准GB/T 6730.65—2009《全铁含量的测定三氯化钛还原重铬酸钾滴定法》进行方法比对,对测定结果显著性差异进行试验分析,选取含量在4%~40%的国家标准物质8个,分别采用本文试验方法与国家标准方法进行试验分析,以本次试验测定结果(A)和国家标准方法测定结果(B)获得该标准物质试样测定结果配对差值(A-B),计算出配对差值的算术平均值及配对差值的标准偏差Sd,并计算检验统计量t,n=8时,查得p=1-a=0.95的p分位数为0.347。通过计算得到t=1.63>0.347,试验结果表明本文试验方法与国家标准方法的测定结果没有显著性差异,结果如表4所示。其计算公式为:

表4 配对测定记录表
3 影响因素分析
3.1 溶样对实验的影响
样品在溶解过程中,为防止FeCl2的挥发和溶液的飞溅,建议在烧杯上放置相应尺寸的表面皿。若酸挥发太快太多,应加入适量盐酸,以保证溶液中的盐酸含量不少于10 mL[6],确保样品能充分溶解。在对样品进行溶解时,为了防止FeCl3的挥发,溶解温度不宜过高,并尽量避免蹦溅,以保证样品的品质及稳定性。
本次试验采用奥普乐可控温石墨电热板(GHP600P)对溶样最适温度进行探究,在盐酸加入量为15 mL、溶解时间为20 min时,试验发现在低于230~250 ℃的条件下,试样的溶出速度变慢,并且溶解不完全,而在高于230~250 ℃的条件下,由于盐酸的快速挥发致使浓度减小,试样也不能完全溶解。实验结果证明,溶解温度在230~250 ℃左右的条件下,样品能够充分溶解,且不会产生蹦溅现象,具体实验现象如表5所示。
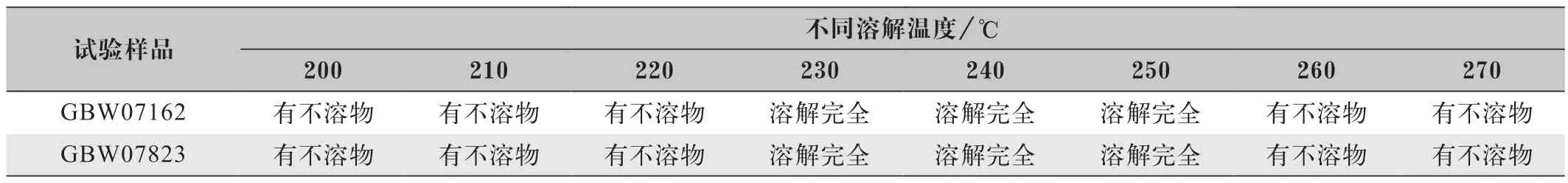
表5 采用不同溶解温度下的试验现象
3.2 温度对实验的影响
在进行氧化、还原以及滴定时,为了保证化学反应的稳定性,最好将溶液温度保持在20~30 ℃之间。在此温度范围内测定的样品含量结果具有较好的准确性[7]。在SnCl2和TiCl3还原Fe3+的过程中,温度过低会导致反应速率变慢,颜色褪去过程不便于观察,易导致SnCl2和TiCl3的加入量偏多。因此,需要对体系温度进行严格调控,否则会使结果产生偏差。
3.3 SnCl2的用量对测定结果的影响
当其他检测参数保持恒定时,改变SnCl2的加入比例,会明显改变检测结果。通过试验发现,如果SnCl2用量不足,则需要较多TiCl3来还原残留的Fe3+,同时由于过量Ti的加入,在加水稀释时会出现较多四价钛盐析出物,使测定结果偏低,进而影响分析精度[8]。当SnCl2的加入量过多时,在加入Na2WO4后会形成不稳定的蓝色,在加入(1+19)TiCl3并摇动到出现钨蓝色的过程中,会使测量值偏高,并且重现性差。因此SnCl2用量过多或过少均会引起测定结果的偏离或错误。
3.4 硫磷混酸在滴定过程中的作用
磷酸是一种强酸,并存在着较强的配位作用。在滴定过程中,Fe3+出现的黄色对正确判定终点有很大影响[9]。因此,加入H3PO4后,磷酸和Fe3+会生成可溶性无色配位化合物H3[Fe(PO4)2]和H[Fe(HPO4)2],可有效去除Fe3+颜色干扰。试验发现,添加磷酸可明显减少Fe3+的浓度,使得Fe3+/Fe2+电对的电极电位降低,滴定突跃范围变大,指示剂可对终点进行准确判断,减少滴定误差。在加入硫磷混酸后,应立即进行滴定操作,以防止Fe2+在酸性条件下被氧化,一般在20 min内滴定,其重现性较好[10]。
4 结语
对全铁含量在4%~40%的八种矿石标准物质进行试验并得到试验数据,统计分析后得出以下结论:(1)本文介绍的试验方法操作简便、分析速度快、灵敏度高、具有良好的准确度和精密度;(2)本次试验方法与国家标准方法的测定结果没有显著性差异;(3)与国家标准方法氯化亚锡-氯化汞-重铬酸钾法相比,不含汞的SnCl2-TiCl3测定Fe的技术有效防止了环境污染,值得进一步普及和推广;(4)溶样过程中的温度控制在230~250 ℃时,样品能够充分溶解,且不会产生蹦溅现象;(5)滴定时的环境温度宜控制在20~30 ℃之间;(6)SnCl2用量要进行严格控制;(7)加入硫磷混酸后,应立即进行滴定操作。综上所述,本次试验对全铁地质实验测试中高品位铁的测定提供了新的思路和方法,为保证地质实验测试给地质找矿提供稳定、准确的数据支撑,还需在以后的工作中不断探索研究。
