灯盏花素对牙龈卟啉单胞菌脂多糖诱导的人牙龈成纤维细胞损伤的影响
2024-03-08晁晓芹赵国廷董振耀马民英姚毅章
晁晓芹 ,赵国廷 ,董振耀 ,马民英 ,姚毅章
青海省第五人民医院1口腔科,2医学中心 西宁市,810000
牙周炎是主要由菌斑微生物引发的一种口腔疾病,是成人失去牙齿的主要原因,牙龈卟啉单胞菌(Porphyromonasgingivalis,Pg) 是牙周疾病的重要致病菌,该菌外膜中的脂多糖(lipopolysaccharide,LPS) 可导致牙周组织细胞破坏,使牙周炎病情加重,因此,减轻Pg-LPS (以下简称LPS) 诱导的人牙龈成纤维细胞 (human gingival fibroblasts,HGFs) 炎性损伤对预防和治疗牙周疾病具有重要意义[1-3]。灯盏花素(breviscapine,BVP) 是从菊科植物中提取的黄酮类成分,主要成分为灯盏乙素,具有抗炎、抗肿瘤、抗氧化、扩张血管等多种药理学作用[4-5]。研究显示,BVP 可通过上调微小RNA (microRNA,miR) miR-499 的表达,抑制LPS 诱导的心肌细胞氧化应激和细胞凋亡,从而保护LPS 所致心肌细胞损伤[6]。但是BVP 对LPS 诱导的HGFs 炎症损伤的影响尚不清楚。因此,本研究建立LPS 诱导的HGFs 细胞损伤模型,观察BVP对LPS 诱导的HGFs 细胞的影响,为寻找治疗牙周炎的新药提供理论基础。
1 材料与方法
1.1 材料
HGFs 购自中科院上海细胞库,Pg-LPS (货号: ATCC33277) 购自美国R&D Systems 公司;BVP (规格: 20 mg) 购自中国药品生物制品检定所;RPMI 1640 培养基(货号: 11875101)、胎牛血清(货号: 26140-079) 购自美国Gibco 公司;二辛可宁酸(bicinchoninicacid,BCA) 蛋白检测试剂盒、Annexin V-FITC/PI 试剂盒购自南京凯基生物技术有限公司;超氧化物歧化酶 (superoxide dismutase,SOD) 活性检测试剂盒 (货号:HZB002) 购自上海沪峥生物科技有限公司;活性氧(reactive oxygen species,ROS) 检测试剂盒-DCFHDA (货号: HR8687) 购自北京百奥莱博科技有限公司;TNF-α (货号: E-EL-H0109c)、IL-1β (货号: E-EL-H0149c)、IL-6 (货 号: E-ELH0192c)、酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA) 试剂盒、丙二醛(malondialdehyde,MDA)、比色法测试盒 (TBA 法)(货号: E-BC-K025-M) 购自Elabscience 公司;辣根过氧化物酶(horseradish peroxidase,HRP) 标记的兔抗二抗(批号: E030120)、鼠抗二抗(批号:E030110) 购自美国EarthOx 公司;兔抗人细胞周期素Cyclin B1 (Y106,货号: ab215436)、Cyclin D1 (SP4,货号: ab134175)、BCL-2 相关X 蛋白(BCL-2-associated X protein,Bax) (E63,货号:ab263897)、B 淋巴细胞瘤-2 (B-cell lymphoma-2,Bcl-2) (EPR17509,货号: ab218123)、半胱氨酸蛋白酶3 (Caspase-3) (E87,货号: ab32150) 和鼠抗人β-actin 抗体(AC-15,货号: ab6276) 购自英国Abcam 公司。Epics Altra 型流式细胞仪购自美国Beckman Coulter 公司,MK3 型全自动酶标仪购自美国Thermo 公司。
1.2 细胞培养及分组
常规复苏HGFs 细胞后,接种至RPMI 1640 培养基中进行传代培养,每隔2~3 天换液,待细胞生长至对数期时,将HGFs 细胞分为对照组,LPS组,LPS+BVP 低、中、高剂量 (25、50、100 μmol/L BVP) 组。对照组不做处理,LPS 组使用10 mg/L LPS 处理4 h,LPS+BVP 低、中、高剂量组使用10 mg/L LPS 处理4 h 后,再分别用终浓度为5、50、100 μmol/L 的BVP 处理,置于细胞培养箱中进行培养。
1.3 细胞计数试剂(cell counting kit 8,CCK-8) 法检测细胞增殖
将处理好的各组HGFs 细胞接种于96 孔板中,培养48 h 后,采用CCK-8 法检测细胞增殖,计算细胞存活率。
1.4 细胞凋亡检测
将处理好的各组HGFs 细胞接种于96 孔板中,培养24 h 后,使用70 %乙醇固定,使用Annexin V-FITC/PI 试剂盒检测细胞凋亡。
1.5 划痕实验检测细胞迁移
将各组处理的HGFs 细胞以4×104个/孔接种于6孔板中,待细胞贴壁融合后,使用200 μL 枪头在培养皿垂直划线,加入无血清的RPMI 1640 培养基培养48 h,显微镜观察拍照,计算各组细胞迁移率。
1.6 蛋白质印迹法检测细胞蛋白表达
离心收集各组处理的HGFs 细胞,使用蛋白裂解液裂解细胞,提取各组HGFs 细胞总蛋白,经变性后进行十二烷基硫酸钠(sodium dodecyl sulfate,SDS) -聚丙烯酰氨凝胶电泳(polyacrylamide gel electrophoresis,PAGE),转膜封闭后,分别加入兔抗人Cyclin B1 (1∶500 稀释)、Cyclin D1 (1∶1 500稀释)、Bax (1∶1 000 稀释)、Bcl-2 (1∶1 000 稀释)、Caspase-3 (1∶1 500 稀释) 和鼠抗人β-actin(1∶1 000) 抗体,4 ℃孵育过夜,再加入辣根过氧化物酶(horseradish peroxidase,HRP) 标记的IgG二抗(1∶2 000 稀释),室温孵育1 h,DAB 显色,以β-actin 为内参,Quantity One 软件分析条带灰度,并计算目的蛋白相对表达量。
1.7 ELISA 法检测细胞上清液中TNF-α、IL-1β、IL-6 水平
各组细胞培养48 h 后取细胞培养上清液,采用ELISA 法测定各组HGFs 细胞上清液中TNF-α、IL-1β、IL-6 水平。
1.8 SOD、MDA 与活性氧 (reactive oxygen species,ROS) 的检测
取各组处理的细胞,裂解液裂解细胞后,用试剂盒检测细胞中SOD 和MDA。各组处理的HGFs细胞接种于黑色96 孔板中,每孔加入10 μmol/L的二氢荧光素二乙酸酯(dichloro-dihydro-fluorescein diacetate,DCFH-DA) 探针,37 ℃避光孵育30 min,以空白孔做对照,荧光酶标仪检测各孔A值,计算相对ROS 水平。
1.9 统计学处理
2 结果
2.1 BVP 对LPS 诱导的HGFs 细胞增殖及其相关蛋白表达的影响
与对照组比较,LPS 组细胞的存活率、Cyclin B1、Cyclin D1 蛋白表达水平显著性降低 (P<0.05)。
与LPS 组比较,LPS +BVP 低、中、高剂量组细胞存活率、Cyclin B1、Cyclin D1 蛋白表达水平显著升高,并呈BVP 浓度依赖性(P<0.05) (图1、表1)。
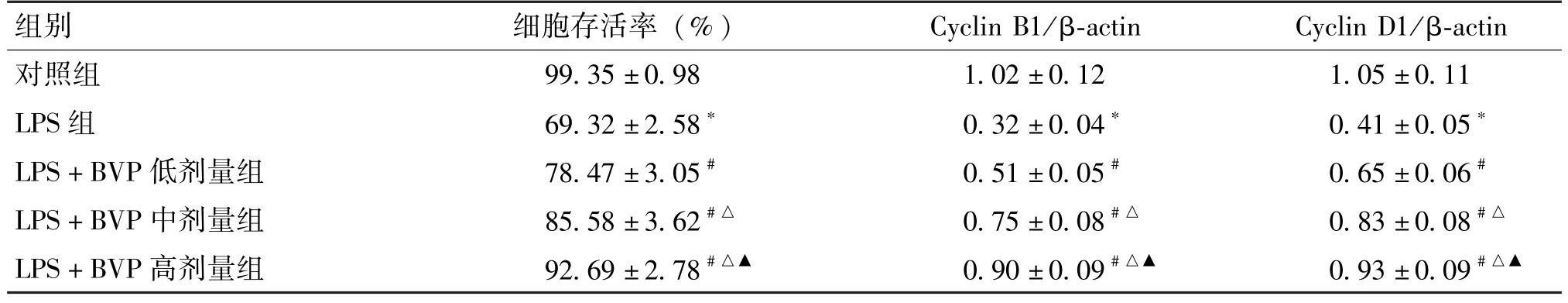
表1 BVP 对LPS 诱导的HGFs 细胞增殖及其相关蛋白表达的影响
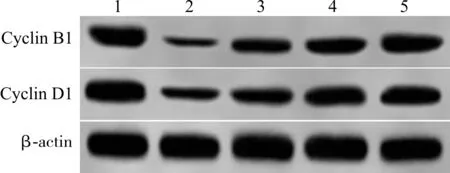
图1 各组细胞Cyclin B1、Cyclin D1 蛋白表达情况
2.2 BVP 对LPS 诱导的HGFs 细胞凋亡及其相关蛋白表达的影响
与对照组比较,LPS 组Bcl-2 蛋白表达显著降低,HGFs 细胞凋亡率、Bax、Caspase-3 蛋白表达水平显著升高(P<0.05);与LPS 组比较,LPS +BVP 低、中、高剂量组Bcl-2 蛋白表达水平显著升高,细胞凋亡率、Bax、Caspase-3 蛋白表达水平显著降低,并呈BVP 浓度依赖性(P<0.05) (图2、表2)。

表2 BVP 对LPS 诱导的HGFs 细胞凋亡及其相关蛋白表达的影响

图2 BVP 对LPS 诱导的HGFs 细胞凋亡及其相关蛋白表达的影响
2.3 BVP 对LPS 诱导的HGFs 细胞迁移的影响
使用划痕实验检测细胞的迁移能力,与对照组比较,LPS 组HGFs 细胞迁移率显著降低 (P<0.05);与LPS 组比较,LPS+BVP 低、中、高剂量组细胞迁移率呈BVP 浓度依赖性升高 (P<0.05) (图3、表3)。
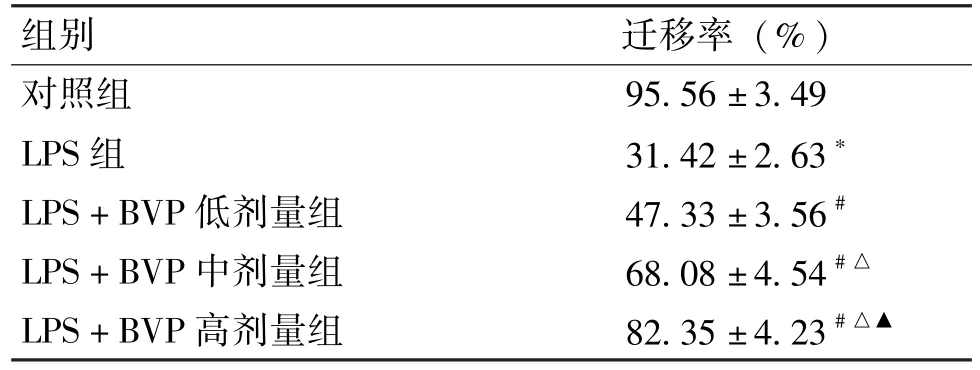
表3 BVP 对LPS 诱导的HGFs 细胞迁移的影响

图3 BVP 对LPS 诱导的HGFs 细胞迁移的影响(×100)
2.4 BVP 对LPS 诱导的HGFs 细胞炎症因子TNF-α、IL-1β、IL-6 表达的影响
ELISA 实验结果显示,与对照组比较,LPS 组HGFs 细胞培养液中TNF-α、IL-1β、IL-6 表达水平显著升高(P<0.05)。
与LPS 组比较,LPS +BVP 低、中、高剂量组HGFs 细胞培养液中TNF-α、IL-1β、IL-6 表达水平显著降低(P<0.05) (表4)。

表4 BVP 对LPS 诱导的HGFs 细胞炎症因子TNF-α、IL-1β、IL-6 表达的影响
2.5 BVP 对LPS 诱导的HGFs 细胞SOD、MDA 与ROS的影响
试验检测SOD、MDA 和ROS 活性,结果显示,与对照组比较,LPS 组HGFs 细胞SOD 活性显著降低,MDA、ROS 水平显著升高(P<0.05);与LPS 组比较,LPS +BVP 低、中、高剂量组HGFs 细胞SOD 活性显著升高,MDA、ROS 水平显著降低(P<0.05) (表5)。

表5 BVP 对LPS 诱导的HGFs 细胞SOD、MDA 与ROS 的影响
3 讨论
BVP 是灯盏花的主要活性成分,具有抗炎、抗氧化和抗血管生成等作用,在肿瘤与炎症疾病中具有良好的应用前景[7-8]。据报道,BVP 可通过抑制LPS 所致小鼠巨噬细胞内ROS 升高而保护线粒体功能,发挥细胞保护作用[9]。BVP 可以抑制高糖诱导的人视网膜色素上皮(RPE) 细胞氧化损伤和凋亡的发生[10]。此外,在脑缺血再灌注(ischemia/reperfusion,I/R) 损伤大鼠模型中,BVP 可有效降低I/R 损伤组织中炎性细胞因子表达、氧化应激及促凋亡蛋白表达,抑制核转录因子-κB (nuclear transcription factor-κB,NF-κB) 信号通路和小胶质细胞的活化,改善脑I/R 诱导的损伤和大鼠的神经功能[11]。Cyclin B1、Cyclin D1 为细胞周期调节蛋白,Cyclin B1 促进G/M 期转换,Cyclin D1 可调节G1/S 期转换,其水平升高可促进细胞增殖。Bax 与Bcl-2 为促凋亡与抗凋亡蛋白,Bax 表达水平升高促进细胞凋亡,而Bcl-2 则发挥抗凋亡作用,Caspase-3 可降解细胞内的功能蛋白和结构蛋白,促进细胞死亡。本研究结果显示,LPS 诱导的HGFs 细胞凋亡率、Bax、Caspase-3 蛋白表达水平显著升高,细胞存活率、迁移率、Cyclin B1、Cyclin D1、Bcl-2 蛋白表达水平显著降低,而使用不同浓度的BVP 处理LPS 诱导的细胞后,HGFs 细胞凋亡率、Bax、Caspase-3 蛋白表达水平均降低,细胞存活率、迁移率、Cyclin B1、Cyclin D1、Bcl-2 蛋白表达水平均升高,表明BVP 可抑制LPS 诱导的HGFs 凋亡,促进其增殖和迁移,减轻HGFs 细胞损伤。
HGFs 能够产生多种炎症相关因子,发挥抗炎作用,而经过LPS 刺激,可放大炎症反应,过度释放炎症因子(TNF-α,IL-1β 等),使牙周炎加重[12]。研究表明,在大鼠颅脑损伤模型中,BVP预处理可减少脑组织炎症因子TNF-α 和IL-1β 水平,抑制炎症损伤[13]。本研究发现,经LPS 处理的HGFs 细胞上清液中TNF-α、IL-1β、IL-6 表达水平均升高,而25、50、100 μmol/L 的BVP 处理细胞后,HGFs 细胞上清液TNF-α、IL-1β、IL-6 表达水平均降低,表明BVP 可抑制LPS 诱导的HGFs细胞炎症因子的释放,减轻LPS 所致HGFs 细胞炎症损伤。SOD 是细胞内的抗氧化酶,其水平高低可反映细胞抗氧化能力,MDA 与ROS 可反映细胞的氧化损伤程度[14-15]。研究显示,大鼠皮质神经元缺氧/复氧损伤模型中,BVP 可增加SOD 的表达,降低细胞内MDA 水平,抑制神经元细胞内ROS 水平,保护缺氧/复氧诱导的神经元氧化损伤[16]。在本研究中,LPS 处理的HGFs 细胞中SOD活性降低,MDA、ROS 水平升高,而不同浓度的BVP 处理HGFs 细胞后,细胞SOD 活性升高,MDA、ROS 水平降低,表明BVP 可通过抗氧化作用抑制LPS 诱导的HGFs 细胞氧化损伤。
综上所述,BVP 可通过抗炎、抗氧化作用减轻LPS 诱导的HGFs 细胞损伤,对牙周疾病中的应治疗有一定潜在价值,但其具体作用机制仍需进一步研究。
