G 蛋白信号转导调节因子在癌症中的新兴作用
2024-03-08张煊赫叶青张舒珊
张煊赫 ,叶青 ,张舒珊
1珠海市妇幼保健医院乳腺外科 广东省珠海市,519000
2中山大学附属第五医院病理科 广东省珠海市,519000
1 RGS 蛋白家族的结构和下游调控机制
G 蛋白偶合生物过程对人类疾病的发展很重要,GPCRs 被配体激活后,其构象的改变导致G 蛋白改变,使Gα 亚基与Gβγ 二聚体解离,促进Gα 亚基的GDP 转换为GTP,使信号在胞内传递[1]。解离的具有活性的Gα-GTP 和游离的Gβγ 二聚体激活下游效应器,从而引起生物化学和细胞生理的改变[2]。RGS 是直接与激活的Gα 亚基结合,发挥GAPs (GTPase 激活蛋白) 作用,加速GTP 水解(>1 000 倍),从而终止G 蛋白信号转导通路的一类分子大小不同,多功能的蛋白质家族[3](图1)。
1.1 RGS 蛋白家族的分类和结构域
所有的RGS 蛋白都包含一个120~130 个氨基酸的保守区域,形成9 个α 螺旋束的分子域被称为RGS-box[4],它与活性的Gα-GTP 接触来加速活化态Gα 亚基回到非活化状态[5]。根据一级序列同源性和其他结构域的存在,RGS 蛋白家族可分为8个明显不同的亚家族: A/RZ、B/R4、C/R7、D/R12、E/RA、F/GEF、G/GRK 以 及H/SNX。另外,D-AKAP2 和RGS22 (PRTD-NY2) 两种特殊RGS 蛋白含有多种RGS 框,不能被分配到8 个家族中的任何一个。A/RZ 和B/R4 亚家族成员分子较小,结构简单,分子中只有一个RGS 结构域[6]。而C/R7、D/R12、E/RA 和F/RL 亚家族成员另外拥有亚家族特异结构域。C/R7 亚家族成员拥有DEP 结构域,R7H 结构域以及GGL 结构域。D/R12 家族拥有RBD 结构域和GoLoco 结构域。E/RA 亚家族含有结合糖原合成酶激酶3β 结构域(GSK3β),一个β-catenin 结合位点(Cat),一个蛋白磷酸酶2A (PP2A) 同源区结构域以及一个二聚体结构域(DIX)。在F/RL 亚家族中,RhoGEF蛋白含有DH 和PH 结构域。GRK 蛋白含有Ser/Thr 激酶催化结构域;而RGS-PX1 含有Phox 同源(PX) 结构域和Phox 相关(PXA) 结构域。每个RGS 个体还拥有各自的特异结构特点,不同结构域的组合创造了高度调控、多功能的蛋白质家族(图2)。
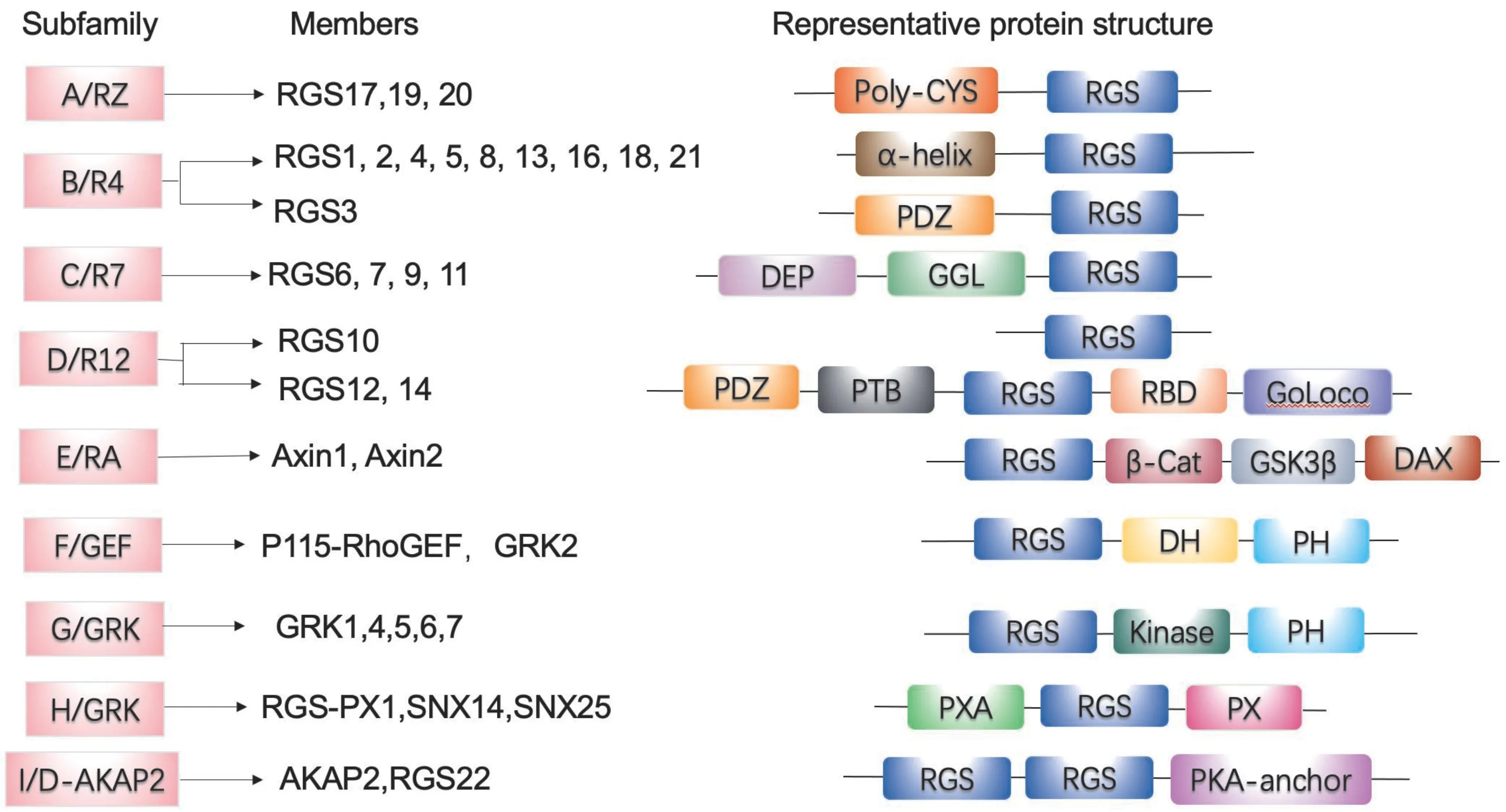
图2 RGS 蛋白家族成员和相关结构域示意图
1.2 RGS 蛋白的下游机制和RGS-Gα 识别模式选择性
RGS 蛋白参与G 蛋白信号转导通路介导的许多细胞内过程,RGS 蛋白调控Gα 亚基具有高度选择性[7]。人体表达4 种类型的Gα 亚基,分别命名为Gαi/o、Gαq/11、Gα12/13、Gαs,这4 种类型的亚基都可以被GPCRs 激活,但是RGS 只与Gi/o和Gq/11 的亚基相互作用发挥GAP 功能[8],最近有研究发现RGS 蛋白也可与G12/13 亚基结合。对RGS 家族几个成员的研究表明,R4 家族成员都表现出与Gi/o 和Gq/11 蛋白结合,基于细微的结构差异,RGS2 对Gq 有更大的选择性,而RGS4 对Gi 有更大的选择性。RZ 家族的所有成员都可以与Gi 和Gq 亚家族结合。目前理论上的Gα-RGS 配对有上百种(约300 种组合) (图3),R4 和RZ 亚型调节Gα 亚基更广泛,R4 和RZ 成员共同调节所有Gq 和Gi/o 类型,同时R7 和R12 亚型的选择性较窄,其成员只调节Gi/o 类型。上述的这种RGSGα 选择性将对GPCR 信号下游产生影响,RGS-Gα选择性的全局模式将进一步影响GPCR 的下游信号通路。我们已知哺乳动物基因组编码16 个Gα 亚基,每个都具有独特的信号关联和选择性参与信号通路的能力,包括腺苷酸环化酶、磷脂酶C 同工酶、Rho 鸟嘌酸核苷酸交换因子(GEF) 和离子通道[9]。根据不同的Gα 亚基鉴定了4 种异三聚体G蛋白复合物: ①Gαi/o,其主要活性是抑制腺苷酸环化酶(AC),减少第二信使环AMP 的产生;②Gαq,激活磷脂酶C,导致细胞溶质Ca2+增加;③Gα12/13,激活Rho 家族的单体GTP 酶,导致细胞骨架重组;④Gαs,激活AC 并增加CAMP,与趋化信号无关[10]。此外,一些RGS 蛋白也可以通过作为Gs 激活的腺苷酸环化酶或Gq 激活的磷脂酶的“效应拮抗剂” 来抑制GPCR 信号的传导。RGS还可以竞争性抑制Gα-效应器的相互作用,激活Gβγ 介导的信号转导途径[11]。
2 RGS 蛋白与肿瘤
2.1 RGS 蛋白家族发挥促癌和抑癌作用
目前,大多数研究认为GPCR 途径和G 蛋白的过度激活有利于致癌生物过程。因此,RGS 蛋白家族介导的GAP 可能在抑制G 蛋白活化方面发挥作用,被认为是肿瘤抑制基因,并且相信“RGS盒” 中的突变将是癌症驱动事件(表1)[12]。

表1 RGS 蛋白变化和肿瘤致癌的作用关系
RGS2、RGS6、RGS7、RGS10 和RGS16 通常被认为是肿瘤抑制基因。RGS2 在乳腺、前列腺[13]、卵巢和结直肠癌中的表达下调,RGS2 还与前列腺癌症疾病的分期有关,其表达在早期和中期下调,但随着疾病的进展,其表达逐渐增加。因此,RGS2 可以被认为是前列腺癌的预后指标[14]。RGS12 在前列腺癌[15]和口腔鳞状细胞癌中起肿瘤抑制作用。在胰腺癌患者中,RGS16 通过p53 和pRb/RB130 抑制肿瘤转移和侵袭。低水平RGS7 被认为是黑色素瘤的驱动因素。RGS10 与癌症、癌症和急性髓细胞白血病的不良预后有关[16]。
然而,RGS 家族的一些成员表现出致癌基因的作用。一些人认为,这种相反的作用可能与非RGS 结构域的非GAP 功能有关。RGS1、RGS3、RGS4、RGS5、RGS11、RGS17、RGS19 和RGS20 被认为是致癌基因。RGS17 在肺、结直肠、乳腺、前列腺和肝细胞癌中高度表达[17]。RGS5 在肾透明细胞癌、肺癌、胃癌、肝癌和舌鳞状细胞癌[18]中增加。RGS1、RGS3、RGS4、RGS11、RGS19 和RGS20 在黑素瘤、胃癌、前列腺癌、视网膜母细胞瘤、卵巢癌和宫颈癌中上调[19-20]。它们可以通过促进细胞增殖、迁移和上皮-间质转化(EMT) 来促进肿瘤,并在化疗耐药性和肿瘤免疫中发挥重要作用。
此外,一些RGS 蛋白具有复杂的功能。RGS2、RGS12、RGS6、RGS26、RGS17、RGS5 在促进和抑制癌症方面发挥双重作用。RGS2、RGS12、RGS6、RGS16 通常被认为是一种肿瘤抑制基因,但RGS2在套细胞淋巴瘤(mantle cell lymphoma,MCL)[21]和纤维板层癌[22]中发挥致癌基因作用。RGS16 在胶质瘤[23]中起促癌作用。RGS17 和RGS5 目前被认为是致癌基因,但RGS17 在鼻咽癌中起抑制癌症的作用[24];RGS5 在人类肺癌中同样发挥抑癌作用。
2.2 RGS 蛋白家族的在泛癌中的作用特征
接下来我们将总结RGS 蛋白家族在泛癌中复杂调控网络的一些特征。首先,我们发现相同的RGS 蛋白在不同的肿瘤中起相反的作用。例如,在肝细胞癌中,RGS5 通过下调Gαi 亚基促进细胞的迁移和转移[25],但在非小细胞肺癌中,它激活Gαq 和Gαi 亚基,进而抑制癌症血管浸润和淋巴结转移[26]。RGS6 同样具备双重作用,即促进ROS诱导的乳腺癌细胞的凋亡,同时抑制卵巢癌的主要生长因子溶血磷脂酸受体2 (LPA2) 的信号转导。因此,RGS 蛋白在不同的组织和器官中结合不同的Gα 亚基,影响不同的下游途径,从而在癌症中发挥多样的功能。
其次,我们发现不同RGS 蛋白在某种癌症中有相反的变化。例如,RGS2 和RGS6 在乳腺癌中低表达,而RGS3 和RGS17 高表达[27]。在卵巢癌症中,RGS17 和RGS2 下调,而RGS1、RGS19、RGS5 和RGS6 上调。然后RGS 的这种差异表达被认为与细胞的补偿机制有关。因为多种RGS 蛋白可以在同一细胞中表达,并且一种RGS 蛋白的上调可能代表另一种RGS 蛋白下调的补偿机制。此外,RGS 蛋白发挥其主要功能的方式更多地取决于整体细胞表达的“主导作用”。例如,在癌症中,RGS2/3 的转录水平降低了75 %,但RGS1/4/5/18 的表达增加了7~9 倍,因此后者的影响可能更大[28]。
最后,我们还发现相同的RGS 蛋白也可能在一个肿瘤中发挥多种作用。例如,RGS10 可以通过Rhb-GTP 和mTOR 途径[29]抑制卵巢癌症,同时还调节参与化疗耐药反应的炎症信号卵巢癌症。RGS16 在癌症中也发挥着多重作用,RGS16 可以通过抑制PI3K 依赖性乳腺上皮细胞的生长而发挥抑癌作用,同时RGS16 的缺失增强了HER2 的激活和对化疗药物的耐药性[30]。在非小细胞肺癌中,RGS5 的表达与肿瘤细胞的分化有关,并且RGS5还抑制癌症血管浸润和淋巴结转移[31]。因此,某种RGS 蛋白可以影响肿瘤的进展,也可以对耐药性、炎症或血管生成发挥不同的作用。
2.3 RGS 蛋白家族调节肿瘤异质性
癌症中RGS 蛋白家族具有高度的多样性,这种复杂的变化与RGS 的结构多样性和复杂性密不可分,分析原因如下: ①器官特异性和不同的内分泌调节机制导致RGS 蛋白通过不同的信号通路进行选择性调节。例如,RGS6 在癌症和乳腺癌中起着不同的作用。②由于RGS 蛋白具有不同的GAP 活性,RGS 蛋白可以调节下游信号级联,从而进一步对癌症细胞进行编程。例如,相同的RGS 蛋白激活肿瘤中不同的信号通路。③RGS 家族成员也有多个结构域,如PDZ、PH 等。因此,RGS 蛋白还可以发挥效应蛋白和支架蛋白的作用,连接受体、G 蛋白和效应物,获得复杂的信号复合物。例如,RGS3 可以通过PDZ 结构域调节TGF-β信号传导,从而潜在拮抗TGF-b 对癌症细胞的抗增殖作用[31]。④RGS 蛋白也是高度可调节的。RGS 蛋白主要受蛋白稳定性、转录调节或表观遗传学调节的调节。这些组合机制允许RGS 水平的急性和慢性调节以响应多种信号。例如,在卵巢癌症中,耐药卵巢癌症细胞中RGS10 启动子的甲基化增加。
3 RGS 蛋白家族在肿瘤免疫微环境中的作用
RGS 蛋白在肿瘤微环境中的潜在作用。众所周知,免疫系统可以识别并摧毁新的肿瘤。鉴于许多RGS 蛋白在肿瘤微环境中的控制作用,RGS 蛋白的上调可能导致抗肿瘤免疫力下降和肿瘤生长增强。
大多数免疫细胞类型表达多种RGS 蛋白[32],尤其是在白细胞趋化性方面[33]。白细胞活化和趋化性是由趋化因子与多种趋化因子受体结合介导的,趋化因子在免疫细胞募集到特定肿瘤微环境中发挥核心作用[34]。趋化因子受体家族属于7 个跨膜GPCR 家族,一些研究表明,敲低RGS 蛋白[35]后白细胞趋化性显著增强。另一项研究指出,Gi和RGS 蛋白之间的相互作用导致趋化因子受体的变化,并导致白细胞重新分布[36]。RGS1 最初被用作B 细胞的早期激活基因,RGS1 调节B 细胞在淋巴结微环境中的归巢和运动[33]。RGS1 也可以调节T 细胞,Gαi2 和RGS1 表达之间的平衡可能控制T细胞在胃肠道粘膜中的滞留[37]。另一项研究发现,RGS1 导致癌症中T 细胞(TH1 和CTL) 浸润减少,并形成了免疫抑制性微环境,而RGS1 与乳腺癌症患者生存期缩短相关[38]。RGS1 还调节巨噬细胞的积聚和滞留,以影响主动脉瘤的形成和破裂[39]。RGS5 也发挥着相似的作用,RGS5 的降低会增加免疫细胞的趋化性和黏附性,从而导致炎症组织的中性粒细胞的招募和动员[40]。因此,我们推测RGS 可以驱动趋化因子受体的内化、脱敏和信号终止,从而协调肿瘤微环境中白细胞的运输和重新分布。另一方面,RGS 蛋白也可以通过影响血管生成来影响肿瘤的进展。有学者研究了RGS2在髓源性抑制细胞(MDSCs) 中的作用。MDSCs中的RGS2 通过产生MCP-1[41]来增加肿瘤血管生成。在另一项研究中,RGS5 在肿瘤衍生的内皮细胞(EC) 中高度表达,并参与微环境中的血管重塑,从而增加肿瘤血管生成并促进肿瘤进展[42]。相反,最新研究报道了RGS 蛋白与T 细胞的耗竭和抑制抗肿瘤T 细胞相关,通过抑制T 细胞上的RGS16 联合PDL-1 阻断治疗,可有效改善T 细胞免疫治疗,达到有效抑制肿瘤的作用[43]。综上,RGS 蛋白家族在肿瘤微环境中的作用尚不清楚,由于肿瘤微环境细胞成分复杂、微环境中丰富的细胞因子和肿瘤血管疾病的存在,将导致RGS 蛋白家族在不同肿瘤微环境中发挥不同的作用。
RGS 从一种潜在的新型GPCR 信号调节器发展为一个具有特征生化机制、结构、细胞信号和表达作用的蛋白质家族,这种重要的调节分子是一种尚不甚了解的致癌原因,它们损害了G 蛋白的功能,而G 蛋白是一个功能多样的信号转导家族,它构成了生命本身无数生物学层面的基础。自从RGS家族被发现以来,RGS 蛋白将G 蛋白与细胞生长和分化、细胞运动和细胞内转运相关的信号通路相结合,在生理学中起着至关重要的作用,可以成为疾病的理想靶点。目前对RGS 的研究还只是初步的,只能简单描绘出RGS 的结构特点、生物学效应及调节机制。相信随着研究的不断深入,RGS蛋白的全部功能意义将会逐步明晰,将成为未来癌症治疗的新靶点。
