飞蝗载脂蛋白对卵巢发育和脂质沉积的影响
2024-03-08赵艺妍郭红芳刘卫敏赵小明张建珍
赵艺妍,郭红芳,刘卫敏,赵小明,张建珍
飞蝗载脂蛋白对卵巢发育和脂质沉积的影响

1山西大学应用生物学研究所/核酸生物农药山西省重点实验室,太原 030006;2山西大学生命科学学院,太原 030006
【背景】脂质是生物体重要营养素之一,对于昆虫滞育、飞行、胚胎发育和能量调节至关重要。载脂蛋白(apolipophorin,apoLp)是昆虫脂蛋白颗粒的蛋白质部分,主要负责组织之间脂质转运。【目的】以世界性农业害虫飞蝗()为研究对象,通过RNA干扰(RNA interference,RNAi)技术对其载脂蛋白生物学功能进行分析,探究载脂蛋白在飞蝗卵巢脂质运输中的作用,为害虫防治提供新的分子靶标。【方法】利用RNAi技术,分别对羽化后第1天(1 PAE,post adult eclosion)的成虫2个载脂蛋白基因(/和)进行dsRNA注射,以ds为对照,每头注射15μg dsRNA;分别解剖羽化后第4、6、8天的卵巢进行观察;取羽化后第8天的卵巢,以作为内参基因,采用实时荧光定量PCR(RT-qPCR)方法检测沉默效率;利用脂质组学技术测定并分析对照和沉默/后飞蝗卵巢脂代谢物差异,采用OPLS-DA模型的差异倍数(FC)、值和VIP值相结合的方法筛选差异脂质;制备冰冻切片,利用Bodipy染色技术对沉默/后飞蝗卵巢中性脂的含量和分布进行观察;利用甘油三酯(triglyceride,TG)测定试剂盒,对沉默/后飞蝗卵巢总甘油三酯含量进行测定。【结果】与对照组相比,分别注射ds/和ds后,卵巢中靶基因的表达量均可被显著抑制,沉默效率分别为80.84%和92.89%;注射ds/的飞蝗卵巢发育迟缓,而注射ds的飞蝗卵巢与对照组相同,均能够正常发育逐渐变大,颜色由白色逐渐变黄。沉默/后,脂质组学分析共检测到1 166种上调代谢物和1 384种下调代谢物,其中20种甘油三酯显著下调;此外,总甘油三酯测定及Bodipy染色结果显示,卵巢总甘油三酯含量和中性脂质含量均较对照组显著降低。【结论】飞蝗/是影响卵巢发育的主要载脂蛋白基因,其参与卵巢脂质的积累和运输。研究结果可为基于脂质运输基因为靶标的害虫防治提供理论依据。
飞蝗;载脂蛋白;RNA干扰;卵巢;脂质运输
0 引言
【研究意义】飞蝗()为重要的世界性农业害虫,其分布广泛、危害性强。目前针对飞蝗的防治策略依然是以化学防治为主,但化学杀虫剂的大量使用不仅影响环境,而且易导致抗药性的产生[1]。因此,研发新型绿色杀虫剂,寻求更安全、高效的生物防治策略显得尤为迫切。RNA干扰(RNAi)技术因其特异性、高效性、系统性及安全性等特点,已被国际上公认为“第四代杀虫剂”的核心技术[2]。脂质是构成生物膜的主要成分,是生物体重要的营养物质,其与糖类、蛋白质和核酸共同构成细胞中四大有机物。昆虫脂类物质分布广泛,包括脂肪体、中肠、卵巢、表皮和飞行肌等,其在昆虫生长、发育、繁殖、飞行及信息交流等生命活动中发挥重要作用[3]。目前,关于昆虫脂质合成通路相关基因(乙酰辅酶A羧化酶、脂肪酸还原酶、脂肪酸合成酶、脂肪酸延伸酶和细胞色素P450基因)的功能已开展了较为详细的研究,且明确了其在昆虫生态适应性中的重要作用[4-10],脂质运输是脂代谢的重要环节,但关于昆虫脂质运输机制尚缺乏系统研究。因此,开展脂质运输关键基因的分子特性及功能研究,对于全面解析昆虫脂类物质代谢过程具有重要的科学意义。【前人研究进展】载脂蛋白(apolipophorin,apoLp)是一种载体蛋白,与脂质结合后形成脂蛋白颗粒,能够调节脂质在组织间的运输。哺乳动物中,载脂蛋白主要分为4类,包括apoA、apoB、apoC和apoE[11-12]。这些蛋白是血浆脂蛋白的重要组成成分,在动物体器官之间调节各种脂质的运输[13]。在昆虫中,载脂蛋白主要包括两种不可交换(non-exchangeable,从生物合成到分解始终在同一脂蛋白颗粒上)的载脂蛋白——载脂蛋白I(apoLp-I)和载脂蛋白II(apoLp-II),和一种可交换(exchangeable,可随时与脂蛋白结合或解离)的载脂蛋白——载脂蛋白III(apoLp-III)[14]。其中apoLp-I和apoLp-II是同一基因()的产物,翻译后被弗林蛋白酶(Furin)切割为两个蛋白,二者以1﹕1的比例存在于脂蛋白颗粒中,共同发挥脂质运输作用[15-16]。ApoLp-II/I与哺乳动物apoB同源,属于大型脂质转移蛋白超家族的一员[17],而apoLp-III则与哺乳动物apoE同源[18]。1987年,Cole等克隆并测序了昆虫中第1条载脂蛋白基因——烟草天蛾()[19],之后,在飞蝗、埃及伊蚊()、柞蚕()等昆虫中其同源基因陆续被发现[20-23]。研究表明,昆虫血淋巴中大约95%的脂是通过载脂蛋白运输的[24-26],apoLp-II/I是昆虫体内主要的载脂蛋白,飞蝗apoLp-II/I在其视网膜下层的色素胶质细胞中高表达,可能参与类维生素A或脂肪酸到视网膜的运输[27]。本课题组前期研究结果表明,飞蝗apoLp-II/I主要定位于绛色细胞和表皮细胞的细胞质中,参与表皮脂质运输以及表皮屏障功能的构建[28]。此外,在采采蝇()中,的沉默导致血淋巴脂质含量降低,卵母细胞发育延迟[29]。在黑腹果蝇()中,主要负责肠道中脂质的动员和运输[24]。昆虫在长距离飞行过程中,apoLp-III结合到高密度脂蛋白(high-density lipophorin,HDLp)颗粒上,与apoLp-II和apoLp-I共同发挥作用,以招募更多的甘油二酯(diacylglycerol,DG)为飞行提供能量,最终HDLp转化为低密度脂蛋白(low-density lipophorin,LDLp)颗粒[18,30]。此外,apoLp-III还参与蜡螟()、柞蚕、黄粉虫()、中华蜜蜂()等多种昆虫的先天免疫反应,在抵抗微生物入侵过程中发挥重要作用[31-39]。【本研究切入点】飞蝗载脂蛋白和序列已分别于2000年和1988年被鉴定[22,27],然而,对其参与卵巢脂质运输的分子机制却少有报道。【拟解决的关键问题】利用RNAi技术分别对2条载脂蛋白基因(和)进行干扰,明确其在卵巢发育及卵巢脂质运输中的作用,为基于RNAi技术的害虫防治新靶标发现提供理论依据。
1 材料与方法
试验于2019—2023年在山西大学应用生物学研究所完成。
1.1 供试昆虫
飞蝗虫卵购自河北省沧州市孟村回族自治县徐利养殖场,在恒温恒湿养虫室(温度:(30±2)℃,相对湿度:40%±5%,光周期:14 h光照/10 h黑暗)中进行孵育。待其孵化成1龄若虫时移至纱网笼中,并继续放置于恒温恒湿养虫室,每天饲喂新鲜的小麦苗,直至飞蝗长至3龄时辅以麦麸饲喂。
1.2 基于RNAi的生物学功能分析
根据LmapoLp和绿色荧光蛋白(GFP)的cDNA序列,通过http://www.dkfz.de/signaling/e-rnai3//网站设计引物,引物见表1。使用PCR MasterMix(天根生化科技(北京)有限公司)进行PCR扩增,反应体系:25 μL PCR MasterMix,10 μL上游/下游引物,2 μL整虫cDNA,加去离子水至50 μL。PCR程序:95 ℃预变性5 min;95 ℃ 15 s,60 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃延伸10 min。产物用E.Z.N.A.®Gel Extraction Kit按照说明进行回收,然后参照T7 RiboMAXTMExpress RNAi System试剂盒说明书体外合成dsRNA。
为了研究两个对飞蝗卵巢发育的影响,利用RNAi技术,对羽化后第1天(1 PAE,post adult eclosion)的90头雌成虫进行dsRNA注射,每头注射15 μg ds或ds,以ds为对照,每组30头。在恒温恒湿养虫室饲养,解剖第4、6、8天成虫的卵巢进行形态学观察,取成虫第8天的部分卵巢进行沉默效率检测,剩余部分液氮速冻,用于非靶向脂质代谢组学分析。设置6个生物学重复,每组3头。

表1 本研究所用引物
1.3 沉默效率检测
注射ds和ds后,解剖成虫第8天的卵巢,使用RNAiso Plus(TaKaRa)提取每个重复中的总RNA,1%的琼脂糖凝胶电泳检测所提RNA的质量,Nanodrop 2000对总RNA进行定量,然后以1 µg总RNA为模板,依据TaKaRa公司反转录试剂说明书合成cDNA模板。通过RT-qPCR方法检测在飞蝗卵巢中的表达,每个样本做两个技术重复。采用ABI Prism 7300 SDS 1.1软件对数据进行分析并记录。引物见表1(由生工生物工程(上海)股份有限公司合成)。以作为内参,的相对表达量采用2-ΔCt法进行分析[40]。
1.4 卵巢脂质组学分析
为了进一步研究对飞蝗卵巢脂质运输的影响,利用脂质组学技术测定并分析正常个体和沉默后飞蝗卵巢脂代谢物差异。
样品提取:向样品中加入500 μL甲基叔丁基醚/甲醇提取液(5﹕1)和适量瓷珠,用组织研磨仪充分研磨;置于涡旋仪上振荡30 s,并于冰水浴条件下超声破碎15 min;-40 ℃冰箱中静置1 h后,13 000 r/min,4 ℃离心15 min;取上清300 μL于1.5 mL离心管中并干燥;加入200 μL二氯甲烷和甲醇溶液(1﹕1)复溶,冰水浴条件下超声破碎10 min;12 000 r/min,4 ℃离心15 min;取上清140 μL于2 mL色谱瓶中待测。
代谢组学分析:分别在正离子(POS)和负离子(NEG)模式下,使用液质联用仪进行代谢组学分析。进样体积为5 μL,柱温为55 ℃,使用采集软件MassLynx V4.2控制下的MSe模式进行一级、二级质谱数据采集。所有数据处理和分析均在百迈客云平台(http://www.biocloud.net)上进行。将原始峰面积用总峰面积归一化后,进行后续分析。采用主成分分析(PCA)和Spearman相关分析来判断组内样品和质控样品的重复性。在LIPID MAPS数据库(https://www. lipidmaps.org/)中检索鉴定出的化合物的分类和途径信息。根据分组信息,计算差异倍数,用检验法计算各化合物的值以评估差异的显著性。采用多重交叉验证法计算模型的变量相互依赖参数(VIP)值。采用OPLS-DA模型的差异倍数(FC)、值和VIP值相结合的方法筛选差异脂质。筛选标准为FC>1,值<0.05,VIP>1。
1.5 Bodipy染色
为了进一步验证代谢组学的结果,利用Bodipy染色技术对卵巢中性脂的含量和分布进行观察。分别取注射ds和ds后第8天的成虫卵巢,经4%甲醛钙溶液固定、不同浓度蔗糖溶液(10%、20%和30%)梯度脱水和OCT包埋剂(Sakura,美国)包埋后,制备厚度为20 μm的冰冻切片;利用经二甲基亚砜稀释后的Bodipy505/515染液(200﹕1),37 ℃孵育40 min,PBS漂洗(5 min×3次);将DAPI滴加至样品上,室温孵育10 min,进行细胞核染色;PBS漂洗(5 min×3次)后使用抗荧光淬灭封片液进行封片,采用激光共聚焦显微镜(Zeiss,LSM880)进行观察。
1.6 卵巢总甘油三酯(triglyceride,TG)含量测定
利用总甘油三酯含量测定试剂盒对卵巢总甘油三酯含量进行测定。分别取注射ds和ds后第8天的成虫卵巢并称重,参照南京建成生物工程研究所甘油三酯测定试剂盒(A110-1-1)说明书对总甘油三酯含量进行测定,设置8个生物学重复,每组3头。
1.7 数据分析
沉默效率检测采用相对表达倍数来表示。
沉默效率、沉默后的卵巢面积、脂质组学以及总甘油三酯含量的差异显著性分析采用student-test法,*<0.05表示差异显著,**<0.01和***<0.001表示差异极显著。
2 结果
2.1 沉默LmapoLp对飞蝗卵巢发育的影响
为研究两个对飞蝗卵巢发育的影响,利用RNAi技术对羽化后第1天的成虫进行干扰。结果发现,与对照组相比,分别注射ds和ds后,卵巢中靶基因的表达量均可以被显著抑制,沉默效率分别为80.84%和92.89%(图1-A)。分别解剖羽化后4 d(4 PAE)、6 d(6 PAE)和8 d(8 PAE)的卵巢进行观察,发现注射ds和ds的飞蝗卵巢均能够正常发育,体积逐渐变大,颜色由白色逐渐变黄,到第8天其正面观面积可达100 mm2以上。而干扰后,飞蝗卵巢发育受阻,其正面观面积始终维持在26 mm2左右(图1-B、1-C),表明在飞蝗卵巢发育中发挥重要作用。
2.2 沉默LmapoLp-II/I后飞蝗卵巢脂代谢组学分析
昆虫卵子发生过程需要大量的脂类物质为胚胎发育提供能量[41-42]。因此,推测ds处理后卵巢发育受阻可能影响了卵巢脂质沉积。对飞蝗卵巢脂代谢组学进行分析,结果表明沉默后,分别检测到1 166种上调代谢物和1 384种下调代谢物(图2-A)。其中下调代谢物包括442种脂肪酰类(FA)、194种甘油脂类(GL)、350种甘油磷脂类(GP)、41种多聚乙烯类(PK)、57种孕烯醇酮脂类(PR)、11种糖脂类(SL)、130种鞘脂类(SP)和159种固醇脂类(ST)(图2-B)。
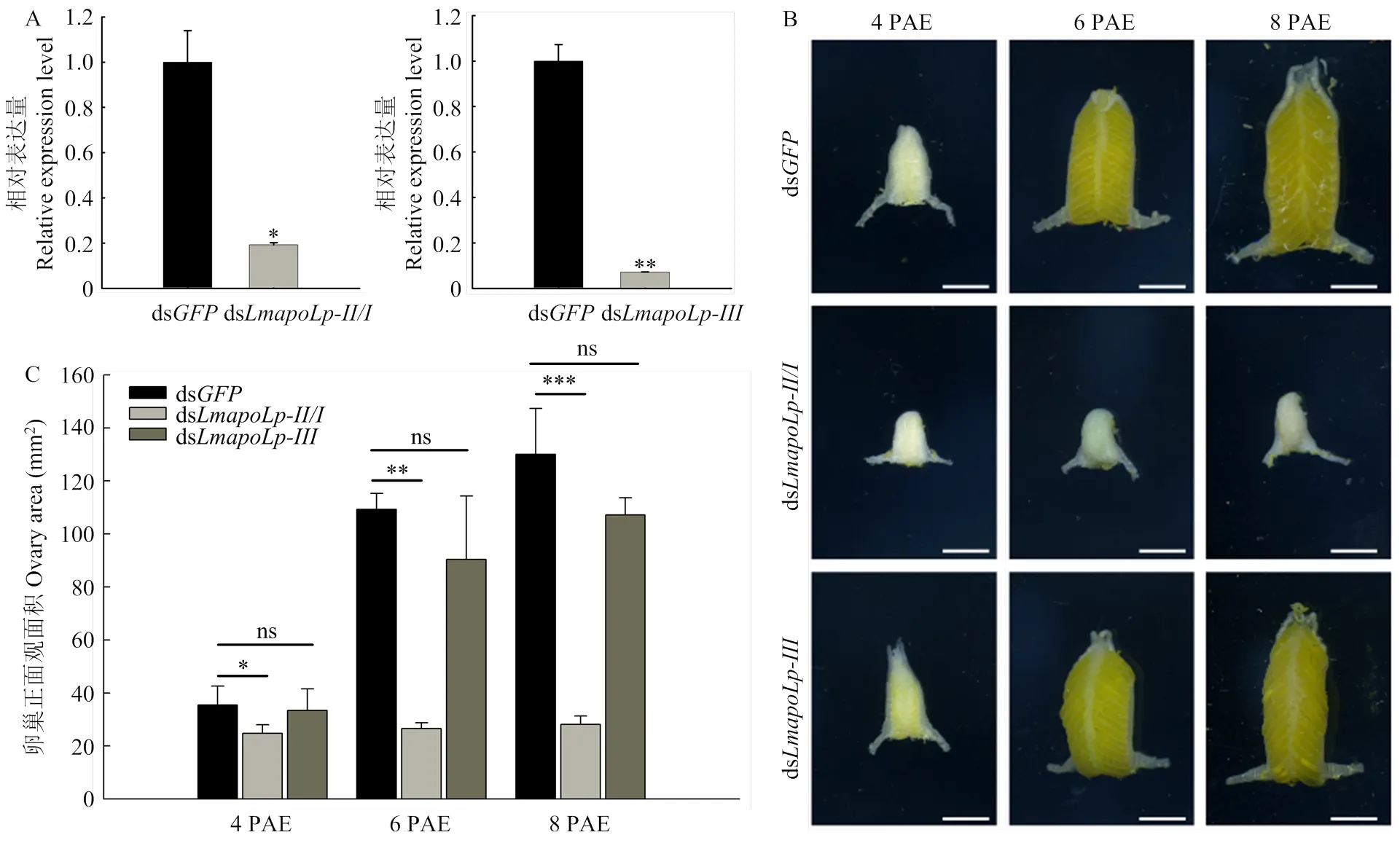
A:RT-qPCR检测和的沉默效率Silencing efficiency ofandwas detected by RT-qPCR;B:分别注射ds和ds后卵巢的形态学观察,标尺为5 mm Morphology of the ovaries in adult female after injection of dsor ds. Scale bars=5 mm;C:注射ds和ds后4—8 PAE卵巢正面观面积统计The area of ovaries frominjected with dsor dsat 4-8 PAE;数值用平均值±标准差表示,*表示ds对照组和ds注射组之间差异显著(<0.05,Student’s-test,n=5,每组3头)The data are shown as means±SD, * indicates significant difference between ds- and ds-injection groups (<0.05, Student’s-test, n=5, three locusts per group)
图1 沉默对飞蝗卵巢发育的影响
Fig. 1 Effects ofRNAi on ovary development in
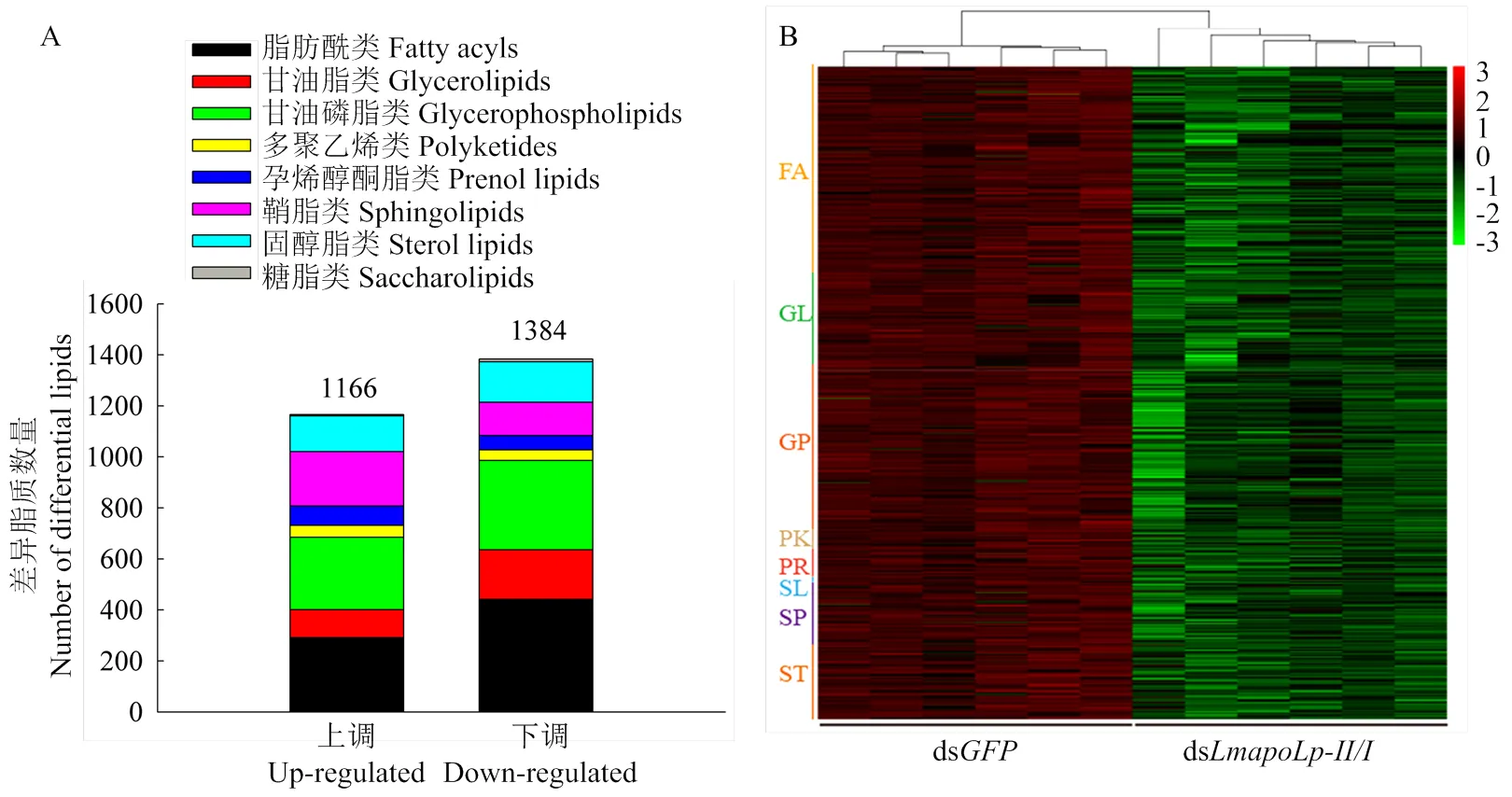
图2 沉默LmapoLp-II/I后卵巢差异脂质数量统计(A)及下调代谢物的聚类分析(B)
昆虫卵母细胞中的脂质主要以甘油三酯(甘油脂类)的形式存在,占中性脂的60%左右[43]。共检测到20种显著下调的甘油三酯,包括TG(12:0_14:1_16:0)、TG(12:0_18:2_22:5)、TG(14:0_15:1_18:4)、TG(14:0_18:2_20:5)、TG(14:0_20:0_22:4)、TG(14:1_22:1_22:3)、TG(15:1_22:0_22:5)、TG (16:0_18:0_18:4)、TG(16:0_20:4_22:0)、TG(16:1_18:1_22:0)、TG(17:1_18:3_20:2)、TG(17:2_18:0_20:5)、TG(17:2_20:1_22:5)、TG (18:0_18:3_22:0)、TG(18:3_20:2_21:0)、TG(19:0_20:2_20:5)、TG(18:3_19:1_21:0)、TG(20:3_20:5_22:2)、TG(20:4_20:4_22:1)以及TG(20:4_20:5_22:0)(图3),表明参与了卵巢脂质的积累和运输。

数值用平均值±标准差表示,*表示ds对照组和ds注射组之间差异显著(<0.05,Student’s-test,n=6,每组3头)
The data are shown as means±SD. * indicates significant difference between ds- and ds-injection groups (<0.05, Student’s-test, n=6, three locusts per group)
图3 沉默/后卵巢中下调的甘油三酯含量分析
Fig. 3 The content analysis of down-regulated triglyceride in the ovary after RNAi of
2.3 沉默LmapoLp-II/I对飞蝗卵巢中性脂含量的影响
为了进一步验证代谢组学的结果,分别利用Bodipy染色技术和总甘油三酯含量测定试剂盒对卵巢中性脂的含量和分布进行观察及测定。结果显示,与对照组相比,注射ds后绿色荧光信号显著变弱,脂滴大小显著减小,表明卵巢中性脂含量显著降低(图4-A)。同时,总甘油三酯含量降低60.04%(图4-B),表明在卵巢脂质运输中发挥重要作用。
3 讨论
3.1 不同物种载脂蛋白的序列及功能特性
在人类中,载脂蛋白主要包括apoA、apoB、apoC和apoE四大类,是血浆脂蛋白的重要组成部分,在血浆脂蛋白代谢中发挥重要的作用,包括脂质运输、酶活性调节以及促进脂蛋白与细胞表面受体相互作用等。其中apoA和apoE主要存在于高密度脂蛋白(HDL),apoB主要存在于低密度脂蛋白(LDL),而apoC主要存在于极低密度脂蛋白(VLDL)和高密度脂蛋白(HDL),与糖尿病、冠心病、动脉粥样硬化及阿尔兹海默症等心脑血管疾病的发生密切相关[11-12,44-47]。
近年来,载脂蛋白序列已在不同昆虫物种中被鉴定并分析,包括飞蝗、斯氏按蚊()、埃及伊蚊、家蚕()及柞蚕等。序列分析结果显示,不同昆虫物种的apoLp-II/I和apoLp-III均含有一个信号肽,且不同昆虫物种的apoLp-II/I均包含LPD_N、DUF1943、DUF1081和VWD结构域[18,20,27,32,48]。此外,与哺乳动物相比,昆虫apoLp-III与哺乳动物apoE的22 kDa氨基端(N terminal,NT)结构域高度相似,均由一束两亲性的螺旋组成,其中apoE-NT包含4个螺旋,apoLp-III包含5个螺旋[18],而昆虫apoLp-II/I与哺乳动物apoB均含有信号肽、LPD_N和DUF1943结构域[16],表明载脂蛋白序列在不同物种中是相对保守的。
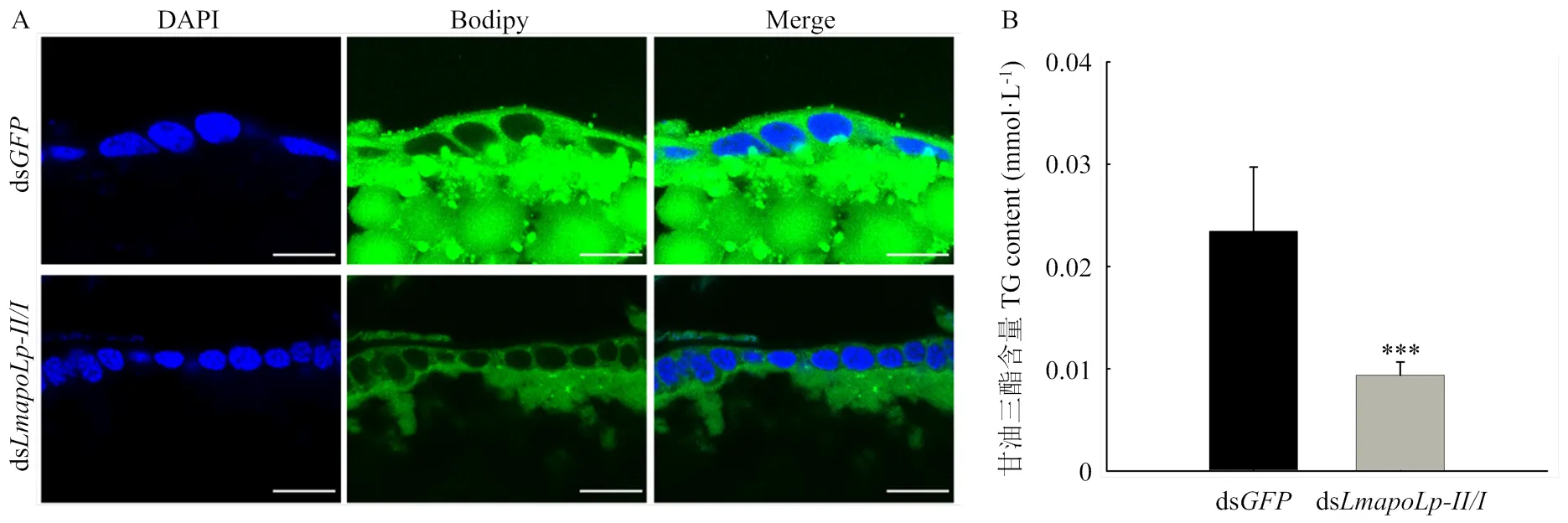
A:注射ds和ds后,取成虫第8天的卵巢制备冰冻切片(20 μm),Bodipy505/515用于标记中性脂质(绿色),DAPI用于标记细胞核(蓝色),标尺为20 μm The cryosections (20 μm) of ovary were prepared 8 days PAE after dsor dsinjected into, and neutral lipids were detected with Bodipy505/515(green). Nuclei were stained with DAPI (blue). Scale bar=20 μm;B:沉默后卵巢总甘油三酯含量分析。数值用平均值±标准差表示,*表示ds对照组和ds注射组之间差异显著(<0.05,Student’s-test,n=8,每组3头)Total triglyceride contents in the ovary after RNAi of. The data are shown as means±SD. * indicates significant difference between ds- and ds-injection groups (<0.05, Student’s-test, n=8, three locusts per group)
图4 沉默/对卵巢中性脂质含量的影响
Fig. 4 The effect ofsuppression on the content of neutral lipids in the ovary
目前国内外关于昆虫载脂蛋白的功能研究主要集中于果蝇和采采蝇等双翅目昆虫,发现其能够参与昆虫肠道、翅原基以及卵母细胞中中性脂质的运输和摄取[24,29]。Bogerd等于2000年在飞蝗中鉴定了序列,并发现其在视网膜下层的色素胶质细胞中高表达,推测其可能参与类维生素A或脂肪酸到视网膜的运输[27]。本课题组前期研究发现,参与飞蝗表皮脂质的转运,从而影响表皮碳氢化合物的含量及表皮的屏障功能,干扰后飞蝗对干燥及农药的敏感性显著降低[28]。然而,在飞蝗中关于载脂蛋白参与脂质运输的研究却未见报道。本研究在有效沉默后,飞蝗卵巢发育受阻(图1),卵巢脂质含量减少,表明在飞蝗卵巢发育和脂质运输中发挥重要作用。然而,的沉默并没有影响卵巢发育,推测其并不参与卵巢发育中脂质的运输过程。研究表明,昆虫血淋巴中含有大量无脂形式的apoLp-III(高达15 mg·mL-1)。飞行过程中,在脂肪动力激素的作用下,apoLp-III与高密度脂蛋白结合,从而增加了其结合脂质的能力,密度降低,转变为低密度脂蛋白,进而与飞行肌上的结合位点结合,脂质水解并被利用[18]。因此,推测apoLp-III可能在飞蝗其他生理过程中发挥作用,例如飞行、滞育、能量调节等,但其具体影响机制有待进一步研究。
3.2 LmapoLp-II/I在卵巢脂质运输中发挥重要作用
雌性昆虫中,卵子发生过程需要大量的脂类物质,这些脂质以卵黄的形式储存起来,并作为能量来源以供胚胎发育[41-42]。然而,昆虫卵母细胞从头合成脂质的能力有限,例如烟草天蛾的卵母细胞自身合成的脂质仅占总脂的1%左右[49]。因此,卵母细胞中大部分脂质都是从其他组织中获得的,据报道,95%的脂质都是由低密度脂蛋白和高密度脂蛋白递送的[49-50]。Coelho等发现长红锥蝽()脂蛋白的密度在卵黄发生和卵巢脂质摄取期间迅速增加[51]。Atella等通过对冈比亚按蚊()的脂蛋白进行放射性同位素标记,发现脂蛋白通过受体介导的内吞作用进入卵母细胞,导致整个卵母细胞形成脂质囊泡[52],而载脂蛋白是脂蛋白的主要成分,表明载脂蛋白在卵巢脂质运输过程中发挥重要作用。Benoit等发现通过RNA干扰抑制采采蝇可导致卵母细胞发育延迟和幼虫期延长[29],然而,目前关于载脂蛋白参与卵巢脂质运输尚缺乏系统深入的研究。本文在有效沉默后,发现飞蝗卵巢显著减小。在此基础上,对飞蝗卵巢脂代谢组学进行深入分析,发现沉默后,有20种甘油三酯显著下调(图3)。SANTOS等研究表明,昆虫卵母细胞中的脂质主要以甘油三酯的形式存在,占中性脂的60%左右[43]。进一步对卵巢中性脂进行染色和测定,发现卵巢中性脂含量显著降低,总甘油三酯含量显著降低(图4),表明在卵巢脂质运输,尤其是甘油脂的运输中发挥重要作用。本研究结果揭示了载脂蛋白LmapoLp-II/I在卵巢发育中的生物学功能,明确了甘油三酯在卵巢发育中的重要作用,可作为分子靶标用于害虫防治。
4 结论
通过研究飞蝗两个载脂蛋白基因(和)的生物学功能,发现是卵巢脂质沉积所需的主要载脂蛋白,对飞蝗卵巢发育起着至关重要的调节作用。
[1] 石旺鹏, 谭树乾. 蝗虫生物防治发展现状及趋势. 中国生物防治学报, 2019, 35(3): 307-324.
SHI W P, TAN S Q. Current status and trend on grasshopper and locust biological control. Chinese Journal of Biological Control, 2019, 35(3): 307-324. (in Chinese)
[2] 张建珍, 柴林, 史学凯, 高璐, 范云鹤. RNA干扰技术与害虫防治. 山西大学学报(自然科学版), 2021, 44(5): 980-987.
ZHANG J Z, CHAI L, SHI X K, GAO L, FAN Y H. RNA interference technology and pest control. Journal of Shanxi University (Natural Science Edition), 2021, 44(5): 980-987. (in Chinese)
[3] 魏琪, 苏建亚. 昆虫糖脂代谢研究进展. 昆虫学报, 2016, 59(8): 906-916.
WEI Q, SU J Y. Research advances in carbohydrate and lipid metabolism in insects. Acta Entomologica Sinica, 2016, 59(8): 906-916. (in Chinese)
[4] PARVY J P, NAPAL L, RUBIN T, POIDEVIN M, PERRIN L, WICKER-THOMAS C, MONTAGNE J.acetyl-CoA-carboxylase sustains a fatty acid-dependent remote signal to waterproof the respiratory system. PLoS Genetics, 2012, 8(8): e1002925.
[5] YU Z T, ZHANG X Y, WANG Y W, MOUSSIAN B, ZHU K Y, LI S, MA E B, ZHANG J Z.: An oenocyte-specific cytochrome P450 gene required for cuticular waterproofing in the migratory locust,. Scientific Reports, 2016, 6: 29980.
[6] WU L X, ZHANG Z F, YU Z T, YU R R, MA E B, FAN Y L, LIU T X, FEYEREISEN R, ZHU K Y, ZHANG J Z. Bothgenes function in decreasing cuticular penetration of insecticides in. Pest Management Science, 2020, 76(11): 3541-3550.
[7] ZHAO X M, YANG Y, NIU N, ZHAO Y Y, LIU W M, MA E B, MOUSSIAN B, ZHANG J Z. The fatty acid elongase geneis required for hydrocarbon biosynthesis and cuticle permeability in the migratory locust,. Journal of Insect Physiology, 2020, 123: 104052.
[8] YANG Y, ZHAO X M, NIU N, ZHAO Y Y, LIU W M, MOUSSIAN B, ZHANG J Z. Two fatty acid synthase genes from the integument contribute to cuticular hydrocarbon biosynthesis and cuticle permeability in. Insect Molecular Biology, 2020, 29(6): 555-568.
[9] LI D T, DAI Y T, CHEN X, WANG X Q, LI Z D, MOUSSIAN B, ZHANG C X. Ten fatty acyl-CoA reductase family genes were essential for the survival of the destructive rice pest,. Pest Management Science, 2020, 76(7): 2304-2315.
[10] BALABANIDOU V, KAMPOURAKI A, MACLEAN M, BLOMQUISTG J, TITTIGER C, JUAREZ M P, MIJAILOVSKY S J, CHALEPAKIS G, ANTHOUSI A, LYND A, ANTOINE S, HEMINGWAY J, RANSON H, LYCETT G J, VONTAS J. Cytochrome P450 associated with insecticide resistance catalyzes cuticular hydrocarbon production in. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(33): 9268-9273.
[11] LIU J Q, LI W X, ZHENG J J, TIAN Q N, HUANG J F, DAI S X. Gain and loss events in the evolution of the apolipoprotein family in vertebrata. BMC Evolutionary Biology, 2019, 19(1): 209.
[12] MAHLEY R W, INNERARITY T L, RALL S C, WEISGRABER K H. Plasma lipoproteins apolipoprotein structure and function. Journal of Lipid Research, 1984, 25(12): 1277-1294.
[13] SU X, PENG D Q. The exchangeable apolipoproteins in lipid metabolism and obesity. Clinica Chimica Acta, 2020, 503: 128-135.
[14] RYAN R O, VAN DER HORST D J. Lipid transport biochemistry and its role in energy production. Annual Review of Entomology, 2000, 45: 233-260.
[15] WEERS P M, VAN MARREWIJK W J, BEENAKKERS A M, VAN DER HORST D J. Biosynthesis of locust lipophorin. Apolipophorins I and II originate from a common precursor. The Journal of Biological Chemistry, 1993, 268(6): 4300-4303.
[16] SMOLENAARS M M, KASPERAITIS M A, RICHARDSON P E, RODENBURG K W, VAN DER HORST D J. Biosynthesis and secretion of insect lipoprotein: involvement of furin in cleavage of the apoB homolog, apolipophorin-II/I. Journal of Lipid Research, 2005, 46(3): 412-421.
[17] VAN DER HORST D J, RODENBURG K W. Lipoprotein assembly and function in an evolutionary perspective. Biomolecular Concepts, 2010, 1(2): 165-183.
[18] WEERS P M, RYAN R O. Apolipophorin III: role model apolipoprotein. Insect Biochemistry and Molecular Biology, 2006, 36(4): 231-240.
[19] COLE K D, FERNANDO-WARNAKULASURIYA G P, BOGUSKI M S, FREEMAN M, GORDON J I, CLARK W A, LAW J H, WELLS M A. Primary structure and comparative sequence analysis of an insect apolipoprotein. Apolipophorin-III from. The Journal of Biological Chemistry, 1987, 262(24): 11794-11800.
[20] WEN D H, LUO H, LI T N, WU C F, ZHANG J H, WANG X L, ZHANG R. Cloning and characterization of an insect apolipoprotein (apolipophorin-II/I) involved in the host immune response of. Developmental & Comparative Immunology, 2017, 77: 221-228.
[21] SUNDERMEYER K, HENDRICKS J K, PRASAD S V, WELLS M A. The precursor protein of the structural apolipoproteins of lipophorin: cDNA and deduced amino acid sequence. Insect Biochemistry and Molecular Biology, 1996, 26(8/9): 735-738.
[22] KANOST M R, BOGUSKI M S, FREEMAN M, GORDON J I, WYATT G R, WELLS M A. Primary structure of apolipophorin-III from the migratory locust,. Potential amphipathic structures and molecular evolution of an insect apolipoprotein. The Journal of Biological Chemistry, 1988, 263(22): 10568-10573.
[23] VAN HEUSDEN M C, THOMPSON F, DENNIS J. Biosynthesis oflipophorin and gene expression of its apolipoproteins. Insect Biochemistry and Molecular Biology, 1998, 28(10): 733-738.
[24] PALM W, SAMPAIO J L, BRANKATSCHK M, CARVALHO M, MAHMOUD A, SHEVCHENKO A, EATON S. Lipoproteins in—Assembly, function, and influence on tissue lipid composition. PLoS Genetics, 2012, 8(7): e1002828.
[25] TSUCHIDA K, WELLS M. Digestion, absorption, transport and storage of fat during the last larval stadium of. Changes in the role of lipophorin in the delivery of dietary lipid to the fat body. Insect Biochemistry, 1988, 18(3): 263-268.
[26] KONUMA T, TSUKAMOTO Y, NAGASAWA H, NAGATA S. Imbalanced hemolymph lipid levels affect feeding motivation in the two-spotted cricket, G. PLoS One, 2016, 11(5): e0154841.
[27] BOGERD J, BABIN P J, KOOIMAN F P, ANDRé M, BALLAGNY C, VAN MARREWIJK W J, VAN DER HORST D J. Molecular characterization and gene expression in the eye of the apolipophorin II/I precursor from. Journal of Comparative Neurology, 2000, 427(4): 546-558.
[28] ZHAO Y, LIU W, ZHAO X, YU Z, GUO H, YANG Y, ZHANG J, MOUSSIAN B, ZHANG J. Apolipophorin-II/I contributes to cuticular hydrocarbon transport and cuticle barrier construction in. Frontiers in Physiology, 2020, 11: 790.
[29] BENOIT J B, YANG G, KRAUSE T B, PATRICK K R, AKSOY S, ATTARDO G M. Lipophorin acts as a shuttle of lipids to the milk gland during tsetse fly pregnancy. Journal of Insect Physiology, 2011, 57(11): 1553-1561.
[30] VAN DER HORST D J, RODENBURG K W. Locust flight activity as a model for hormonal regulation of lipid mobilization and transport. Journal of Insect Physiology, 2010, 56(8): 844-853.
[31] ZDYBICKA-BARABAS A, CYTRYŃSKA M. Apolipophorins and insects immune response. Invertebrate Survival Journal, 2013, 10(1): 58-68.
[32] DHAWAN R, GUPTA K, KAJLA M, KAKANI P, CHOUDHURY T P, KUMAR S, KUMAR V, GUPTA L. Apolipophorin-III acts as a positive regulator ofdevelopment in. Frontiers in Physiology, 2017, 8: 185.
[33] KIM B Y, JIN B R. Apolipophorin III from honeybees () exhibits antibacterial activity. Comparative Biochemistry and Physiology Part B: Biochemistry and Molecular Biology, 2015, 182: 6-13.
[34] NIERE M, MEISSLITZER C, DETTLOFF M, WEISE C, ZIEGLER M, WIESNER A. Insect immune activation by recombinantapolipophorin III. Biochimica et Biophysica Acta, 1999, 1433(1/2): 16-26.
[35] NOH J Y, PATNAIK B B, TINDWA H, SEO G W, KIM D H, PATNAIK H H, JO Y H, LEE Y S, LEE B L, KIM N J, HAN Y S. Genomic organization, sequence characterization and expression analysis ofapolipophorin-III in response to an intracellular pathogen,. Gene, 2014, 534(2): 204-217.
[36] PALUSINSKA-SZYSZ M, ZDYBICKA-BARABAS A, RESZCZYNSKA E, LUCHOWSKI R, KANIA M, GISCH N, WALDOW F, MAK P, DANIKIEWICZ W, GRUSZECKI W I, CYTRYNSKA M. The lipid composition ofmembrane modulates the interaction withapolipophorin III. Biochimica et Biophysica Acta, 2016, 1861(7): 617-629.
[37] WEN D H, WANG X L, SHANG L, HUANG Y, LI T N, WU C F, ZHANG R, ZHANG J H. Involvement of a versatile pattern recognition receptor, apolipophorin-III in prophenoloxidase activation and antibacterial defense of the Chinese oak silkworm,. Developmental & Comparative Immunology, 2016, 65: 124-131.
[38] WIJERATNE T U, WEERS P M M. Lipid-bound apoLp-III is less effective in binding to lipopolysaccharides and phosphatidylglycerol vesicles compared to the lipid-free protein. Molecular and Cellular Biochemistry, 2019, 458(1/2): 61-70.
[39] YU H Z, WANG J, ZHANG S Z, TOUFEEQ S, LI B, LI Z, YANG L A, HU P, XU J P. Molecular characterisation ofgene inand its roles in response to bacterial infection. Journal of Invertebrate Pathology, 2018, 159: 61-70.
[40] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod. Methods, 2001, 25(4): 402-408.
[41] LEYRIA J, FRUTTERO L L, AGUIRRE S A, CANAVOSO L E. Ovarian nutritional resources during the reproductive cycle of the hematophagous(Hemiptera: Reduviidae): focus on lipid metabolism. Archives of Insect Biochemistry and Physiology, 2014, 87(3): 148-163.
[42] ATELLA G C, GONDIM K C, MACHADO E A, MEDEIROS M N, SILVA-NETO M A, MASUDA H. Oogenesis and egg development in triatomines: a biochemical approach. Anais da Academia Brasileira de Ciencias, 2005, 77(3): 405-430.
[43] SANTOS R, ROSAS-OLIVEIRA R, SARAIVA F B, MAJEROWICZ D, GONDIM K C. Lipid accumulation and utilization by oocytes and eggs of. Archives of Insect Biochemistry and Physiology, 2011, 77(1): 1-16.
[44] RUBIN E M, KRAUSS R M, SPANGLER E A, VERSTUYFT J G, CLIFT S M. Inhibition of early atherogenesis in transgenic mice by human apolipoprotein AI. Nature, 1991, 353(6341): 265-267.
[45] ROSES A D. Apolipoprotein E alleles as risk factors in Alzheimer’s disease. Annual Review of Medicine, 1996, 47: 387-400.
[46] MASUCCI-MAGOULAS L, GOLDBERG I J, BISGAIER C L, SERAJUDDIN H, FRANCONE O L, BRESLOW J L, TALL A R. A mouse model with features of familial combined hyperlipidemia. Science, 1997, 275(5298): 391-394.
[47] SHACHTER N S. Apolipoproteins C-I and C-III as important modulators of lipoprotein metabolism. Current Opinion in Lipidology, 2001, 12(3): 297-304.
[48] HANADA Y, SEKIMIZU K, KAITO C. Silkworm apolipophorin protein inhibitsvirulence. The Journal of Biological Chemistry, 2011, 286(45): 39360-39369.
[49] KAWOOYA J K, LAW J H. Role of lipophorin in lipid transport to the insect egg. The Journal of Biological Chemistry, 1988, 263(18): 8748-8753.
[50] CANAVOSO L E, JOUNI Z E, KARNAS K J, PENNINGTON J E, WELLS M A. Fat metabolism in insects. Annual Review of Nutrition, 2001, 21: 23-46.
[51] COELHO H S, ATELLA G C, MOREIRA M F, GONDIM K C, MASUDA H. Lipophorin density variation during oogenesis on. Archives of Insect Biochemistry and Physiology, 1997, 35(3): 301-313.
[52] ATELLA G C, SILVA-NETO M A C, GOLODNE D M, AREFIN S, SHAHABUDDIN M.lipophorin: Characterization and role in lipid transport to developing oocyte. Insect Biochemistry and Molecular Biology, 2006, 36(5): 375-386.
Effects of apolipophorin on ovarian development and lipid deposition in

1Institute of Applied Biology/Shanxi Key Laboratory of Nucleic Acid Biopesticides, Shanxi University, Taiyuan 030006;2College of Life Science, Shanxi University, Taiyuan 030006
【Background】Lipids are one of the important nutrients required by organisms, which play important physiological functions, including diapause, flight, embryonic development and energy regulation in insects. Apolipophorins (apoLps) are the main components of insect lipophorin particles, which are involved in the transport of lipids among different tissues.【Objective】The objective of this study is to investigate the function of apolipophorins (and) by RNA interference (RNAi) in ovarian lipid transport in, and to provide a new molecular target for pest control.【Method】RNAi was performed to silence two apolipophorin genes (and) at 1 day post adult eclosion (1 PAE), respectively. dswas used as control, 15 μg dsRNA was injected into each insect. The ovaries at 4, 6 and 8 PAE were dissected and observed after dsRNA injection. The silencing efficiency ofin the ovaries at 8 PAE was analyzed by reverse-transcription quantitative PCR (RT-qPCR), andwas used as internal reference gene. Lipidomics technique was used to determine and analyze the differences of lipid metabolites in the ovaries between ds- and ds-treated groups. The approach combining the fold change, thevalue and the VIP value of the OPLS-DA model was adopted to screen for differential abundance of lipids. The contents of neutral lipids and total triglycerides were determined by Bodipy staining and triglyceride assay kit.【Result】After injection of dsand ds, the expression level of target genes could be significantly silenced by 80.84% and 92.89%, respectively. RNAi-mediated silencing ofled to a retarded ovarian development, with significantly decreased neutral lipid content and triglyceride content, while the ovaries ofinjected with dswere the same as those in the control group, which could develop normally and gradually grow larger, with the color gradually changing from white to yellow. Aftersilencing, a total of 1 166 up-regulated metabolites and 1 384 down-regulated metabolites were detected by lipidomics analysis, of which 20 triglycerides were significantly down-regulated.【Conclusion】is a major apolipophorin gene that affects ovarian development and is involved in the accumulation and transport of ovarian lipids. These research results not only enrich the research content of lipid metabolism in insects, but also help to find new targets for pest control.
; apolipophorin; RNA interference (RNAi); ovary; lipid transport

2023-10-20;
2023-11-28
国家重点研发计划(2022YFE0196200)
赵艺妍,E-mail:490051225@qq.com。通信作者张建珍,E-mail:zjz@sxu.edu.cn
(责任编辑 岳梅)
