甘蓝型油菜光叶性状的遗传分析及基因定位
2024-03-08关志林靳丰蔚刘婷婷王毅谭莹莹杨春慧李蕊彤王博刘克德董云
关志林,靳丰蔚,刘婷婷,王毅,谭莹莹,杨春慧,李蕊彤,王博,刘克德,董云
甘蓝型油菜光叶性状的遗传分析及基因定位

1甘肃省农业科学院作物研究所,兰州 730070;2华中农业大学作物遗传改良全国重点实验室,武汉 430070;3武汉基诺赛克科技有限公司,武汉 430070
【目的】表皮蜡质是覆盖植物叶片和茎秆等部位的疏水层,在植物抵御逆境方面发挥着重要作用,同时会影响光合作用和生长发育;甘蓝型油菜作为世界上主要的油料作物之一,研究表皮蜡质突变体的遗传机制,为实现油菜高产稳产提供参考。【方法】对油菜光叶突变体M8和普通蜡质叶中双11(ZS11)和C20的叶片表征进行记载,使用便携式植物光合作用测量系统测定叶片光合速率;利用M8和ZS11、C20分别杂交获得2个F1、自交构建2个F2分离群体,用于分析油菜光叶性状的遗传规律;选取M8和ZS11杂交的F2群体中光叶和蜡质叶表型单株分别进行混池,通过集团分离分析法结合靶向测序技术进行基因克隆,结合比较基因组和转录组数据进行候选基因预测,并通过RT-PCR验证候选基因。【结果】甘蓝型油菜光叶表型叶片气孔导度更大、光合效率更高;遗传分析表明M8光叶性状受1对基因控制,光叶相对蜡质叶为隐性。图位克隆将光叶控制基因定位至A08染色体0.134—0.699 Mb物理区间内。进一步分析发现,相比于ZS11,光叶突变体M8中A08染色体0.22—0.58 Mb区间存在大片段缺失,ZS11在该区段中的()可能为光叶的候选基因,该基因编码一个Kelch-F-box蛋白,在ZS11叶片中表达量高而M8中未检测到,该基因缺失可能导致了M8光叶表型。【结论】甘蓝型油菜光叶新突变体M8相比野生型蜡质叶片光合速率更高,该光叶表型受1对隐性基因控制;图位克隆鉴定到光叶性状调控基因为,基因缺失产生了光叶表型。
甘蓝型油菜;光叶;蜡质;图位克隆;
0 引言
【研究意义】甘蓝型油菜是我国乃至世界上主要的油料作物之一,同时也具有饲用、观赏、菜用、肥用等其他功能。在油菜的生长发育过程中,高温、干旱和病虫害不利环境因素会造成严重产量降低和品质下降[1-2]。叶片是植物进行光合作用及蒸腾作用的主要场所,叶片表面蜡质是疏水层,表现为白霜蜡状,在陆生植物抵御环境缺水、紫外线等逆境过程中发挥重要作用[3-5]。此外,表皮蜡质还可以减少叶表面灰尘、碎屑附着,有助于植物自清洁,提高叶片等光合作用效率[6-7]。通常情况,叶片表皮蜡质缺失在视觉上表现为更光滑、明亮[7-9],称为光叶;也有部分植物中光叶是叶表皮蜡质增加、排布发生变化引起[10-11]。利用光叶突变体解析油菜表皮蜡质形成机制对于提高油菜抗逆能力、实现高产稳产具有重要意义。【前人研究进展】植物表皮蜡质通常形成晶体,下方的蜡分子嵌入角质层,由外到内可分为突出蜡质、平铺表层蜡质、内层蜡质和角质四层[12-13]。表皮蜡质主要由超长链脂肪酸(very long chain fatty acids,VLCFAs,C20—C34)、VLCFAs衍生物(醛、醇、酮等)、VLC烷烃和蜡酯等组成[14]。蜡质组成和含量、形态和覆盖率,以及生长环境条件均会改变蜡质的性质,从而使植物在应对逆境的能力发生差异[15]。蜡质在表皮细胞中合成[16],蜡质合成包括C16/C18长链脂肪酸从头合成、延伸形成超长链脂肪酸和进一步衍生化3个阶段。其中,C16/C18长链脂肪酸从头合成与油脂代谢相同,在叶片细胞质体中进行[17]。其次是在内质网中C16/C18长链脂肪酸延伸为VLCFAs[18],蜡质基因/是该过程关键基因,结合脂肪酸延长酶可将C18等延伸至C28,最高可达C34;突变会导致茎秆和花粉VLCFAs缺陷、蜡质含量大为减少[19]。VLCFAs衍生化分为烷烃合成途径和醇合成途径2个衍生化分支[18],拟南芥中超过80%蜡质通过烷烃合成途径生成[3],与编码一种参与产生超长链烷烃(蜡的主要成分)的生物合成酶,是烷烃合成途径中关键基因[20]。通过醇合成途径调控蜡质合成[10]。蜡质合成还受多种转录因子调节[21-22],在内质网合成后,还需转运蛋白介导胞外运输[23]。【本研究切入点】油菜是白菜和甘蓝杂交形成的异源四倍体,与拟南芥同属十字花科,但是由于基因组多倍化和染色体重排,变异更为复杂,光叶性状的研究也起步较晚。油菜的祖先种白菜和甘蓝中,拟南芥的同源基因均被证实调控蜡质[24-25],同源基因也被定位[24, 26],而相关基因功能还需进一步研究。油菜中,突变体光叶性状受2对隐形基因控制,分别位于A01和C01染色体[27],后被证实为的同源基因[28]。目前,甘蓝型油菜中克隆的蜡质相关基因较少,相关调控机制也不明确。【拟解决的关键问题】本研究以油菜光叶突变体M8和正常蜡粉叶品种中双11杂交构建F2分离群体,利用BSA(bulked segregation analysis)结合靶向测序(target-seq)的快速定位技术对甘蓝型油菜光叶性状控制基因进行定位,确定候选基因,为油菜蜡质形成机理解析奠定基础,对油菜叶片表皮蜡质的改良及辅助油菜高光效新品种选育具有重要意义。
1 材料与方法
1.1 试验材料
在利用EMS诱变甘蓝型油菜三系杂交种陇油10号父本C20(野生型,普通蜡质叶)获得的突变体中,鉴定到一个稳定遗传的光叶株系,命名M8。光叶突变体M8与普通蜡质叶常规品种中双11(ZS11)、C20分别杂交并自交,收获的F1和F2群体用于遗传分析,M8与ZS11组合的F2分离群体共计2 094个单株用于基因精细定位。所有材料均种植于甘肃省农业科学院油菜育种基地和华中农业大学试验田。
1.2 性状调查及光合作用测定
油菜植株长至5—6片真叶时进行表型调查,2人一组通过肉眼观察叶片表面有无蜡粉并记录。对F2群体各单株表型调查2次并记录,2次鉴定一致、确保表型无误后进行后续统计分析。
为了探索叶片蜡粉有无对油菜品种光合作用的影响,使用便携式植物光合作用测量系统LI-6800(美国LI-COR)对3个亲本的苗期植株进行光合作用的测定,测定时间为2022年1月18日13:00—14:00。计算公式为A(µmol·m-2·s-1)=F(Cr-Cs)/100S-Cs×E,其中,A表示CO2净同化速率,F是气流量(µmol·s-1),S是叶面积(cm2),Cr和Cs是参比室和样品室的CO2浓度(µmol CO2·mol air-1),E是叶片表面蒸腾速率;气孔导度单位为mol·m-2·s-1。采用Microsoft Excle计算数据的显著性。
1.3 光叶性状的遗传分析
光叶突变体M8与有蜡质的常规品种中双11(ZS11)、C20分别杂交获得F1代、自交获得F2群体,观察蜡质表型;统计2个F2群体中光叶(突变体类型)和普通蜡质叶数目,进行卡方检测。
1.4 BSA混池及测序
按照田间编号对F2群体进行取样,每单株取0.25 g叶片放入96孔深孔板中,采用改良CTAB法[29]提取DNA,并通过琼脂糖凝胶电泳检测所提DNA的质量。BSA分析[30]混样:根据F2群体表型结果,随机选取30个光叶单株DNA和30个普通蜡质叶单株DNA,利用Qubit 2.0(Thermo Fisher,USA)测定DNA浓度后,将30个光叶单株和30个蜡质叶单株的DNA分别等量混合构成光叶DNA混池(Bulk-G)和蜡质叶DNA混池(Bulk-L),将2个混池和亲本DNA浓度调整至25 ng·µL-1。混合好的DNA交由武汉基诺赛克科技有限公司进行文库构建并测序,文库构建主要流程包括DNA片段化、末端修复并连接接头、片段筛选、磁珠纯化等,经过质检、定量后,在HiSeq 4000平台上进行Paired-end 150 bp(PE150)测序。
1.5 BSA测序数据分析
采用FastQC软件(https://www.bioinformatics. babraham.ac.uk/projects/fastqc/)检测PE150测序原始序列的质量,并通过Trimmomatic软件[31]对测序数据进行质量控制。随后经由BWA[32]与ZS11参考基因组[33](http://yanglab.hzau.edu.cn/BnIR)比对,再利用GATK[34]提取全基因组范围变异信息,用ANNOVAR[35]对提取的全部变异信息进行注释。BWA和Samtools软件分析均使用默认参数,GATK软件使用参数“QUAL<30.0||QD<4.0||FS>60.0||MQ<40.0”过滤。
1.6 候选基因的初定位
以ZS11高质量基因组序列作为参考,利用QTLseqr软件[36]计算每个变异位点在Bulk-G和Bulk-L中的SNP-index,进一步计算Δ(SNP-index)衡量2个混池的等位基因频率差异。使用滑窗分析方法(滑窗大小为500 kb)计算SNP-index及Δ(SNP-index)的平均值,并对其在染色体上的分布进行作图(步长2 Mb)。2个混池中差异较大的区段即为该油菜突变体光叶性状控制基因所在的候选区段。
使用ANNOVAR软件对初定位区间的变异进行注释并预测变异对邻近基因功能的影响。根据变异位点及邻近基因在参考基因组上的位置信息即可得到变异位点在基因组的区域(基因间区、基因区或CDS区等)及变异对基因产生的影响(同义、非同义突变等)。
1.7 光叶基因的精细定位
为了进一步缩小区间,根据BSA初定位区间的变异信息开发分子标记,通过Target-seq进行精细定位。基于ZS11参考基因组,在初定位区间内使用Primer3软件(version 2.5.0)设计16个SNP标记的引物,分别对亲本M8和ZS11和F2群体2 094个单株进行PCR扩增;PCR产物直接进行建库测序,并利用生物信息分析进行测序序列的比对与变异位点检测,并进行基因分型。Target-seq及基因分型由武汉基诺赛克科技有限公司辅助完成。结合表型与基因型结果筛选交换单株,缩小定位区间。
1.8 基因表达量测定及数据来源
取M8和ZS11幼嫩叶片,用常规的Trizol Reagent方法提取RNA,并检测其完整性。使用RevertAid First strand cDNA synthesis kit(Thermo scientific, USA)试剂盒反转录合成第一链cDNA,将反转录产物浓度调整至50 ng·µL-1,作为qPCR的模板。参照SYBR Green master mixture(Roche)说明书进行qPCR反应。以油菜Epsin N-terminal homology()为内参基因,每个生物学样品设3个技术重复。引物见电子附表1。利用2-ΔΔCt法计算基因的相对表达量,低表达量计为1(Livak and Schmittgen 2001)。
在定位区段,根据基因的功能注释信息推断候选基因。在候选基因的时空表达分析中,候选基因及其同源基因在ZS11各组织各时期的基因表达量数据来源于ZS11转录组数据库(http://yanglab.hzau.edu.cn/ BnIR)[37],包括根、茎、叶、花、果、种等共计6个组织80个样本。
2 结果
2.1 油菜光叶突变体叶片表型特征
前期在甘蓝型油菜三系杂交种陇油10号父本C20通过EMS诱变群体中鉴定到光叶突变体M8,连续多代自交和田间观察发现该突变体光叶性状能稳定遗传。与野生型蜡质叶自交系C20及普通蜡质叶油菜品种中双11相比,光叶材料M8的叶片表现得更加嫩绿,且表面光滑、明亮;而ZS11普通蜡质叶正面和背面均覆盖一层明显的白色蜡质,叶面粗糙没有光泽、易附着尘屑(图1-a—b)。
通过测定普通蜡质叶与光叶的净光合速率,发现光叶突变体M8叶片CO2净同化速率最高(图1-c),平均为(27.57±1.28) µmol·m-2·s-1,而普通蜡质叶ZS11和野生型C20叶片中CO2净同化速率分别为(24.51±1.29)和(20.16±1.38) µmol·m-2·s-1。光叶突变体CO2净同化速率显著高于普通蜡质叶ZS11和野生型蜡质叶C20。同时,光叶突变体M8的气孔导度((0.519±0.014) mol·m-2·s-1)极显著大于普通蜡质叶ZS11((0.395±0.028) mol·m-2·s-1)和野生型蜡质叶C20((0.271±0.015) mol·m-2·s-1)。光叶突变体可能因为叶表蜡质变化、叶表光滑清洁等导致气孔导度更大,光合速率更快。
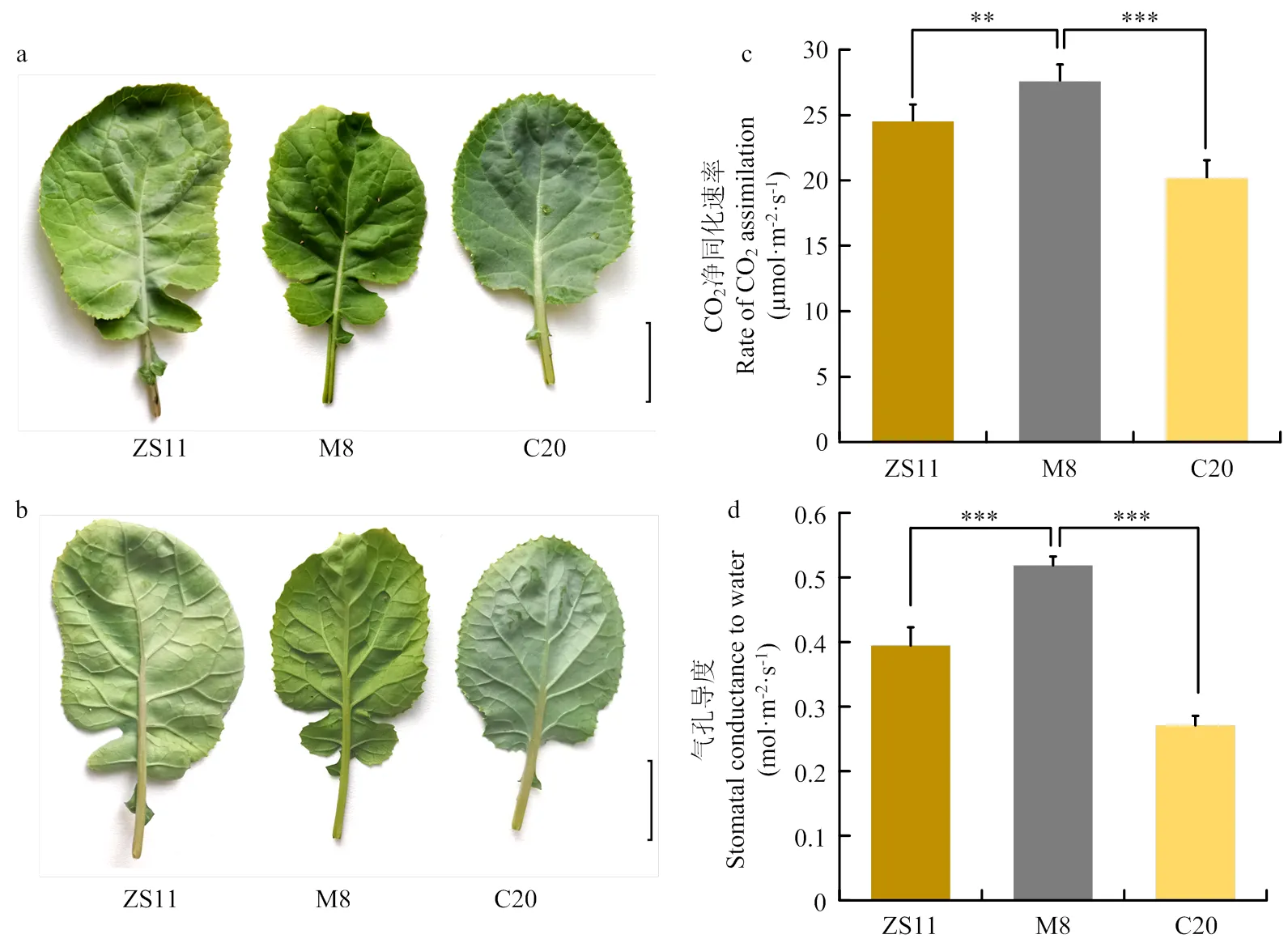
a:叶片正面;b:叶片背面;c:叶片CO2净同化速率;d:气孔导度。bar=20 cm
a: Photographs of the front leaves; b: Photographs of the back leaves; c: The net CO2assimilation rate; d: The stomatal conductance to water. bar=20 cm
图1 甘蓝型油菜光叶和普通蜡质叶品种间的性状及净光合速率比较
Fig. 1 Comparison of characteristics and net photosynthetic rate of cultivars with glossy- and waxy- leaf in
2.2 油菜光叶性状的遗传分析
以光叶材料M8为父本,分别以普通蜡质叶品系ZS11和野生型C20为母本杂交获得F1,2个杂交组合的F1单株均表现为普通蜡质叶,说明光叶性状为隐性。F1单株分别自交获得2个组合的F2群体,均分离出光叶表型单株(表1)。M8和ZS11杂交的F2群体443个单株中,光叶表型95个单株,普通蜡质叶表型348个单株,光叶与普通蜡质叶性状单株数量之比经卡方验证符合1﹕3分离(χ2=2.80<3.84= χ20.05)。M8和C20杂交的F2群体中,光叶表型109个单株,普通蜡质叶表型275个单株,光叶与普通蜡质叶性状单株数量之比经卡方验证符合1﹕3分离(χ2=2.17<3.84=χ20.05)。对2个F2分离群体的遗传分析均表明,突变体M8光叶性状受单个隐性基因控制。
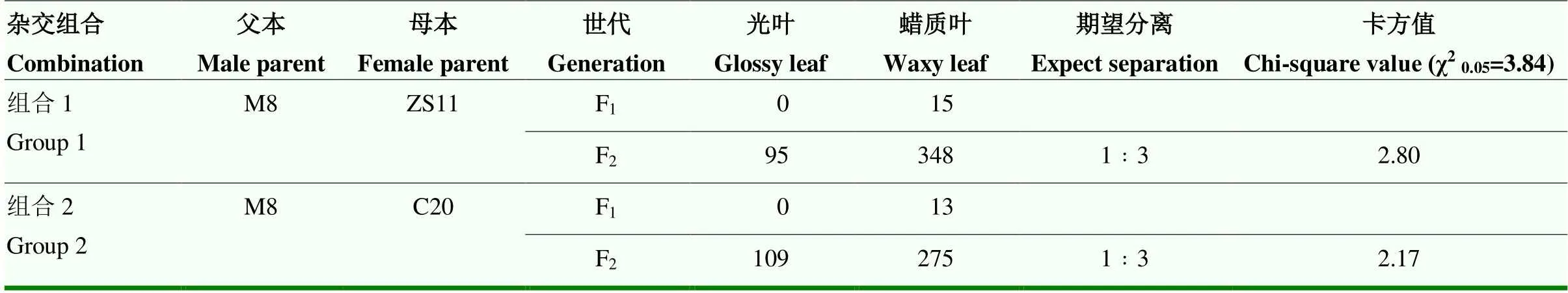
表1 光叶和普通蜡质叶F2单株分离的卡方测验
2.3 油菜光叶性状控制基因初定位
由于ZS11已有高质量基因组序列作为参考,选用M8和ZS11杂交的F2群体用于基因定位。BSA测序结果统计分析显示,亲本M8和ZS11分别获得82 441 310条和68 380 245条双端序列,混池Bulk-G和Bulk-L分别得到175 668 813和121 874 422条序列,样本平均测序数据量为32 G。
测序数据分别与ZS11参考基因组比对,比对率超过87.61%,覆盖度达78%—87%。变异检测共获得482 322个SNP(single nucleotide polymorphism)和57 461个InDel(insertions or deletion),SNP中约61%为C/T或A/G变异,在19条染色体上均匀分布,平均每Mb含有502个SNP和60个Indel。利用BSA-seq常用软件QTLseqr[21]分别计算光叶混池Bulk-G和普通叶混池Bulk-L的SNP-index及Δ(SNP-index),以2 Mb区间为滑动窗口考察Δ(SNP-index)在全基因上的分布(图2),结果显示,在A08染色体0.13—2.40 Mb区间内Δ(SNP-index)超过阈值,表明甘蓝型油菜光叶基因可能位于该区间内。

红色箭头表示Δ(SNP-index)超过阈值(灰色线,=0.0001)的区域
Red arrow indicates the region where the value of Δ(SNP-index) exceeds the threshold (gray line,=0.0001)
图2 BSA-seq定位甘蓝型油菜光叶候选基因
Fig. 2 Genetic mapping of candidate glossy leaf genes by BSA-seq in
甘蓝型油菜光叶基因候选区间A08:0.13—2.40 Mb内共含有287个注释基因。这段长度为2.27 Mb的物理区间内含1 071个SNP和174个InDel,25.8%位于基因间区,60.0%位于基因区,其余14.2%位于基因上游或下游区域。其中,有143个SNP和33个InDel导致共移码突变或提前终止,最终导致氨基酸序列改变。
2.4 油菜光叶性状控制基因精细定位
为进一步精细定位该光叶控制基因,利用初定位获得的变异信息,在候选区间内开发了16个SNP标记(表2),利用Target-seq对M8和ZS11杂交的F2群体全部单株进行基因分型。16个SNP标记中,P2、P3、P4这3个标记表现为显性外,其余13个标记均为共显性,均获得较为完整的基因型信息。结合重点交换单株及叶片蜡质有无表型,将目的基因定位于标记P1和P5之间(图3),对应ZS11基因组A08染色体133 863—698 791 bp物理区间。在定位群体中,显性标记P2、P3、P4与叶片蜡质有无表型呈共分离。

表2 A08染色体分子标记信息
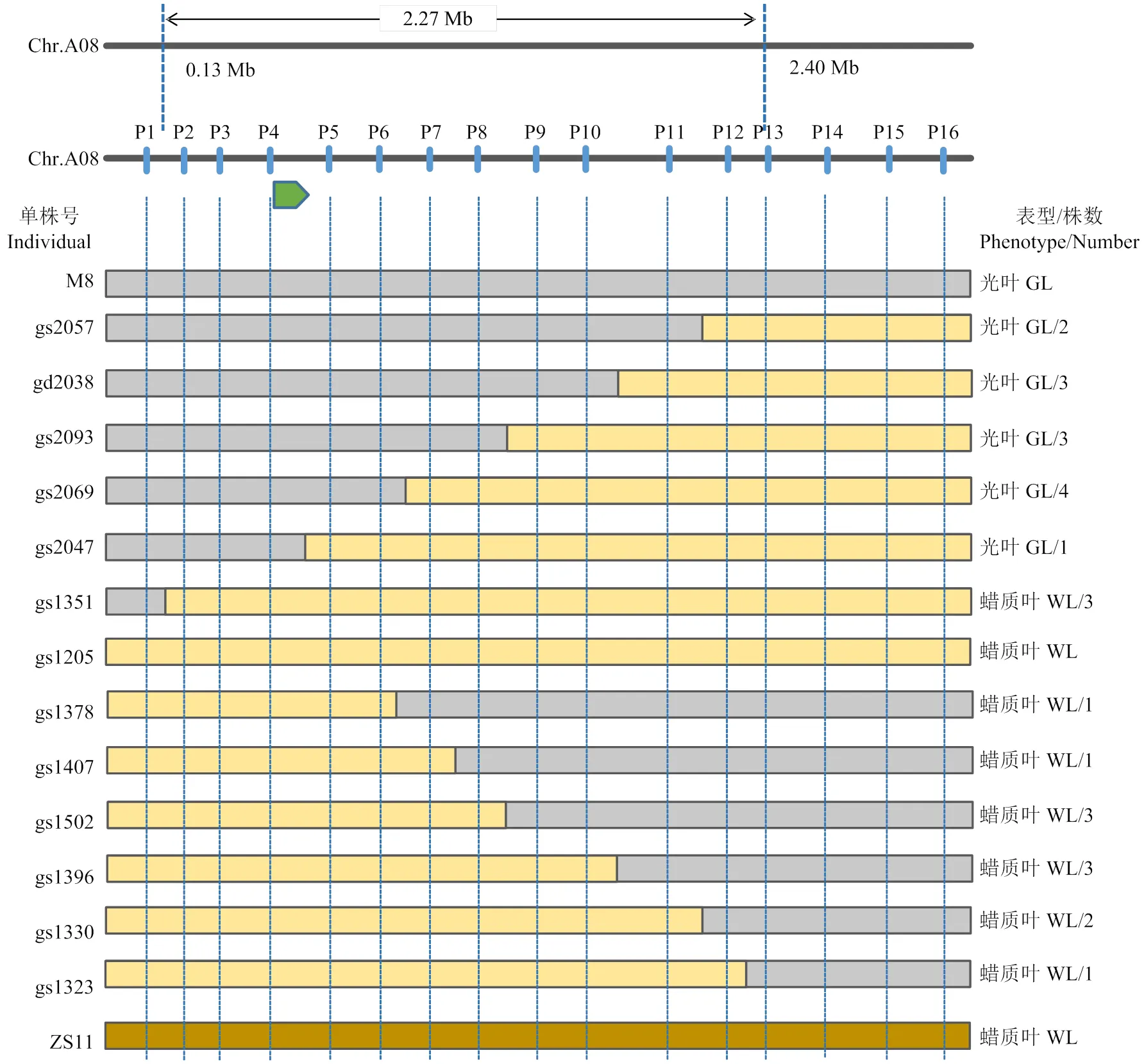
图中从上至下为油菜光叶基因精细定位标记及重点交换单株基因型示意图。M8为光叶突变体,gs1205为基因型全杂合的普通蜡质叶单株,浅绿色部分表示M8类基因型,橙色为ZS11类基因型,淡黄色部分表示杂合基因型;GL:光叶,WL:蜡质叶
The diagram shows the fine mapping markers and key exchange of single plant genotypes for rapeseed light leaf genes. M8 is the glossy leaf mutant, gs1205 is a common waxy leaf individual with heterozygous genotypes. The light green part represents the M8-genotype, the orange part represents the ZS11-genotype, and the light yellow part represents the heterozygotes. GL: glossy leaf trait, WL: waxy leaf trait
图3 甘蓝型油菜光叶候选基因的精细定位
Fig. 3 Fine mapping of candidate glossy leaf genes in
鉴于位于精细定位的A08染色体0.1338—0.6988 Mb区间内的P2、P3、P4 3个标记基因分型失败,检测了亲本及2个混池二代测序数据在A08染色体上的覆盖,发现光叶突变体M8及光叶混池Bulk-G在0—0.6 Mb区间内平均覆盖测序reads数偏低,而ZS11和普通蜡质叶混池Bulk-L测序reads覆盖正常(图4-a),推测光叶突变体M8在0—0.6 Mb物理区间可能存在片段缺失。为验证这一推测,在该区间内间隔50 kb物理距离分段设计9对引物扩增亲本ZS11及M8中的基因组中对应9个片段(Fr.1—Fr.9,表3),除Fr.9外,其余8个目标片段只在ZS11检测到扩增产物,而光叶突变体M8没有检测到扩增产物(图4-b),证实光叶突变体M8中A08染色体上对应ZS11基因组0.22—0.58 Mb区间存在缺失(图4-c),具体缺失断点仍有待进一步验证。
2.5 油菜光叶性状候选基因鉴定及基因表达分析
在光叶基因定位区段内,ZS11参考基因组共注释了75个基因。根据ZS11全转录组数据库显示(http://yanglab.hzau.edu.cn/BnIR/),其中,有9个基因在ZS11全部组织均未表达,有24个基因在叶片中不表达,因此,可以排除这些基因。另外42个基因主要编码丝氨酸乙酰转移酶、线粒体导入内膜转位酶亚基、磷脂酰肌醇转运蛋白、F-box蛋白、光系统Ⅰ反应中心亚基Ⅴ、TATA-box结合蛋白、谷氨酰胺依赖性NAD+合成酶、功能未知蛋白等。其中,基因(A08:532 818..534 788)对应拟南芥同源基因,编码一个富含Kelch重复序列的F-box(Kelch-F-box)蛋白,又名SAGL1(SMALL AND GLOSSY LEAVES1)。拟南芥和突变体表现为叶片小而肥厚、有光泽[38],与M8光叶表型相似,因此,推测()为光叶候选基因,突变体M8光叶表型可能因缺失该基因导致。

a:中双11、突变体M8、Bulk-L和Bulk-G 4个样品A8染色体上测序read覆盖度和测序深度;b:ZS11和M8中9个片段的扩增结果;c:光叶突变体M8中A08染色体片段缺失示意图,红色箭头为目标候选基因
a: The coverage and depth distribution map on of the sequencing data of 4 samples including ZS11, M8, Bulk-L and Bulk-G; b: the PCR amplification results of 9 fragments in ZS11 and M8; c: Schematic diagram of fragment deletion on A08 chromosome in the glossy leaf mutant M8, and the red arrow represents the target candidate gene
图4 甘蓝型油菜光叶突变体M8中A08染色体存在片段缺失
Fig. 4 Fragment deletion on A08 chromosome in theglossy leaf mutant M8
在甘蓝型油菜中鉴定到6个拟南芥()的同源拷贝,分别位于A08/C03、A05/ C06、A06/C06染色体。拟南芥中,调控的靶基因[38]在油菜中有位于A02/C02和A10/ C09染色体的4个同源拷贝。油菜和与拟南芥同源性较高,在中双11的根、茎、叶等7个组织中,表达水平最高,尤其是根、叶、角果皮等裸露、接触光和空气等部位(图5-a—b)。通过检测光叶突变体M8和蜡质叶ZS11叶片和的表达水平,发现M8中的几乎不表达,而ZS11中的高表达;在M8和ZS11中均不表达(图5-c)。同时,在M8中表达量高出ZS11约12倍,在M8中表达量高出ZS11约5倍(图5-d),进一步说明可能为M8光叶性状控制基因。
表4 基因表达量分析引物信息
在油菜ZS11叶片中,在新叶中表达水平低,老叶中表达水平高;而和相反,在新叶中表达水平高,老叶中表达水平低(图5-e—f);角果皮是油菜角果成熟时期的主要光和器官,成熟过程中,角果皮中表达不断增强,和表达呈同样降低趋势(图5-g—h)。与表达趋势相反,暗示油菜中可能与拟南芥存在相似的调控机制,即通过调控表皮蜡质合成,同时,表皮蜡质与光合作用相关。
3 讨论
3.1 植物表皮蜡质具有多重保护作用
植物角质层的发育是陆生植物进化的关键步骤,叶片表皮蜡质作为一道保护植物的屏障不仅可以抵御干旱,防止病虫害侵入,还可以防止强光辐射等逆境伤害。本研究光叶突变体M8气孔导度更大,光合效率高。在抗病表现上,光叶可能也是优势性状;从图1-b可明显看出,有蜡质的ZS11叶片背面有白色菌丝(白粉病)附着,而光叶突变体M8背面光滑、无明显附着,可见光叶赋予叶片更强的自洁能力。
3.2 油菜光叶性状可作为形态标记利用
叶片表皮蜡质有无是一个肉眼可识别的形态特征,在油菜育种中还可发挥形态标记作用,如将光叶性状与育性关联可用于鉴定、选育不育系和恢复系[39-40]。本研究光叶突变体M8来源于三系杂交种陇油10号父本,M8携带相应的恢复基因,光叶可作为形态标记在选育新的恢复系,还可以应用于品系去杂。近年来,薹用油菜越来越受到重视,光叶由于叶片亮绿、食用品质好,还可用于蔬菜杂交制种。
3.3 油菜光叶性状产生与叶表蜡质含量和结构相关
油菜中发现的光叶突变体多为隐性,与前人研究[27-28]光叶性状受2对隐性基因控制不同,本研究突变体M8光叶表型受单对隐性基因控制,遗传上更为简单。油菜与拟南芥亲缘关系近,BnaA08.SAGL1的同源蛋白SAGL1在拟南芥中通过调节CER3的稳定性来负调控表皮蜡质合成,拟南芥突变叶片变现为光叶[38],CER3是一种参与VLC烷烃生产的生物合成酶,VLC烷烃占拟南芥叶和茎角质层总蜡含量的60%—75%[20],低湿度条件下,过表达导致拟南芥茎中VLC烷烃含量降低约15%[38]。E3泛素连接酶在进化上是保守的,在植物生命周期中起着关键调节因子的作用,表明拟南芥中SAGL1-CER3模块调节机制也可能参与调节油菜、番茄等多种植物的表皮蜡生物合成[6]。结合基因定位和表达量测定结果,推测为突变体M8光叶性状控制基因,可能由于叶表VLC烷烃含量变化排布差异导致了光叶表型。
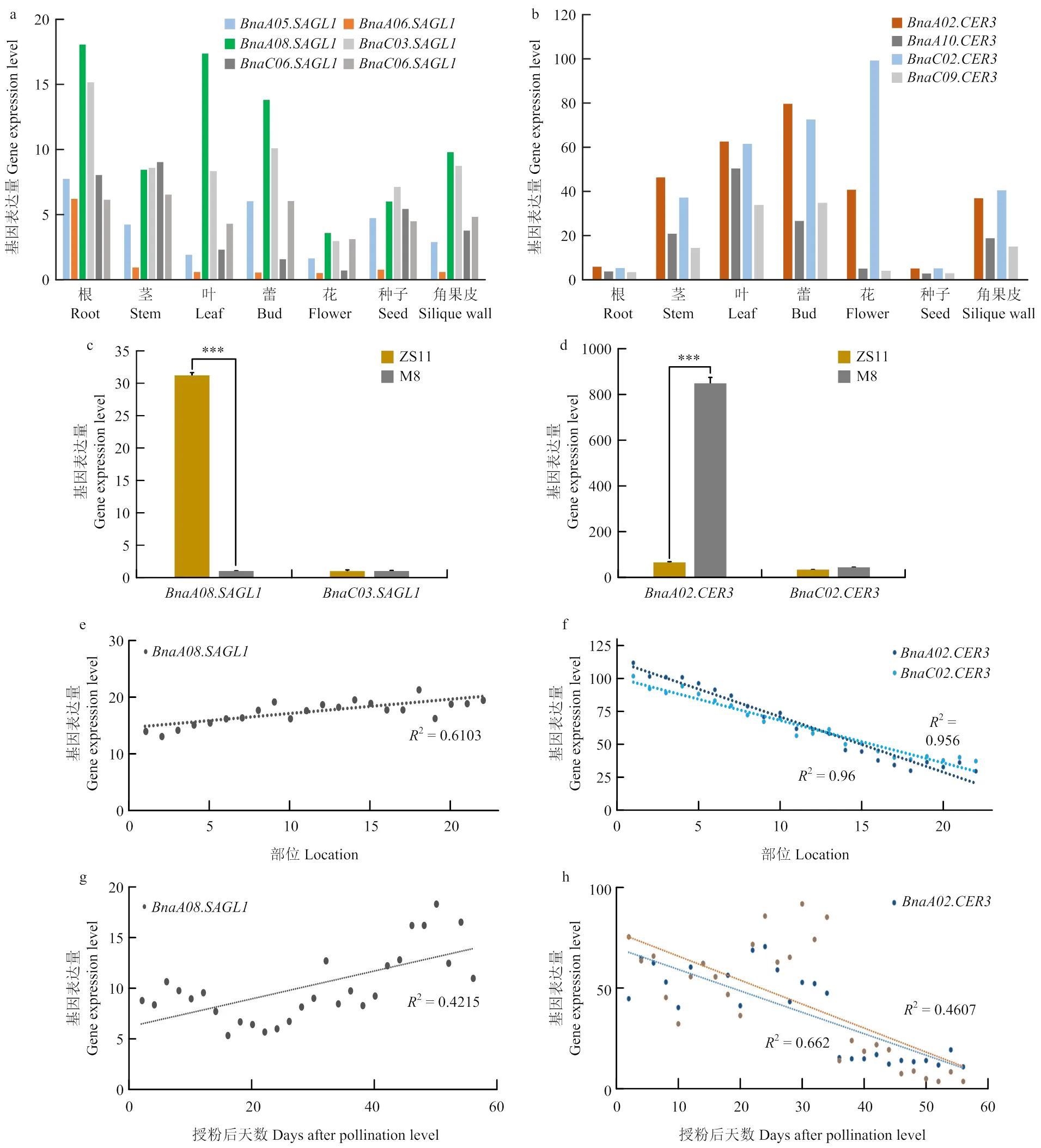
a:基因在油菜不同组织中的平均表达水平;b:基因在油菜不同组织中的平均表达水平;c:基因和在油菜ZS11和M8叶片中的相对表达水平;d:基因和在油菜ZS11和M8叶片中的相对表达水平;e和f:基因(e)和(f)在不同部位叶片中的表达水平,其中,1是油菜最上部的新叶,依次向下,23是茎秆基部的老叶;g和h:基因(h)和(h)在不同生长发育时期角果皮中的表达水平
a: The average expression level of thein different tissues of rapeseed ZS11; b: The average expression level ofin different tissues of rapeseed ZS11; c: The relative expression level of theandand(e) and(f) in leaves at different lacations of ZS11, Among the 1-23, 1 is the new leaf at the top, descending in order, the 23 is the old leaf at the bottom of the stem of the rapeseed; g and h: The expression levels of(g) and(h) in silique wall at different development stages of ZS11
图5 油菜基因和的表达水平分析
Fig. 5 Expression level analysis ofandgenes in rapeseed
本研究通过基因表达数据发现,在油菜品种ZS11叶片和角果皮等器官中,表达随发育进程不断升高,表达呈降低趋势,暗示油菜中可能与拟南芥存在相似的调控机制,即通过调控表皮蜡质合成。同时,发育后期表皮蜡质合成减弱,一方面可能为蜡质层已相对稳定,一方面可能光合效率更高,有待进一步研究。综上,本研究定位了光叶调控基因,解析了甘蓝型油菜光叶性状的形成机制,这对指导叶片表皮蜡质组分改良及辅助选育甘蓝型油菜高光效品种具有重要意义。
4 结论
甘蓝型油菜光叶新突变体M8相比野生型蜡质叶片光合速率更高,该光叶表型受1对隐性基因控制。图位克隆鉴定到光叶性状调控基因为,基因缺失产生了光叶表型。
[1] Jenks M A, Andersen L, Teusink R S, Williams M H. Leaf cuticular waxes of potted rose cultivars as affected by plant development, drought and paclobutrazol treatments. Physiologia Plantarum, 2001, 112(1): 62-70.
[2] Wang H H, Hao J J, Chen X J, Hao Z N, Wang X, Lou Y G, Peng Y L, Guo Z J. Overexpression of riceenhances ultraviolet B tolerance and disease resistance in rice plants. Plant Molecular Biology, 2007, 65(6): 799-815.
[3] Kunst L, Samuels A L. Biosynthesis and secretion of plant cuticular wax. Progress in Lipid Research, 2003, 42(1): 51-80.
[4] Riederer M, Schreiber L. Protecting against water loss: analysis of the barrier properties of plant cuticles. Journal of Experimental Botany, 2001, 52(363): 2023-2032.
[5] Zhu L, Guo J S, Zhu J, Zhou C. Enhanced expression ofimproves drought tolerance with increased accumulation of cuticular wax and ascorbic acid in transgenic. Plant Physiology and Biochemistry, 2014, 75: 24-35.
[6] Lee S B, Suh M C. Advances in the understanding of cuticular waxes inand crop species. Plant Cell Reports, 2015, 34(4): 557-572.
[7] Samuels L, Kunst L, Jetter R. Sealing plant surfaces: Cuticular wax formation by epidermal cells. Annual Review of Plant Biology, 2008, 59: 683-707.
[8] Jenks M A, Tuttle H A, Eigenbrode S D, Feldmann K A. leaf epicuticular waxes of the eceriferum mutants in. Plant Physiology, 1995, 108(1): 369-377.
[9] Rashotte A M, Jenks M A, Feldmann K A. Cuticular waxes on eceriferum mutants of. Phytochemistry, 2001, 57(1): 115-123.
[10] Rowland O, Zheng H Q, Hepworth S R, Lam P, Jetter R, Kunst L.encodes an alcohol-forming fatty acyl-coenzyme A reductase involved in cuticular wax production in. Plant Physiology, 2006, 142(3): 866-877.
[11] Yang X P, Zhao H Y, Kosma D K, Tomasi P, Dyer J M, Li R J, Liu X L, Wang Z Y, Parsons E P, Jenks M A, Lü S Y. The acyl desaturaseis involved in producing wax unsaturated primary alcohols and cutin monomers. Plant Physiology, 2017, 173(2): 1109-1124.
[12] Pollard M, Beisson F, Li Y H, Ohlrogge J B. Building lipid barriers: biosynthesis of cutin and suberin. Trends in Plant Science, 2008, 13(5): 236-246.
[13] Schuster A C, Burghardt M, Alfarhan A, Bueno A, Hedrich R, Leide J, Thomas J, Riederer M. Effectiveness of cuticular transpiration barriers in a desert plant at controlling water loss at high temperatures. Aob Plants, 2016, 8: plw027.
[14] Isaacson T, Kosma D K, Matas A J, Buda G J, He Y H, Yu B W, Pravitasari A, Batteas J D, Stark R E, Jenks M A, Rose J K C. Cutin deficiency in the tomato fruit cuticle consistently affects resistance to microbial infection and biomechanical properties, but not transpirational water loss. The Plant Journal, 2009, 60(2): 363-377.
[15] Koch K, Hartmann K D, Schreiber L, Barthlott W, Neinhuis C. Influences of air humidity during the cultivation of plants on wax chemical composition, morphology and leaf surface wettability. Environment and Experimental Botany, 2006, 56(1): 1-9.
[16] Sun W, Li Y, Zhao Y X, Zhang H. The TsnsLTP4, a nonspecific lipid transfer protein involved in wax deposition and stress tolerance. Plant Molecular Biology Reports, 2015, 33(4): 962-974.
[17] Bonaventure G, Salas J J, Pollard M R, Ohlrogge J B. Disruption of thegene indemonstrates an essential role of saturated fatty acids in plant growth. The Plant Cell, 2003, 15(4): 1020-1033.
[18] Lewandowska M, Keyl A, Feussner I. Wax biosynthesis in response to danger: its regulation upon abiotic and biotic stress. The New Phytologist, 2020, 227(3): 698-713.
[19] Fiebig A, Mayfield J A, Miley N L, Chau S, Fischer R L, Preuss D. Alterations in, a gene identical to CUT1, differentially affect long-chain lipid content on the surface of pollen and stems. The Plant Cell, 2000, 12(10): 2001-2008.
[20] Bernard A, JoubÈs J.cuticular waxes: Advances in synthesis, export and regulation. Progress in Lipid Research, 2013, 52(1): 110-129.
[21] Aharoni A, Dixit S, Jetter R, Thoenes E, Van Arkel G, Pereira A. The SHINE clade of AP2 domain transcription factors activates wax biosynthesis, alters cuticle properties, and confers drought tolerance when overexpressed in. The Plant Cell, 2004, 16(9): 2463-2480.
[22] Broun P, Poindexter P, Osborne E, Jiang C Z, Riechmann J L. WIN1, a transcriptional activator of epidermal wax accumulation in. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(13): 4706-4711.
[23] Bird D, Beisson F, Brigham A, Shin J, Greer S, Jetter R, Kunst L, Wu X W, Yephremov A, Samuels L. Characterization ofABCG11/WBC11, an ATP binding cassette (ABC) transporter that is required for cuticular lipid secretion. The Plant Journal, 2007, 52(3): 485-498.
[24] Liu D M, Tang J, Liu Z Z, Dong X, Zhuang M, Zhang Y Y, Lv H H, Sun P T, Liu Y M, Li Z S, Ye Z B, Fang Z Y, Yang L M.plays an essential role in cuticular wax biosynthesis in cabbage (L. var.). Bmc Plant Biology, 2017, 17(1): 223-232.
[25] Zhang X, Liu Z Y, Wang P, Wang Q S, Yang S, Feng H. Fine mapping of, a gene controlling cuticular wax biosynthesis in Chinese cabbage (L. ssp.). Molecular Breeding, 2013, 32(4): 867-874.
[26] Wang X Y, Zhi P F, Fan Q X, Zhang M, Chang C. Wheat CHD3 protein TaCHR729 regulates the cuticular wax biosynthesis required for stimulating germination off.sp.. Journal of Experimental Botany, 2019, 70(2): 701-713.
[27] 祝利霞. 甘蓝型油菜黄化和光叶突变体的基因定位及克隆[D]. 武汉: 华中农业大学, 2014.
Zhu L X. Mapping and cloning the gene in chlorophyii-deficient and glossy mutants inL.[D]. Wuhan: Huazhong Agricultural University, 2014. (in Chinese)
[28] 刘杰. 甘蓝型油菜光叶基因的克隆和功能分析[D]. 华中农业大学, 2020.
Liu J. Map-based cloning and functional analysis of the glossy gene in[D].Wuhan: Huazhong Agricultural University, 2020. (in Chinese)
[29] Doyle J, Doyle J L, DOYLE J, DOYLE F J. A rapid DNA isolation procedure for small amounts of fresh leaf tissue. Phytochem Bull, 1987, 19: 11-15.
[30] Michelmore R W, Paran I, Kesseli R V. Identification of markers linked to disease-resistance genes by bulked segregant analysis: A rapid method to detect markers in specific genomic regions by using segregating populations. Proceedings of the National Academy of Sciences of the United States of America, 1991, 88(21): 9828-9832.
[31] Bolger A M, Lohse M, Usadel B. Trimmomatic: A flexible trimmer for illumina sequence data. Bioinformatics, 2014, 30(15): 2114-2120.
[32] Vasimuddin M, Misra S, Li H, Aluru S. Efficient architecture-aware acceleration of BWA-MEM for multicore systems. 2019 IEEE International Parallel and Distributed ProcessingSymposium (IPDPS). May 20-24, 2019, Rio de Janeiro, Brazil. IEEE, 2019: 314-324.
[33] Song J M, Guan Z L, Hu J L, Guo C C, Yang Z Q, Wang S, Liu D X, Wang B, Lu S P, Zhou R, Xie W Z, Cheng Y F, Zhang Y T, Liu K D, Yang Q Y, Chen L L, Guo L A. Eight high-quality genomes reveal pan-genome architecture and ecotype differentiation of. Nature Plants, 2020, 6(1): 34-45.
[34] Mckenna A, Hanna M, Banks E, Sivachenko A, Cibulskis K, Kernytsky A, Garimella K, Altshuler D, Gabriel S, Daly M, Depristo M A. The Genome Analysis Toolkit: A MapReduce framework for analyzing next- generation DNA sequencing data. Genome Research, 2010, 20(9): 1297-1303.
[35] Wang K, Li M Y, Hakonarson H. ANNOVAR: functional annotation of genetic variants from high-throughput sequencing data. Nucleic Acids Research, 2010, 38(16): e164.
[36] Mansfeld B N, Grumet R. QTLseqr: An R package for bulk segregant analysis with next-generation sequencing. The Plant Genome, 2018, 11(2): 180006.
[37] Yang Z Q, Wang S B, Wei L L, Huang Y M, Liu D X, Jia Y P, Luo C F, Lin Y C, Liang C Y, Hu Y, Dai C, Guo L, Zhou Y M, Yang Q Y. BnIR: A multi-omics database with various tools forresearch and breeding. Molecular Plant, 2023, 16(4): 775-789.
[38] Kim H, Yu S I, Jung S H, Lee B H, Suh M C. The F-box protein SAGL1 and ECERIFERUM3 regulate cuticular wax biosynthesis in response to changes in humidity in. The Plant Cell, 2019, 31(9): 2223-2240.
[39] 莫鉴国, 李万渠, 彭云强, 余勤. 甘蓝型油菜无蜡粉种质材料的改良以及在杂优育种上的应用. 种子, 1999, 18(5): 18-20.
Mo J G, Li W Q, Peng Y Q, Yu Q. Improvement and application of waxless germplasm material (L.) in heterosis. Seed, 1999, 18(5): 18-20. (in Chinese)
[40] 周熙荣, 李树林, 庄静, 顾龙弟. 甘蓝型油菜(L.)无蜡粉隐性核不育两型系的选育. 上海农业学报, 2002, 18(1): 20-24.
Zhou X R, Li S L, Zhuang J, Gu L D. Selection and breeding of waxless two-type line of recessive genic male sterility inL.. Acta Agriculturae Shanghai, 2002, 18(1): 20-24. (in Chinese)
Genetic analysis and gene mapping of glossy leaf in

1Crop Research Institute of Gansu Academy of Agricultural Sciences, Lanzhou 730070;2National Key Laboratory of Crop Genetic and Improvement, Huazhong Agricultural University, Wuhan 430070;3Wuhan Genoseq Technology Co., Ltd., Wuhan 430070
【Objective】Epicuticular waxes is a hydrophobic layer covering plant leaves and stems, playing an important role in stress resistance and affecting photosynthesis, growth and development. Rapeseed (L.) is one of the main oil crops in the world, but the mechanism of epicuticular waxes formation on its leaves is still unclear. This study aims to reveal the genetic mechanism of epicuticular wax on leaves through a mutant, which will help to achieve high and stable yield of rapeseed.【Method】In this study, leaf of glossy leaf mutant M8 and common waxy leaf inbred lines Zhongshuang 11 (ZS11) and the C20 were characterized, and its photosynthetic rate were measured by portable plant photosynthesis measurement system. Two F1hybrids and F2segregating populations were constructed by crossing the M8 with ZS11 and C20, respectively, and were used to analyze the heredity of leaf characters in rapeseed. The F2population hybridized by M8 and ZS11 was constructed to analyze the genetic regulation of the glossy leaf trait in rapeseed by bulked segregation analysis (BSA) combined with target-sequencing (Target-seq). Combined with comparative genome and transcriptome database, candidate genes were predicted and then verified by RT-PCR.【Result】The leaf stomatal conductance and photosynthetic efficiency were higher in the glossy leaf mutant M8, compared with ZS11 in rapeseed. The genetic analysis results showed that the glossy leaf was controlled by one pair of recessive genes and glossy leaf was recessive compared with waxy leaf. It was finally fine mapped in the physical region of 0.134-0.699 Mb on chromosome A08 by map based cloning method. Further analysis revealed that there was a large segmental deletion in the 0.22-0.58 Mb region of chromosome A08 in the M8 glossy leaf mutant compared to ZS11, and() in this region of the genome was identified as the candidate gene for the glossy leaf trait. This gene encodes a Kelch-F-box protein, and its deletion may lead to the observed glossy leaf trait in the M8 mutant, as it was highly expressed in ZS11 but none in M8. 【Conclusion】Compared with wild-type waxy leaves, the photosynthetic rate of the new glossy leaf mutant M8 was higher, and the glossy leaf phenotype was controlled by a recessive gene. In the picture, the glossy leaf phenotype regulatory gene was identified as, and deletion of the gene resulted in glossy leaf in rapeseed.
L.; glossy leaf; epicuticular wax; map-based gene cloning;

2023-07-14;
2023-08-30
甘肃省科技计划重大项目(21ZD4NA022)、国家自然科学基金(31960436)、甘肃省农业科学院院列项目(2022GAAS54、2021GAAS13、2021GAAS43、2023GAAS43)
关志林,E-mail:zhilinggg@163.com。通信作者董云,E-mail:dongyungs@163.com
(责任编辑 李莉)
