贫血对接受免疫治疗的晚期实体瘤患者预后的影响
2024-03-08秦垠刘莲芳钱伟华高海建张永华
秦垠 刘莲芳 钱伟华 高海建 张永华
不同于与放化疗或靶向治疗的模式, 免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)通过免疫应答达到杀伤肿瘤细胞的目的[1]。恶性实体瘤常伴有贫血, 已有研究表明癌性贫血是影响肿瘤患者预后的危险因素之一[2]。癌性贫血的原因很多, 但仍不清楚,可能与恶性肿瘤本身及化放疗等相关。目前贫血与免疫治疗的相关研究不多。本研究回顾性分析了59 例2019 年1 月~2022 年5 月在本院接受免疫治疗的晚期实体瘤患者, 探讨贫血对接受免疫治疗的晚期实体瘤患者预后的影响。
1 资料与方法
1.1 一般资料 选取2019 年1 月~2022 年5 月本院收治的59 例晚期实体瘤患者, 包括肺癌、胃癌、肝癌、鼻咽癌、恶性黑色素瘤、乳腺癌、舌癌、膀胱癌、食管癌、结肠癌、直肠癌、子宫内膜癌、胆囊癌、胸腺癌。所有患者均接受免疫联合化疗或抗血管治疗, 包括以下任何一种免疫药物Sintilimab 200 mg、Pembrolizumab 200 mg、Toripalimab 240 mg、Tislelizumab 200 mg 或Camrelizumab 200 mg(1 次/3 周)。
1.2 贫血分级 按照世界卫生组织(WHO)标准诊断贫血并进行分级, 根据Hb 水平, 将贫血分为5 级(0 级~Ⅳ级)。0 级:Hb≥110 g/L(正常);Ⅰ级:Hb 95~109 g/L(轻度);Ⅱ级:Hb 80~94 g/L(中度);Ⅲ级:Hb 65~79 g/L(重度);Ⅳ级:Hb<65 g/L(极重度)。
1.3 纳入标准 ①病理学明确诊断为恶性肿瘤;②临床分期明确为晚期恶性肿瘤的患者;③至少接受1 个疗程的免疫治疗;④病例资料完整, 包括性别、年龄、肿瘤病理类型、PS 评分、治疗前Hb 水平、免疫治疗的药物, 可评价病灶的影像学检查等指标。
1.4 排除标准 ①重度及极重度贫血;②近期接受手术或者合并炎症。所有患者均签署免疫治疗同意书。
1.5 治疗效果判定标准 按照实体瘤临床疗效评价标准(response evaluation criteria in solid tumor)评估患者对治疗的反应。
1.6 随访状况 通过门诊或者电话对患者随访, 随访率达到100%, 随访截止时间为2022 年9 月31 日。
1.7 观察指标 记录患者基本资料, 并分析患者PFS的影响因素。
1.8 统计学方法 采用SPSS22.0 统计学软件处理数据。计量资料以均数±标准差(±s)表示, 采用t 检验;计数资料以率(%)表示, 采用χ2检验;单因素、多因素影响因素分析采用COX 风险回归模型;通过Kaplan-Meier 法绘制生存曲线, 采用Log-rank 检验。P<0.05 表示差异有统计学意义。
2 结果
2.1 患者基本资料 免疫治疗前无贫血的患者37 例(62.7%), 轻度贫血的患者10 例(16.9%), 中度贫血的患者12 例(20.3%)。患者平均年龄(62.3±11.4)岁, 其中男37 例, 女22 例;年龄<65 岁的有31 例(52.5%), 年龄≥65 岁的有28 例(47.5%);PS 评分0~1 分的患者39 例(66.1%), ≥2 分的有20 例(33.9%);转移脏器数目≤1 个有46 例(78.0%), 转移脏器数目>1 个有13 例(22.0%);头颈部和胸部肿瘤有13 例(22.0%), 消化系统肿瘤有37 例(62.7%), 其他部位肿瘤有9 例(15.3%);进行一线免疫治疗有26 例(44.1%)、二线免疫治疗有18 例(30.5%)、三线免疫治疗有9 例(15.3%)、四线免疫治疗有6 例(10.2%)。
2.2 接受免疫治疗的晚期实体瘤患者PFS 的单因素和多因素分析 单因素分析显示, PS 评分、贫血情况是接受免疫治疗的晚期实体瘤患者PFS 的影响因素(P<0.05);多因素分析显示, PS 评分≥2 分、中度贫血是接受免疫治疗的晚期实体瘤患者PFS 的独立危险因素(P<0.05)。见表1。
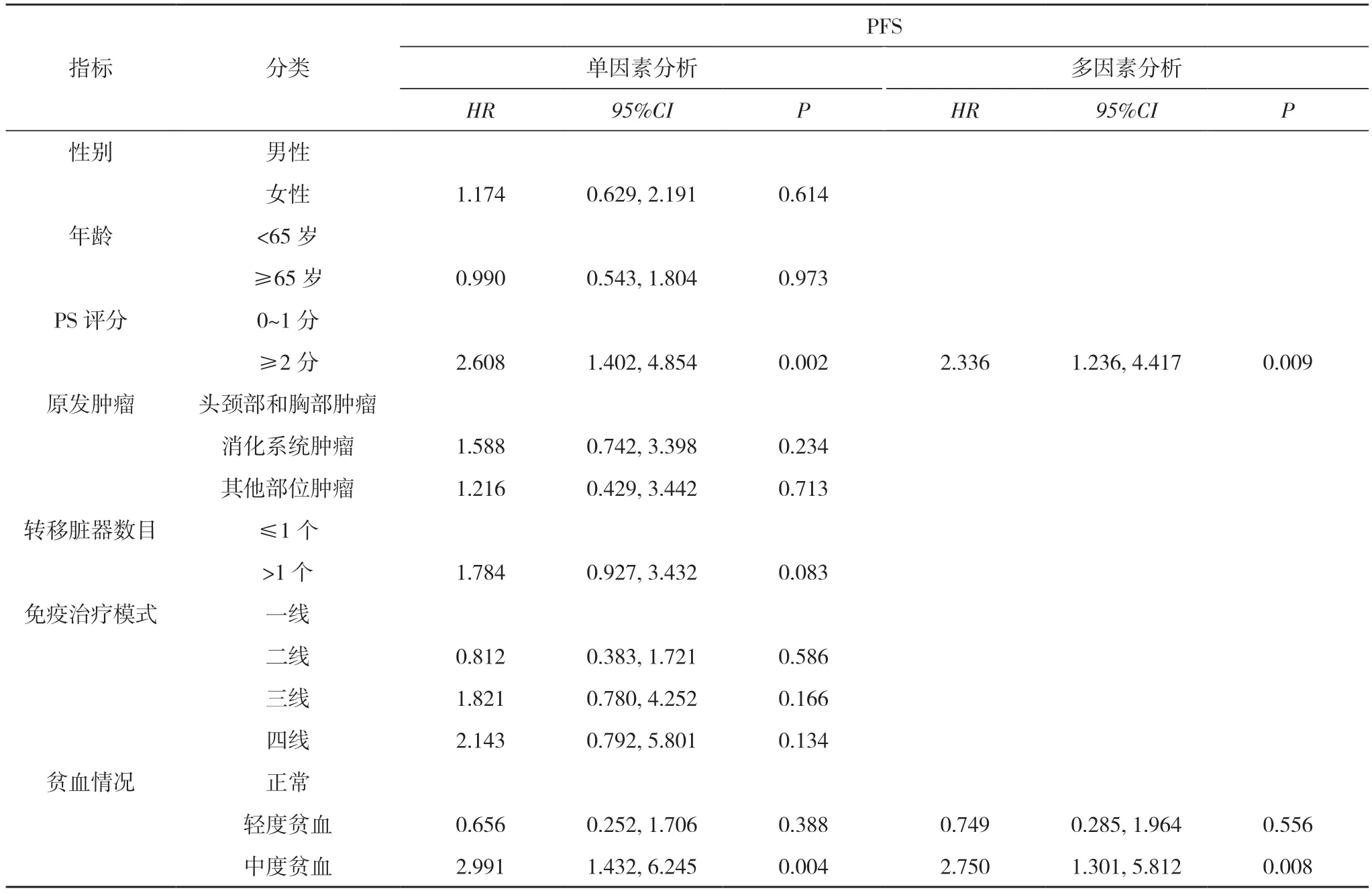
表1 免疫治疗的晚期实体瘤患者PFS 的单因素和多因素分析
2.3 正常、轻度贫血和中度贫血患者PFS 的曲线分析 59 例患者的中位PFS 是6.7 个月, Hb 水平正常、轻度贫血患者的中位PFS 分别为6.9、6.7 个月, 均明显长于中度贫血患者的1.9 个月(P<0.05);轻度贫血患者与Hb 水平正常患者的中位PFS 比较无统计学差异(P>0.05)。见图1。
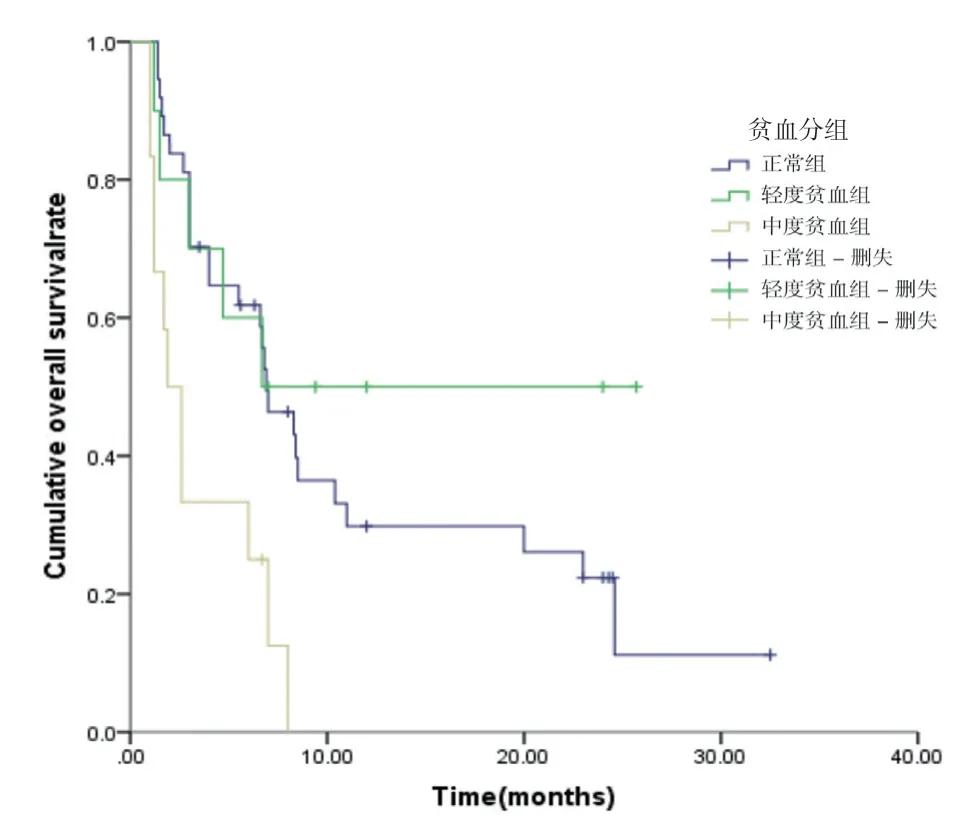
图1 正常、轻度贫血和中度贫血患者PFS 的曲线
3 讨论
免疫治疗已经成为目前肿瘤治疗的热点。已有临床试验证实了抗程序性死亡受体1(PD-1)/程序性死亡受体配体 1(PD-L1)治疗能够在非小细胞肺癌、晚期黑色素瘤、肾细胞癌等多种恶性实体瘤中明显提高治疗效果[3-5]。但是并不是所有肿瘤患者都能获益于免疫治疗, 目前已经探索出包括PD-L1 表达水平、肿瘤突变负荷、肿瘤浸润性淋巴细胞比例及机体自身状态等多种能影响免疫治疗效果的因素。
肿瘤相关性贫血即癌性贫血, 是由肿瘤自身或者治疗相关所导致的贫血, 癌性贫血在恶性肿瘤患者中的发生率达到50%以上[6]。由于贫血可致组织缺氧,因此减少自由基产生、降低细胞内化疗药物浓度, 以致可能影响患者对放化疗的敏感性, 同时组织的乏氧状态会刺激血管内皮生长因子(VEGF)的生成, 从而可能导致肿瘤组织对治疗发生抵抗, 最终影响肿瘤的疗效及预后[7,8]。
裴王伟等[9]随访了20500 例恶性肿瘤患者, 发现肿瘤相关性贫血发生率为23.7%, 妇科肿瘤患者的肿瘤相关性贫血发生率最高, 其次是消化系统和泌尿系统肿瘤, 发生率最低的是头颈部肿瘤。许崇安等[10]研究证明, 化疗前发生的贫血及化疗导致的贫血均可以显著降低非小细胞肺癌患者化疗的疗效。癌性贫血严重影响患者的预后, 无贫血患者的中位生存期(13 个月)明显长于发生癌性贫血者(7 个月)(P<0.001);化疗前贫血患者的中位生存期(7 个月)明显短于化疗前无贫血患者的中位生产期(11 个月)(P<0.001)。吴飞雪[11]回顾性分析了接受化疗的146 例中晚期恶性肿瘤患者,Hb 浓度与化疗效果呈正相关, 化疗前贫血患者的病因大多与肿瘤本身相关, 化疗后贫血可能存在耐药因素,影响治疗效果, 因此在化疗期间对贫血进行早期干预,有助于对减少耐药, 提高疗效。王博等[12]回顾性分析了80 例接受化疗的晚期宫颈癌患者, 发现晚期宫颈癌化疗可提高患者的贫血发生率, 并且影响患者近期化疗效果, 但对患者的2 年生存率无明显影响。赵敏艳等[13]研究发现, 化疗相关性贫血在胃肠道恶性肿瘤中的发生率较高, 其不但会影响胃肠道肿瘤患者的化疗效果, 还会缩短患者的总生存期。
本研究显示, 单因素分析显示, PS 评分、贫血情况是接受免疫治疗的晚期实体瘤患者PFS 的影响因素(P<0.05);多因素分析显示, PS 评分≥2 分、中度贫血是接受免疫治疗的晚期实体瘤患者PFS 的独立危险因素(P<0.05)。因此在临床实践中应重视肿瘤相关性贫血,对于治疗前发生贫血的患者, 临床医师应积极寻找病因并采取措施治疗;对于在治疗过程中发生的贫血, 应采取预防措施或者支持对症治疗。本研究的不足之处在于样本量较少, 随访时间相对较短, 因此需要更大的样本量和更长的随访时间来探索贫血对接受免疫治疗的实体瘤患者预后的影响。由于Hb 检测方便、实惠, 其有可能成为接受免疫治疗的实体瘤患者预后的评价指标。
