特效菌群构建及其处理兰炭废水试验研究
2024-03-07晋银佳刘继明刘彦东郭栋徐展尤良洲衡世权
晋银佳, 刘继明, 刘彦东, 郭栋, 徐展, 尤良洲, 衡世权
(1.华电电力科学研究院有限公司, 杭州 310030; 2.神木职业技术学院, 陕西 榆林 719300;3.河北华电石家庄鹿华热电有限公司, 石家庄 050200)
兰炭是一种重要的生产原料, 在兰炭生产过程中会产生兰炭废水[1]。 兰炭废水含有高浓度的单环及多环芳香族化合物, 主要为二元酚和三元酚[2],具有较高的生物毒性, 使得兰炭废水的生化处理效果极为有限。 近年来, 随着国家环保要求的日益提升, 兰炭废水的达标排放面临严峻的挑战。 高级氧化技术能够对兰炭废水中的有机物分子进行有效分解, 显著降低兰炭废水的COD[2-4]; 电化学氧化技术可有效降低废水COD 和氨氮[5]; 光催化与电化学氧化结合的工艺处理兰炭废水, COD 去除率达到60.63%[6]; 在添加NaCl 的情况下, 电化学处理技术可以将兰炭废水中COD 和氨氮去除率提升至84.31% 和95.77%[7]。 高级氧化技术和电化学处理技术对兰炭废水的COD 和氨氮有较好的去除效果,然而运行成本较高, 并且处理出水难以确保达到排放标准。
采用臭氧氧化提升兰炭废水的可生化性, 通过生物法进一步去除废水的COD, 处理效果显著提升[8]。 然而, 由于兰炭废水中的酚类分子能够破坏微生物菌群的活性和氧化功能, 从而使得其生化处理效果受到限制[9-11]。 因此, 降低兰炭废水的生物毒性、 提高兰炭废水的可生化性对于提升生化处理工艺的处理效果具有重要意义。
医药废水中含有抗生素等对微生物具有抑制作用的物质以及高浓度的COD、 有机氮, 因此, 本研究利用某医药废水处理系统的活性污泥, 通过在兰炭废水中进行适应性驯化后得到特效菌群, 并将其用于兰炭废水的处理, 考察该特效菌群对兰炭废水毒性、 COD、 氨氮的去除效果, 为兰炭废水的解毒预处理提供新的思路和方法。
1 试验部分
1.1 主要仪器及试剂
5B-3A 型COD 分析仪, SHP-160 型生化培养箱, PHSJ-3F 型pH 计, BT600-2J 型蠕动泵,FA1004E 型电子天平, 501A 型恒温水浴器, JPBJ-607A 型溶解氧测定仪。
重铬酸钾, 浓硫酸, 硫酸银, 氢氧化钠, 酒石酸钾钠, 过硫酸钾, 氯化铵, 硫代硫酸钠, 碳酸钠, 氯化钠等, 均为分析纯; 牛肉膏, 蛋白胨, 水溶性淀粉, 葡萄糖, 均为化学纯。
1.2 试验用水
无菌水: 通过将去离子水在高压灭菌锅内进行灭菌处理制备获得。
兰炭废水取自陕西榆林某焦化厂, 水质分析结果如表1 所示。

表1 兰炭废水水质Tab.1 Semi-coke wastewater quality
兰炭废水呈灰黑色, 通常含有高浓度酚类等对细菌活性具有抑制毒性的有机物, 使得兰炭废水的生物处理效果受到限制[12-14]。 通过测试分析特效菌群处理前后兰炭废水毒性的变化, 分析特效菌群对兰炭废水解毒处理效果。 废水毒性测试分为综合生物毒性测试和硝化菌抑制性测试。 综合生物毒性测试采用最小抑菌浓度(MIC)法, 以对人体安全无害的植物乳酸杆菌(lactobacillus plantarum ATCC 14917)为标准被试菌种, 以抑制菌种ATCC 14917生长所需最低废水浓度比例表征被测水样的微生物毒性, MIC 值越高, 表示毒性越低; 硝化菌抑制性测试采用半数最大效应浓度(N-EC50)法, 以市售硝化菌剂为被试菌种, 与空白对照组相比, 将24 h氨氧化抑制率达到50% 的最低水样浓度定义为NEC50 值, N-EC50 值越高, 表示毒性越低。 将兰炭废水的原水进行了MIC 和N-EC50 毒性分析,检测结果如表2 所示。
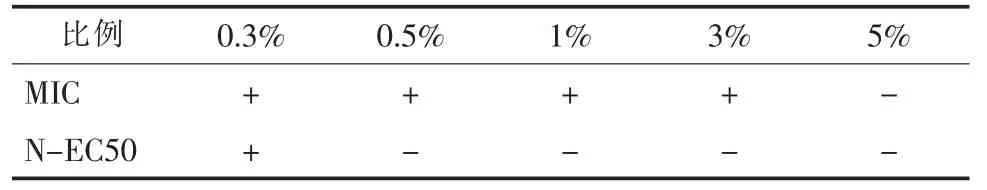
表2 兰炭废水MIC 和N-EC50 毒性分析结果Tab.2 MIC and N-EC50 toxicity analysis of semi-coke wastewater
兰炭废水的毒性测试结果表明, 废水对于微生物具有较强的毒性, 3% 的兰炭废水(相当于稀释33.3 倍)对微生物即显示出明显的抑制作用, 0.3%的兰炭废水(相当于稀释333.3 倍)即可对硝化菌产生明显的抑制作用。 因此, 兰炭废水采用常规的生化处理工艺难以达到预期的效果[15-16], 其原因主要为毒性较强, 对微生物具有显著的抑制作用, 限制了微生物对废水中有机污染物的降解。 通过采用特效菌群对兰炭废水进行预处理, 分解废水中含有的酚类等有机物, 可以降低兰炭废水对细菌的毒性。
1.3 特效菌群驯化、 培养
菌群取自某医药废水生化处理系统的活性污泥。 取10 mL 活性污泥, 加入到盛有200 mL 兰炭废水的锥形瓶中, 用盐酸将兰炭废水pH 值调整至7 左右, 将锥形瓶放在恒温水浴器中, 设定温度为35 ℃; 用空气泵向锥形瓶中鼓入空气, 空气流量设置为300 mL/min; 用滴管向兰炭废水中加入水溶性淀粉和葡萄糖的混合物水溶液, 水溶性淀粉和葡萄糖质量分数均为5%, 添加量为5mL, 每8 h添加1 次。 活性污泥在兰炭废水中适应驯化10 d后, 存活的菌群即为特效菌群。 将含有特效菌群的兰炭废水通过离心机将特效菌群分离出来, 用无菌水将分离出的菌团清洗3 次, 然后加入100 mL 灭菌处理后的生理盐水将菌团混匀, 封口后置于4 ℃冰箱保存备用。
特效菌群可以采用灭菌后的牛肉膏蛋白胨培养。 牛肉膏蛋白胨培养基的配方为牛肉膏3 g、 蛋白胨10 g、 NaCl 5 g、 琼脂20 g、 水1 000 mL、 pH值7.0 ~8.0。 将驯化后的特效菌群用灭菌后的接种环蘸取保存在生理盐水中的菌液, 将菌液接种在培养基上, 并将接种菌液后的培养基置于35 ℃恒温箱中培养30 h。 培养基上长出菌斑后将培养皿取出, 用生料带密封后置于4 ℃冰箱保存备用。
1.4 试验方法
(1) 特效菌群定性分析。 对经筛选、 分离、 驯化所得到的特效菌群进行16S rDNA 鉴定, 选择通用引物对细菌基因进行PCR 扩增, 产物克隆到pMD 18-T 载体中。 经16S rDNA 鉴定, 将序列与NCBI GenBank 数据库中的序列进行BLAST 比对,并将结果上传到NCBI 进行同源性分析, 从而确定特效菌群中的细菌种属。
取特效菌群的菌液进行微生物多样性分析检测。 DNA 提取采用E.Z.N.A.Soil DNA Kit 试剂盒,使用Nanodrop 2000 对DNA 的质量和浓度进行检测, 所有提取的DNA 样本存储在-20 ℃待进一步分析。 16S rDNA 基因的高通量测序使用Illumina MiSeq PE300 测序平台。 细菌基因的PCR 扩增引物采用2 7 F(5′-AGAGTTTGATCMTGGCTCAG-3′)和1492R(5′-CGGYTACCTTGTTACGACTT-3′), PCR扩增反应条件参考文献[17]。
(2) 特效菌群处理兰炭废水静态试验。 在静态试验中, 为了探究特效菌群对不同浓度兰炭废水的处理效果, 分别将兰炭废水稀释5 倍和10 倍进行静态试验。 静态试验的操作方法如下: 取20 mL 兰炭废水加入250 mL 锥形瓶, 向锥形瓶中加入79 mL 无菌水, 再接种1 mL 特效菌群的菌液, pH 值调节为7.0, 此时兰炭废水被稀释了5 倍, 记为体系A; 取10 mL 兰炭废水加入250 mL 锥形瓶, 向锥形瓶中加入89 mL 无菌水, 再接种1 mL 特效菌群的菌液, pH 值调节为7.0, 此时兰炭废水被稀释了10 倍, 记为体系B。 将A、 B 2 个锥形瓶的瓶口用纱布密封后置于恒温摇床中, 温度设置为35 ℃。用空气泵向A、 B 2 个锥形瓶中鼓入空气, 空气流量设置为150 mL/min。 每隔24 h 取废水水样, 分析废水COD、 总氮、 氨氮含量。 静态试验持续18 d。
(3) 特效菌群处理兰炭废水动态试验。 取250 mL 兰炭废水加入1 000 mL 锥形瓶, 向锥形瓶中加入220 mL 无菌水, 再接种10 mL 特种菌群的菌液,调节pH 值为7.0 后用无菌水定容至500 mL(兰炭废水稀释2 倍), 向锥形瓶中投加部分填料, 便于菌群附着生长。 将锥形瓶的瓶口用纱布密封后置于恒温摇床中, 温度设置为35 ℃。 用空气泵向锥形瓶中鼓入空气, 空气流量设置为1 500 mL/min。 将废水进行循环, 蠕动泵流量控制在100 mL/min。每隔24 h 取废水水样, 分析废水COD、 总氮、 氨氮含量, 并在试验结束时测定废水的MIC 和NEC50 毒性。 动态试验持续18 d。
1.5 分析方法
COD 采用重铬酸盐法[18], 总氮采用碱性过硫酸钾消解紫外分光光度法[19], 氨氮采用纳氏试剂分光光度法[20]。
2 结果与讨论
2.1 特效菌群定性分析
通过同源性比对分析, 发现特效菌群中DNA序列与芽孢杆菌属(Bacillus sp.)、 副球菌菌属(Paracoccus sp.)和红球菌菌属(Rhodococcus sp.)相似性较高, 相似度都达到99%。 16S rDNA 鉴定结果与Biolog 生理生化鉴定结果的细菌菌属相一致。
本研究分离的特效菌群中含有的芽孢杆菌属(Bacillus sp.)和红球菌菌属(Rhodococcus sp.), 对苯酚、 喹啉等具有明显的分解效果。 芽孢杆菌和红球菌能利用喹啉、 苯酚作为碳源和氮源, 将喹啉降解为2-羟基喹啉和8-羟基香豆素[21-22], 将苯酚降解为羧酸类分子、 乙醛等。 兰炭废水中含有高浓度的苯酚、 喹啉等有机物[10], 因此, 分离驯化得到的特效菌群对兰炭废水中的有机物分子具有较好的降解去除潜力。
2.2 静态试验结果分析
由于兰炭废水的微生物毒性极强, 直接采用特效菌群处理兰炭废水效果较差, 因此, 为了解特效菌群对兰炭废水COD、 氨氮、 总氮的去除效果,在静态试验中对兰炭废水进行了一定程度的稀释,然后再采用特效菌群进行处理。
静态试验中, 将兰炭废水分别稀释5 倍和10倍(A 体系和B 体系), 试验持续时间为18 d。 通过静态试验考察了特效菌群对兰炭废水的处理效果,主要分析了COD、 氨氮和总氮3 个指标的下降情况, 结果如图1 所示。
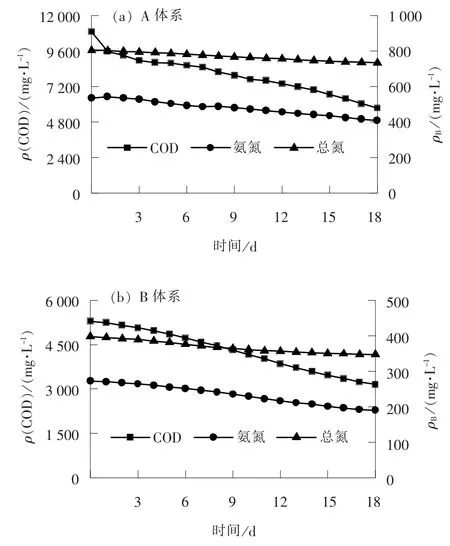
图1 静态试验结果Fig.1 Static experiment results
对于A 体系, 经过18 d 的处理, 兰炭废水COD 的质量浓度明显下降, 从10 896 mg/L 下降到5 726 mg/L, 去除率达到47.43%; 总氮的质量浓度略有下降, 从804 mg/L 降低到733 mg/L, 去除率约为8.83%; 氨氮的质量浓度也略有下降, 从534 mg/L 降低到408 mg/L, 去除率约为23.60%。A 体系静态试验结果表明, 特效菌群对兰炭废水的COD 具有明显的去除效果, 对总氮和氨氮有一定的去除效果, 表明在A 体系工况下, 特效菌群能够存活并具有一定的降解能力。 相较于总氮, 特效菌群对废水中COD 和氨氮的去除速度更快, 而生化反应过程中反硝化速度较慢, 导致总氮去除速度较慢[22]。 因此, 兰炭废水经过特效菌群进行预处理后, 后续的生化处理过程应强化反硝化反应, 提升兰炭废水的总氮去除效果。
对于B 体系, 经过18 d 的处理, 兰炭废水COD 的质量浓度明显下降, 从5 289 mg/L 下降到3 148 mg/L, 去除率达到40.48%; 总氮的质量浓度略有下降, 从398 mg/L 降低到347 mg/L, 去除率约为12.81%; 氨氮的质量浓度也略有下降, 从269 mg/L 降低到190 mg/L, 去除率约为29.37%。B 体系静态试验结果表明, 特效菌群对兰炭废水的COD 具有明显的去除效果, 对总氮和氨氮的去除效果相对于A 体系更好, 特效菌群对兰炭废水中总氮和氨氮的去除效果受废水中污染物浓度的影响较大。 通过稀释虽然能够提高特效菌群对兰炭废水的处理效果, 但是稀释也将导致需要处理的废水量增加, 使得废水处理系统的规模增加, 废水处理系统的占地和投资运行成本显著提升, 因此, 在实际工程应用中需要合理确定废水稀释倍数[23]。
2.3 动态试验结果分析
静态试验结果表明, 特效菌种对兰炭废水有一定的耐受能力, 并能够降低废水的COD、 总氮和氨氮指标。 为模拟实际工程项目运行工况, 优化静态试验处理效果, 探究特效菌群的最优处理能力,采用连续进出水动态试验, 模拟工程运行条件开展兰炭废水处理的动态试验研究, 将兰炭废水稀释2倍, 试验持续18 d, 结果如图2 所示。
兰炭废水COD 的质量浓度从27 240 mg/L 降低到9 827 mg/L, 去除率达到65.20%; 总氮的质量浓度也有明显下降, 从2 010 mg/L 降低到1 452 mg/L, 去除率约为27.76%; 氨氮的质量浓度有显著下降, 从1 335 mg/L 降低到545 mg/L, 去除率约为59.17%。 动态试验结果表明, 在动态工况下特效菌群对兰炭废水有良好的处理效果, 对COD、氨氮均有大幅度的去除; 废水的B/C 值从0.12 提升至0.43, 可生化性显著提升。 在动态试验工况下, 兰炭废水与特效菌群的混合更为均匀, 菌群与污染物分子反应过程的传质速率相较于静态工况更高, 因此具有更好的废水处理效果[24]。 经过特效菌群处理后, 废水中的难降解有机物分子被分解, 可生化性显著提高, 显著降低了后续生化处理系统的运行负荷, 有助于提升兰炭废水的生化处理出水水质[25]。
2.4 兰炭废水生物毒性变化
在动态试验结束后, 对处理后兰炭废水的MIC和N-EC50 毒性进行了检测, 结果如表3 所示。
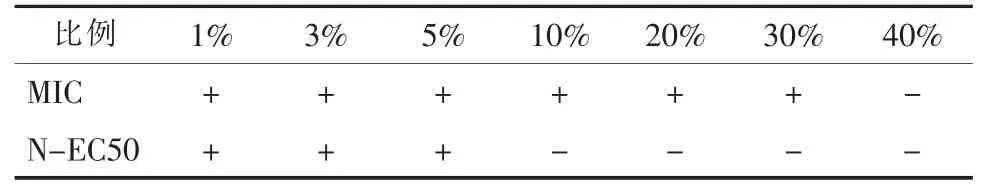
表3 动态试验后兰炭废水MIC 和N-EC50 毒性分析结果Tab.3 MIC and N-EC50 toxicity analysis of semi-coke wastewater after dynamic experiment
经过特效菌群的处理, 兰炭废水的MIC 和NEC50 毒性显著降低。 MIC 值从3% 升高到30%,基本上实现了综合生物毒性的去除, 菌群的生物活性显著提升, 加速了废水中有机物的降解去除;N-EC50 值从0.3% 升高到5%, 废水的硝化菌抑制毒性显著降低, 硝化菌的活性显著提升, 氨氮的去除效果得到提高。 动态试验结果表明, 利用特效菌群对兰炭废水进行预处理, 兰炭废水的综合生物毒性和硝化菌抑制毒性均显著降低, 该特效菌群对兰炭废水COD 和氨氮均表现出良好的去除效果, 显著改善了兰炭废水的可生化性, 为后续的兰炭废水生化处理奠定了较好的基础。 将特效菌群加入兰炭废水生化处理系统能够增加反应体系的微生物群落多样性, 提高对有毒难降解污染物的去除能力[26-27]。
3 结论
(1) 医药废水生化处理系统中分离出的菌群经过适应性驯化后, 对兰炭废水COD、 氨氮、 总氮均具有较好的处理效果。
(2) 特效菌群对兰炭废水有较好的解毒效果,动态试验中, 处理后兰炭废水的MIC 值从3%升高到30%, N-EC50 值从0.3% 升高到5%, B/C 值从0.12 提升至0.43, 经过特效菌群处理后能够显著降低兰炭废水的生物毒性, 并提升兰炭废水的可生化性。
(3) 特效菌群对兰炭废水中的COD 和氨氮有较好的去除效果, 将兰炭废水稀释2 倍, 开展动态试验研究, 结果表明经过处理后的COD 和氨氮的去除率分别达到65.20% 和59.17%, 显著降低后续生化处理的负荷。
