Niemann-Pick C1蛋白在埃博拉病毒感染中的作用及其靶向药物研究进展
2024-03-07吴海燕陈国江
吴海燕,陈国江
(军事科学院军事医学研究院毒物药物研究所,北京 100850)
埃博拉病毒(Ebola virus,EBOV)属于丝状病毒科,丝状病毒科主要分为EBOV 属、马尔堡病毒(Marburg virus,MARV)属和奎瓦病毒属。EBOV属包括EBOV、本迪布焦病毒、莱斯顿病毒、苏丹病毒和塔伊森林病毒[1]。自1976年在非洲大陆被发现以来,EBOV 已在非洲引起多次致命出血性疾病的暴发,给世界公共卫生带来巨大挑战[2]。EBOV的主要感染途径有直接接触感染、医源性接触感染、性传播和母婴传播,感染EBOV 可引起发热、头痛和肌痛等症状,最后发展为肝、肾功能衰竭,导致死亡[3]。埃博拉病毒病(Ebola virus disease,EVD)的暴发主要在非洲国家,在2013年至2016年西非暴发的疫情中,报告病例约28 000 例,死亡高达约11 000 例[4]。尽管目前已有多个治疗EVD 的候选药物,但考虑到病毒的高频突变性,开发靶向丝状病毒的广谱治疗药物仍有迫切的现实需求。
1 Niemann-Pick C1在EBOV感染中的作用
EBOV 是一类单链负义RNA 病毒,其基因组编码7 种蛋白,分别为核蛋白、聚合酶辅因子、基质蛋白、糖蛋白(glycoprotein,GP)、转录激活因子、次要基质蛋白和RNA 依赖的RNA 聚合酶[5]。EBOV 利用多种宿主因子进入细胞,包括去唾液酸糖蛋白受体、C 型凝集素、T 细胞免疫球蛋白黏蛋白结构域1和β1 整合素等[6-7]。EBOV 表面蛋白GP 为单一的包膜糖蛋白,介导病毒附着、进入与膜融合。GP 分子以同源三聚体形式存在于病毒粒子表面,每个单体由二硫键连接的GP1 和GP2 亚单位异源二聚体组成。GP 介导EBOV 进入靶细胞,与宿主细胞膜相互作用触发病毒颗粒内吞。GP1 包含受体结合位点(receptor binding site,RBS)、聚糖帽和黏蛋白样结构域,而GP2 包含融合环和跨膜结构域[8]。在病毒与细胞表面黏附因子(如C 型凝集素)结合后,EBOV 通过胞吞作用进入细胞[9-11]。在晚期内体中,GP 被宿主组织蛋白酶(如组织蛋白酶L 和B)切割为酶裂解GP(cleaved GP,GPcl),去除聚糖帽和黏蛋白样结构域,进而暴露RBS[12]。RBS 与内体膜上的胆固醇转运蛋白Niemann-Pick C 1(NPC1)结合,促进GP2 介导的病毒膜与内体膜融合。随后,病毒RNA 释放到胞质中,完成复制等步骤[13-15]。
近期研究发现,NPC1 是丝状病毒感染靶细胞的关键受体。NPC1蛋白是溶酶体和内体膜上的胆固醇转运体,人NPC1 蛋白包含1278 个氨基酸残基,包括1 个N 端结构域(N-terminal lumenal domain,NTD)、1 个中间结构域(middle luminal domain,MLD)、1个C端结构域(C-terminal lumenal domain,CTD)和13 个跨膜段(transmembrane segments,TM),TM3~7 片段被称为甾醇传感结构域(sterol-sensing domain,SSD)[16](图1)。MLD主要由中心的7个α螺旋作为核心和围绕核心的7个β 链组成,并有2 个突出的环。第一突出环(loop1)位于β2 和β3 链之间,而第二突出环(loop2)位于α4 和α5 螺旋线之间。MLD 利用2 个突出环结合GPcl 头部的疏水空腔,GPcl 是EBOV 进入内体被组织蛋白酶切割后的GP,能暴露出RBS。EBOV GPcl和NPC1-MLD 之间的分子相互作用由NPC1-MLD的2个突出环介导,它们与GPcl头部RBS中的疏水口袋结合。在第一突出环中,7 个残基Y420,Q421,Y423,P424,S425,G426 和D428 参与相互作用,其中残基Y423 和P424 参与大部分原子间的接触。在第二突出环中,6 个残基D501,D502,F503,F504,V505 和Y506 参与结合过程,残基F503,F504 和Y506 通过与GPcl 头部空腔的紧密疏水相互作用发挥主要作用(图2)。在酶切并与MLD 结合后,GPcl 的构象变化进一步影响内部融合环的状态,触发膜融合。疏水相互作用主要有助于在MLD 和EBOV-GPcl 之间的接触表面水平上,稳定蛋白质-蛋白质复合物[17-18]。
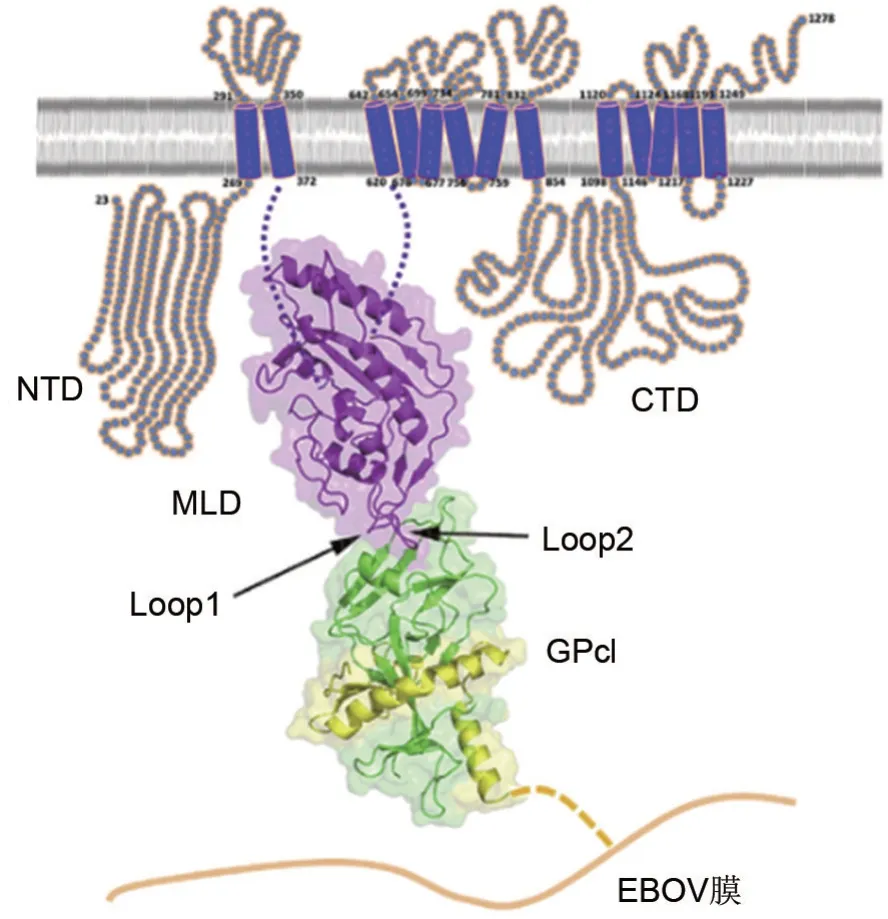
图1 埃博拉病毒(EBOV)入侵宿主细胞的过程[17].NTD:Niemann-Pick C1(NPC1)蛋白N端结构域;MLD:NPC1蛋白中间结构域;CTD:NPC1 蛋白C 端结构域;Loop1:第一突出环;GPcl:酶裂解糖蛋白.
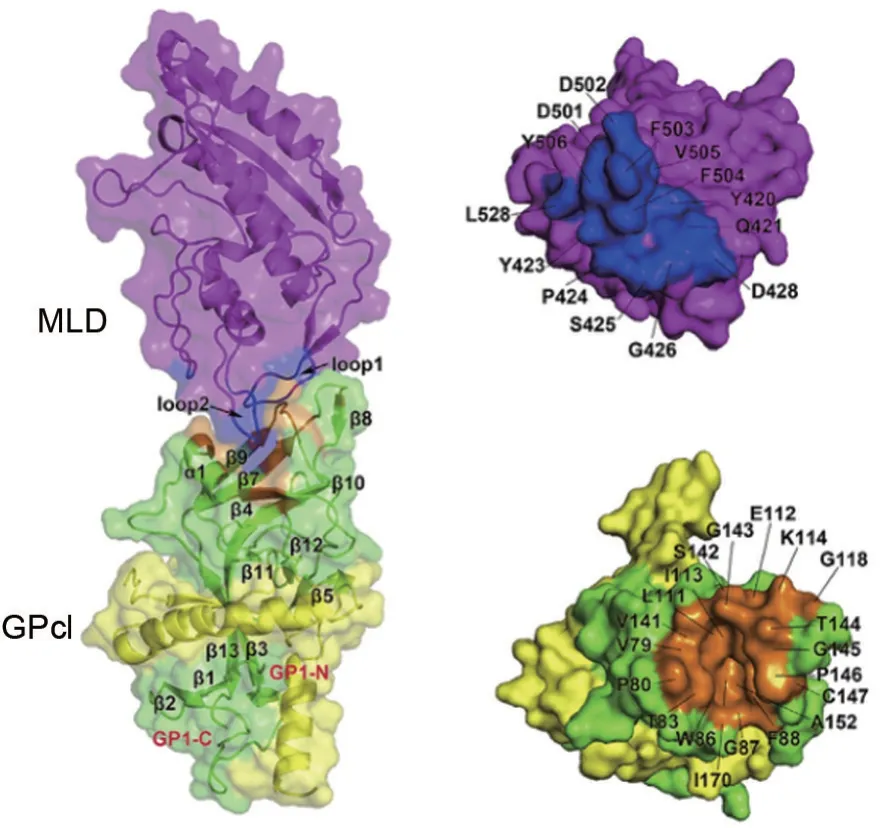
图2 NPC1-MLD与GPcl复合结构[17].
NPC1基因的缺失会使细胞内胆固醇堆积,导致一种严重的神经退行性疾病,称为尼曼-匹克C型疾病(Niemann-Pick disease type C)[19-20]。NPC1与NPC2 共同介导胆固醇的转运。NPC2 结合到NPC1 的MLD 后将胆固醇转移到NTD,MLD 与NPC2 的主要作用残基为R404 和R518(图3)。R518 暴露在MLD 顶部的短螺旋α3 末端,R404 埋在MLD 中,与TM3 N 端茎部分的E606 相互作用[16]。CTD 的所有8 个半胱氨酸形成4 个二硫键,其中C909~C914 形成1 个特定环,该环反过来介导与NTD 的相互作用[21-22]。之后NTD 从NPC2 接收到胆固醇,并将胆固醇转移到膜上的SSD 区域[23]。值得注意的是,NPC1 在EBOV 入胞中的作用与其在胆固醇外排中的功能相互独立,为病毒进入的治疗性抑制剂的设计提供了分子基础[15,24]。NPC1蛋白作为目前已知的丝状病毒的共同进入受体,靶向NPC1的药物可能具有广谱抗丝状病毒作用。
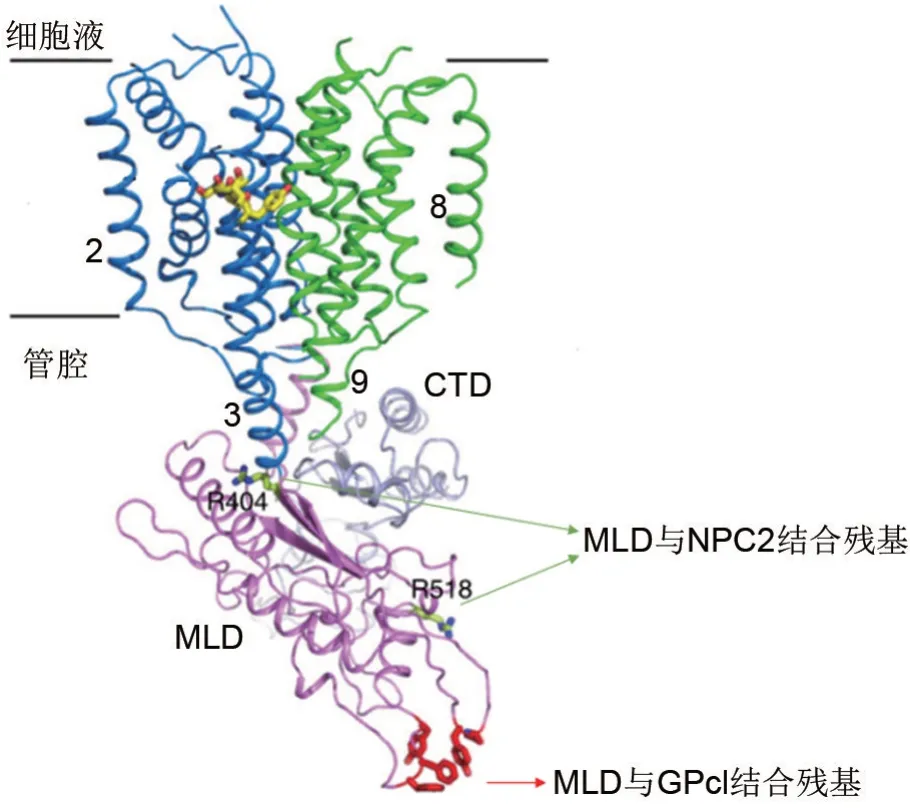
图3 NPC1与NPC2结合的关键位点[16].
2 靶向NPC1的药物
目前抗病毒治疗大多针对病毒本身,由于病毒具有高频突变的特性,一段时间后这些治疗方法往往失效或耐药。针对病毒识别的关键宿主分子开发药物具有广谱性、不易诱发变异等优点,且在阻断病毒与宿主相互作用的同时,还能调节宿主的免疫反应,增强抗病毒功效[25]。目前,NPC1已成为抗EVD 药物研发领域颇具吸引力的靶点。NPC1 已被证实在其他病毒感染中也起重要作用。NPC1能与严重急性呼吸综合征冠状病毒2 核蛋白相互作用,增强其感染性,抑制NPC1够显著减轻其引起的病变[26-27]。此外,研究还发现,NPC1也涉及如丙肝病毒[28]、人类免疫缺陷病毒[29]、基孔肯雅病毒[30]、登革热病毒[31]、寨卡病毒[32]和杆状病毒[33]等感染。由于NPC1 为多种包膜病毒的共同受体,靶向NPC1的抑制剂可能成为广谱抗病毒候选药物。针对NPC1 的药物主要包括小分子抑制剂、单克隆抗体以及基因治疗药物,在非临床研究中展示了较好活性。
2.1 小分子抑制剂
2.1.1 直接作用于NPC1
一类化合物,如金刚烷二肽哌嗪、磺胺、三唑硫醚、咔唑和硫化物等,可结合到NPC1 上与GPcl 结合的位点,竞争性阻断GP与膜的结合(表1)。
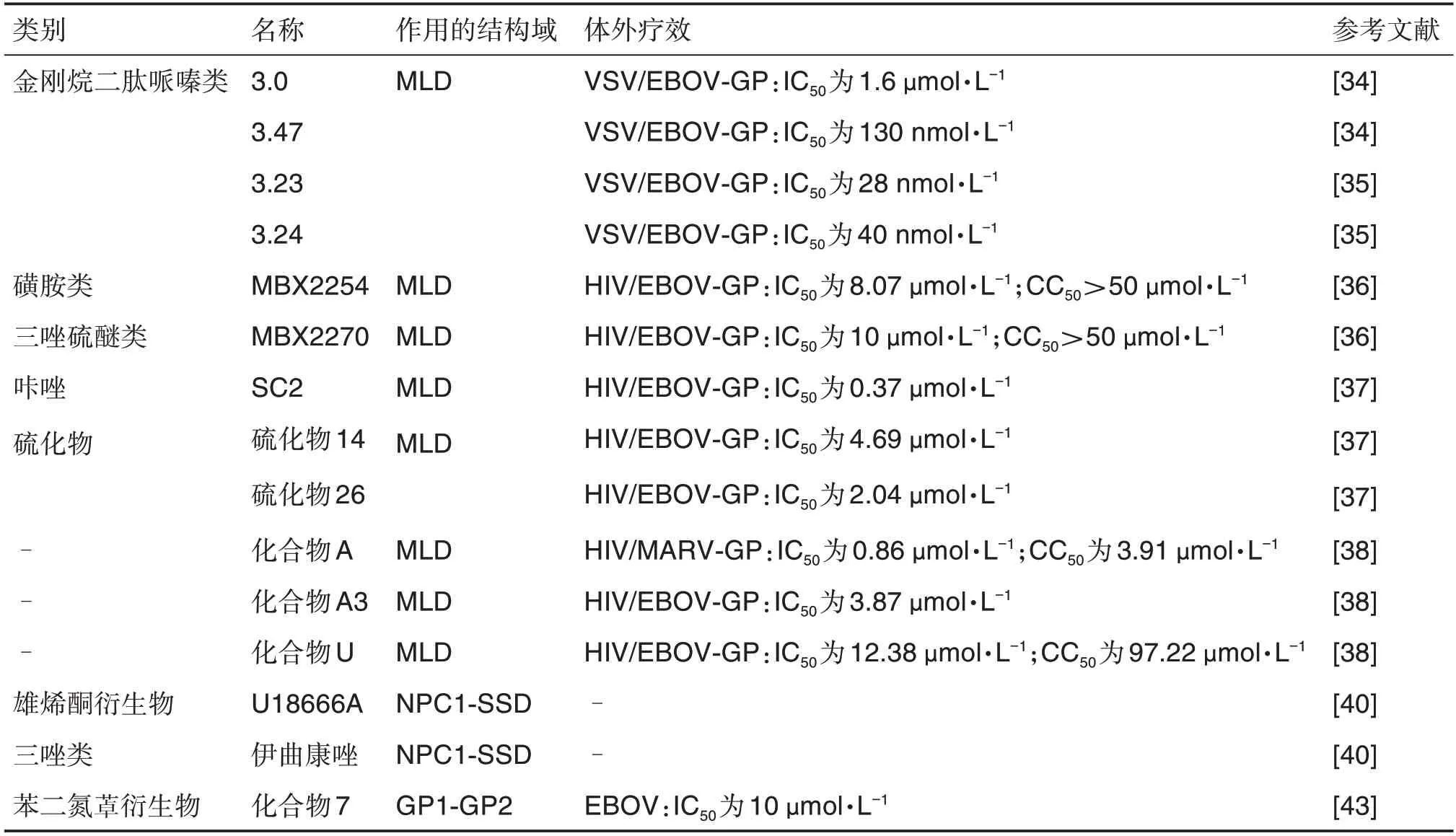
表1 抗EBOV NPC1-C-GPcl相互作用的化合物
金刚烷二肽哌嗪系列包括化合物3.0 和化合物3.47,能识别NPC1 在丝状病毒进入过程中的关键作用,干扰NPC1-GP 相互作用[34]。化合物3.0 半数抑制浓度(half inhibitory concentration,IC50)为1.6 μmol·L-1,而化合物3.47的IC50低至130 nmol·L-1。通过改进化合物3.47 体外药动学特性获得的衍生物3.23和3.24,比3.47更有效,疏水性更低,且对导致人类感染大暴发的Mayinga EBOV(1976年)和Makona EBOV(2014年)具有很强抑制活性,其对Makona EBOV的半数效应浓度(half maximal inhitory concentration,EC50)分别为52 和17 nmol·L-1,对Mayinga EBOV 的EC50值分别为33 和35 nmol·L-1[35],但小鼠体内实验显示,这类化合物并未提高小鼠生存率。
Basu 等[36]发现了2 种分别基于磺胺和三唑硫醚骨架的小分子氨基乙酰胺磺酰胺MBX2254和三唑硫醚MBX2270,两者能在病毒入胞后的晚期内体中抑制EBOV-GP 与NPC1-MLD 相互作用,在体外对EBOV 的IC50分别为8.07 和10.00 μmol·L-1,半数细胞毒性浓度(half cytotoxic concentration,CC50)均>50 μmol·L-1,且两者与NPC1-MLD 的结合诱导构象变化,阻断NPC1 的胆固醇转运。另外,Lasala 等[37]运用虚拟筛选方法获得具有病毒抑制活性的7 种化合物,分别属于苯并噻唑(9,12,19和30)、咔唑(SC2)和硫化物(14 和26)衍生物。在EBOV假病毒感染实验中,二芳基硫化物(14和26)的IC50分别为4.69 和2.04 μmol·L-1,SC2 的IC50为0.37 μmol·L-1,均显示出较好的抗病毒活性。ELISA结果显示,这些化合物抑制EBOV-GPcl 和NPC1-MLD 之间的相互作用,而苯并噻唑类药物不影响NPC1-GP的相互作用。
Wang 等[38]采用计算机方法在化合物库中针对NPC1 与GP 相互作用的RBS 区域筛选出化合物A 和U,及其类似物A3 和A4 及U6 和U7,它们对EBOV 和MARV 感染均表现出较强抑制活性。在体外假病毒实验中,化合物A 对MARV 的IC50值最低(0.86 μmol·L-1),化合物A3 对EBOV 的IC50值最低(3.87 μmol·L-1)。对于EBOV 和MARV,化合物U 的IC50值分别为12.38 和21.72 μmol·L-1。在细胞毒性实验中,化合物A 显示出更大毒性,CC50值为3.91 μmol·L-1,而化合物U 表现出较低细胞毒性,其CC50值接近100 μmol·L-1。在EBOV 真毒实验中,化合物A 和U 均显示较强抑制活性,IC50值分别为11.92和8.77 μmol·L-1。
另一类化合物与NPC1 上的其他位点结合,使其无法在晚期内体正常表达,影响GPcl与NPC1的结合。以雄烯酮衍生物U18666A(表1)为例,它是一种两亲性类固醇,能抑制溶酶体膜蛋白NPC1 转运胆固醇,导致胆固醇在溶酶体中累积[39]。尽管U18666A 和丙咪嗪(imipramine)治疗均可使感染EBOV 小鼠的病毒复制降低,但未显示出明显保护作用[24]。先前的研究结果也表明,U18666A和三唑类药物伊曲康唑(itraconazole)(表1)均可阻断NPC1 介导的胆固醇转运,对EBOV 感染具有抑制作用。U18666A与伊曲康唑对NPC1的抑制作用位点主要在NPC1-SSD[40],NPC1-SSD的P691S突变可以阻止NPC1蛋白与这些配体的结合[41-42]。
2.1.2 作用于GP间接影响NPC1
除上述化合物外,进入抑制剂(entry inhibitor)还可通过作用于EBOV-GP 的GP1-GP2 界面的融合环水平变构干扰NPC1-MLD-GPcl相互作用。通过使用GP 假病毒,Basu 等[43]在进入抑制剂筛选中发现了苯二氮衍生物化合物7(表1)。与其他RNA和DNA病毒相比,化合物7 在细胞实验中表现出对EBOV 和MARV 的抑制具有选择性,IC50值分别为10和12 μmol·L-1。研究表明,化合物7 可与GP1 和GP2 之间界面上的疏水口袋结合,这种与EBOV-GP 的结合会对GP 蛋白在GP1-GP2 二聚表面的稳定性产生负面影响。配体诱导的失稳将随着EBOV-GP 结构扩散到容纳NPC1-MLD 的空腔,最终损害结合位点的蛋白质相互作用。
2.2 单克隆抗体药物
目前对丝状病毒抗体药物的研究主要针对病毒表面GP,在众多靶向EBOV GP 的单克隆抗体中,较为有效的有3 种,分别是Zmapp,REGN-EB3和mAb114。Zmapp 和REGN-EB3 是治疗性混合物,各自含有3 个针对不同表位的单抗,mAb114 是针对EBOV GP 受体结合域的单一治疗性单抗;mAb114 与EBOV GP 受体结合域上的一个保守氨基酸区域结合,即使在低pH(如内体中的pH)下仍保持结合,提示mAb114 可阻断GP 在晚期内体中与宿主细胞受体蛋白NPC1的相互作用[44-45]。无法避免的是,当GP 表位发生突变时,这些靶向EBOV GP 表位抗体的中和效果将大幅下降。但由于这些单抗对严重EVD 的治疗仅具有中等效力,对其他种类EBOV 无效,因此开展针对所有丝状病毒科的广谱抗体药物研究具有重要意义。
有研究表明,双特异性抗体(bispecific antibody,BsAb)治疗可成为一种很有前景的抗体联合治疗方法。Wec 等[46]开发了一种“特洛伊木马”(Trojan horse)BsAb,他们分别将以RBS和NPC1-MLD 为靶向位点的单抗MR72 和mAb-548 偶联靶向GP 表位的单抗FVM09。这类BsAb 能通过FVM09以“搭便车”方式进入感染病毒细胞,并通过MR72 或mAb-548 成功抑制GPcl-NPC1 相互作用。体内实验也表明,BsAb 对感染了EBOV 或苏丹病毒的BALB/c 小鼠具有保护作用,与未治疗组相比,FVM09-MR72 组小鼠存活率更高(70%),FVM09-548 具有部分保护作用。该方法对EBOV属病毒提供了广泛保护,即使在暴露后治疗条件下,也可对抗致命的EBOV 攻击,但该BsAb 不能中和其他丝状病毒。在此基础上,该团队开发了第二代“特洛伊木马”BsAb,通过与内化细胞表面受体-离子非依赖性甘露糖-6-磷酸受体/胰岛素样生长因子2受体的结合,将抗体内化到细胞中,增强对丝状病毒进入细胞的阻断作用[47]。该研究扩展了“特洛伊木马”BsAb 传递机制,具有更加广谱的抗病毒功能。
2.3 基因治疗药物
Sadewasser 等[48]采取一种基于反义寡核苷酸(antisense oligonucleotides,ASO)作用于NPC1的新方法,对感染了EBOV 的细胞具有体外抑制效果。ASO 是指短的(16~53 个核苷酸)、合成的低聚核苷酸,用于阻断RNA(包括微RNA)的功能。研究人员选择NPC1作为锁定核酸修饰的反义寡核苷酸抑制的治疗靶点。在人和小鼠细胞系中筛选ASO,鉴定出的候选寡核苷酸能够在体外有效敲除NPC1蛋白,敲除效率高达94%,并且不改变细胞活力,其中最有效的ASO 05HM 抑制NPC1 表达的IC50值为668 nmol·L-1。用选出的候选寡核苷酸处理感染EBOV 的HeLa 细胞,病毒滴度显著降低(>99%),表明针对NPC1 的ASO 是一种有希望的治疗方法。另外,Kondoh 等[49]利用国家生物技术信息中心单核苷酸多态性(single-nucleotide polymorphism,SNP)数据库在人NPC1 中发现了10 个天然存在的错义SNP,建立了稳定表达NPC1 的具有SNP 替换的Vero E6 细胞系,发现核苷酸的替换导致细胞对丝状病毒易感性降低。利用NPC1 SNP 虽可使病毒易感性降低,但很有可能会影响NPC1本身的生理功能而产生其他不良反应。
3 结语
全面了解病毒的感染过程如病毒的结构、病毒与宿主的相互作用机制等有利于研发新的抗病毒疗法。基于病毒表位研发的小分子抑制剂及单克隆抗体等能有效抑制EVD 发生。目前,单克隆抗体是EBOV 感染的主要治疗药物,靶向位点主要是病毒表面GP。这些抗体虽表现了良好的中和活性,但仍存在一些问题。①EBOV 为RNA 病毒,易产生突变和逃逸,单克隆抗体容易失效;②靶向病毒表位的抗体不够广谱。宿主靶向抗病毒治疗能克服这些缺点,但不可避免地导致药物的一些不良反应。对于EBOV 来说,NPC1 是体内胆固醇的转运体,抑制NPC1 的药物虽可降低EVD 发生,但也会影响细胞内胆固醇转运。如何有效控制EBOV 感染且不影响体内正常NPC1功能是目前该研究领域面临的一大挑战。不断发掘新宿主受体并开发新靶向药物必将为EVD 治疗提供更多选择,并取得更好治疗效果。
