氰化钠加重缺氧诱导的小鼠脑神经损伤及机制
2024-03-07李鹏飞石华香周梦玮郭家彬王永安王丽韫
李鹏飞,石华香,周梦玮,郭家彬,王永安,王丽韫
(1.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,北京 100850;2.中国人民解放军疾病预防控制中心,北京 100071)
缺氧是造成神经系统功能障碍的重要诱因,包括外缺氧和内缺氧,前者指机体外环境缺氧,后者指机体内组织缺氧[1-2]。内、外缺氧往往同时存在,如火灾发生时因氧供不足和氧利用障碍发生内、外复合缺氧[3]。机体内、外缺氧均可导致脑损伤,特别是外缺氧复合内缺氧可能使脑损伤进一步加剧,但其具体损伤特征和机制尚未阐明[4-5]。
氰化物是指含有氰根的物质,包括无机氰化物〔如氰化钠(sodium cyanide,NaCN)和氰化钾等)〕和有机氰化物(如丙烯晴和氰化物等),在炼金、农业和制药领域均有广泛应用。NaCN 具有结构简单、储存方便、毒性剧烈、中毒途径多且中毒后难防难治等特点[6-8]。急性NaCN中毒发作迅速,首先出现头晕和头痛症状,继而可出现昏迷,甚至死亡。中枢神经系统是NaCN 重要靶器官,慢性NaCN 暴露可导致多种神经系统功能异常,严重的会形成迟发性肌张力障碍或帕金森病[9-10]。氰根能结合线粒体内细胞色素氧化酶的三价铁形成氰化高铁细胞色素氧化酶,从而阻断呼吸链电子传递,导致体内细胞无法获得足够的氧气,使细胞主要产能方式由有氧呼吸转换为无氧呼吸,产生大量乳酸堆积,造成代谢性酸中毒,导致细胞凋亡或坏死[11-12]。
开展缺氧环境NaCN 中毒相关研究对于保障应急条件下出现密闭环境复合NaCN 中毒后的救治具有重要意义。本研究通过构建急性NaCN 暴露复合缺氧小鼠模型,采用激光散斑成像技术[13-14]和免疫组化等方法,探讨在缺氧环境中发生NaCN急性染毒对海马神经元的损伤作用及病理机制,为NaCN 中毒复合缺氧的临床治疗提供新的思路和实验依据。
1 材料与方法
1.1 实验动物
雄性昆明种小鼠,SPF 级,体重18~20 g,购于斯贝福(北京)生物技术有限公司,许可证号SCXK(京)2019-0010。饲养环境为温度18~24 ℃,湿度50%~60%,12/12 h 昼夜交替,小鼠自由进食、饮水,适应3 d 后用于实验。所有的动物实验均经军事医学研究院动物实验伦理委员会批准(批准号:IACUCDWZX-2020-517)。
1.2 药品、试剂和主要仪器
NaCN(纯度>98%),军事医学研究院毒物药物研究所合成,溶于生理盐水;水合氯醛、固体甲醛、蔗糖和30%过氧化氢,国药集团化学试剂有限公司;PBS,无锡傲锐东源生物科技有限公司;丙二醛(malondialdehyde,MDA)测定试剂盒(A003-1-1)、总超氧化物歧化酶(total superoxide dismutase,T-SOD)测定试剂盒(A001-1-2)和考马斯亮蓝总蛋白测定试剂盒(A045-2),南京建成生物工程研究所;DAPI 荧光封片液(F5067),美国Sigma 公司;TUNEL 细胞凋亡检测试剂盒(C1090)、辣根过氧化物酶标记山羊抗兔IgG(H+L)抗体(A0208)和HE染色试剂盒(C0105M),碧云天生物技术有限公司。
SIM BFI HR Pro 激光散斑血流成像系统,武汉迅微科技有限公司;UV-4802 紫外分光光度计,上海尤尼科仪器有限公司;CM1950 冰冻切片机,德国Leica 公司;LSM 880 激光共聚焦显微镜,德国Carl Zeiss 公司;AC-ROS 电子天平,德国Sartorius公司;ABL90FLEX 血气分析仪,雷度米特医疗设备(上海)有限公司。
1.3 小鼠缺氧存活时间检测
将小鼠随机分为缺氧+NaCN〔0(缺氧对照),2.56,3.8 和5.1 mg·kg-1〕组,每组20 只。各组小鼠ip 给予不同剂量NaCN 后立即置于密闭的玻璃罐(容积为1.5 L,环境温度为25 ℃,气体压强为101 kPa)中,每罐2 只,观察并记录小鼠呼吸运动、皮毛状态和活动情况,以最后一次呼吸为标记,记录死亡时间。
1.4 血气分析仪测定小鼠动脉血气值
将小鼠随机分为正常对照组、NaCN 暴露组(ip给予NaCN 3.8 mg·kg-1)、缺氧(30 和60 min)组(置缺氧罐内30 或60 min 后取出)和NaCN+缺氧组〔ip 给予NaCN 3.8 mg·kg-1后立即置缺氧罐内,缺氧处理30 min(NaCN+缺氧30 min组)或60 min(NaCN+缺氧60 min 组)后取出〕,每组5 只。小鼠按分组处理后ip 给予5%水合氯醛麻醉,经腹主动脉取动脉血约0.2 mL,抗凝处理后于20 min内使用全自动血气分析仪进行检测,并记录动脉血pH 值、氧饱和度(oxygen saturation,sO2)、氧分压(oxygen tension,pO2)和二氧化碳分压(carbon dioxide partial pressure,pCO2)。
1.5 激光散斑血流成像系统测定小鼠脑血流
小鼠ip 给予5%水合氯醛麻醉后固定于小鼠脑立体定位仪操作台上,剪去颅顶部皮毛暴露颅骨,滴加3%双氧水去除骨膜和残余组织,充分暴露出Bregma点及颅骨表面,滴加生理盐水保持颅顶湿润。连接激光散斑血流成像系统脑血流仪,调整操作台使颅骨中线与参考线重合或平行,拍照记录脑定位的初始位置,实时监测脑血流相对值,记录时间2 min,作为给药前或缺氧前正常脑血流基线值。记录完成后,将小鼠暴露的颅顶进行缝合,放回鼠笼恢复48 h,之后将小鼠按照1.4 分组处理并麻醉,每组5只。按原始位置图片调整脑定位,再次实时监测脑血流相对值2 min。绘制实验处理前后脑血流实时变化图像和折线图,从折线图上每间隔10 s取脑血流绝对值,缺氧处理前后各取12个点进行统计分析。
1.6 试剂盒测定小鼠海马T-SOD活性和MDA含量
小鼠分组处理方法同1.4,每组5只。处理后将小鼠处死,迅速取脑并分离海马组织。用考马斯亮蓝试剂盒按照说明书步骤操作,定量检测样品蛋白浓度。分别按照T-SOD 和MDA 检测试剂盒说明书操作,用紫外分光光度计测定吸光度,计算各组小鼠海马组织T-SOD 活性(kU·g-1蛋白)和MDA含量(μmol·g-1蛋白)。
1.7 HE染色观察小鼠海马组织病理变化
将小鼠按照1.4分组处理并麻醉,每组3只。经心脏灌流4%多聚甲醛40 mL,取出全脑,浸泡于4%多聚甲醛溶液中4 ℃固定2 d,经梯度酒精脱水、二甲苯透明和石蜡包后埋常规切片,厚度5 μm。每只小鼠各取1张脑片,经常规HE染色后置显微镜下观察海马区细胞形态。
1.8 脑组织含水率测定
小鼠分组处理方法同1.4,每组4 只,按分组处理后处死并取全脑,去除嗅球和延髓,先用分析天平称量湿重,而后置60 ℃烘箱连续烘干1周后称量其干重,计算脑组织含水率。脑组织含水率(%)=(湿重-干重)/湿重×100%。
1.9 TUNEL染色检测海马神经细胞凋亡率
小鼠分组处理方法同1.4,每组3 只,小鼠灌流和石蜡切片制备方法同1.7。每只小鼠各取1 张海马脑片,按照TUNEL 细胞凋亡试剂盒说明书操作,用含有DAPI 的抗荧光淬灭封片剂封片,于显微镜下观察计数阳性细胞数,根据凋亡细胞分布情况在400 倍光镜下,每组切片拍摄7 个阳性视野,每个视野计数150 个细胞,以凋亡细胞数占总细胞数的百分比作为凋亡率。
1.10 统计学分析
2 结果
2.1 NaCN对小鼠缺氧存活时间的影响
小鼠缺氧存活时间如图1所示,与缺氧对照组比较,缺氧+NaCN 2.56,3.8 和5.1 mg·kg-1组小鼠平均存活时间显著延长(P<0.01);与缺氧+NaCN 2.56 mg·kg-1组比较,缺氧+NaCN 3.8和5.1 mg·kg-1组小鼠平均存活时间显著延长(P<0.01)。
2.2 NaCN对缺氧小鼠动脉血气值的影响
表1结果可见,与正常对照组比较,缺氧30 min组小鼠pO2和pH 值显著下调(P<0.05),pCO2显著上调(P<0.05);缺氧60 min 组pCO2显著上调(P<0.05);NaCN 3.8 mg·kg-1组sO2和pO2均显著下调(P<0.05)。与缺氧30 min 组比较,NaCN+缺氧30 min 组sO2和pO2上调(P<0.05),pCO2下调(P<0.05)。与缺氧60 min 组比较,NaCN+缺氧60 min组sO2,pO2和pCO2均无显著性差异。
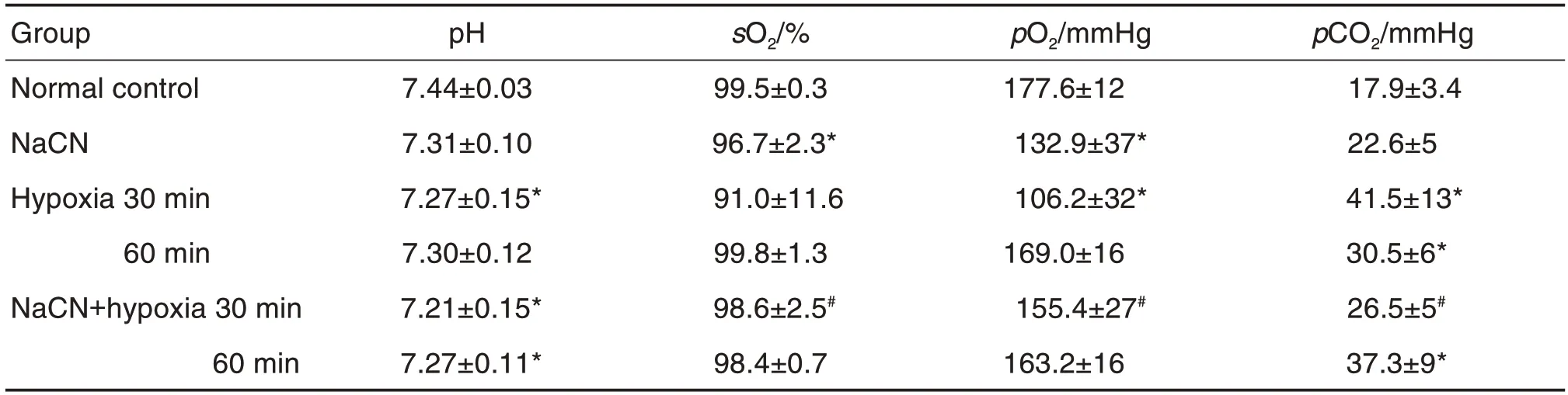
Tab.1 Effect of NaCN on arterial blood gas values in hypoxic mice
2.3 NaCN对缺氧小鼠皮质脑血流的影响
小鼠皮质脑血流激光散斑成像(图2A)显示,正常对照组小鼠血流量丰富,同正常对照组比较,缺氧30 min 组主支循环无明显变化,侧支循环远端末梢减少;缺氧60 min 组主、侧支循环均减少;NaCN 3.8 mg·kg-1组主支循环减少;NaCN+缺氧30 min组主支循环血流量显著减少,侧支循环稀疏分布。NaCN+缺氧60 min组主循环血流量进一步减少,侧支循环消失。
统计分析结果(图2B)显示,与正常对照组比较,除缺氧30 min 组外,其余各组皮质脑血流相对值均显著下调(P<0.01)。同缺氧30 min 组比较,NaCN+缺氧30 min 组皮质脑血流相对值显著下调(P<0.01)。同缺氧60 min 组比较,NaCN+缺氧60 min组皮质脑血流相对值也显著下调(P<0.01)。
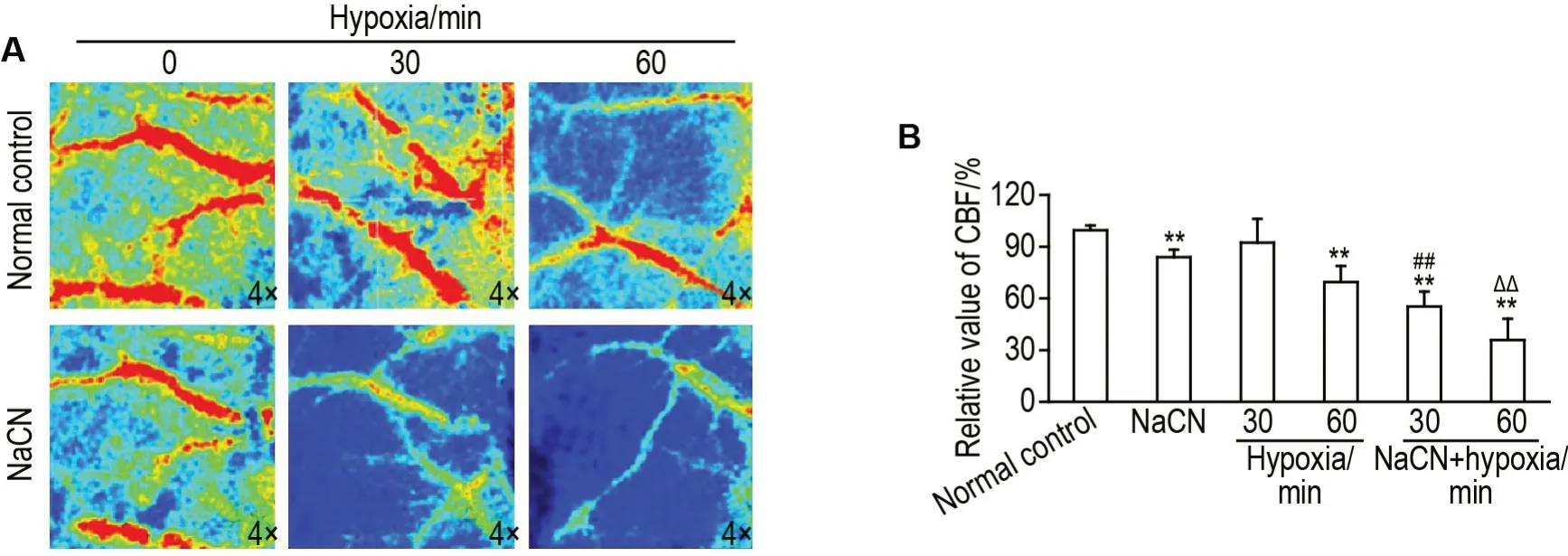
Fig.2 Effect of NaCN on cerebral cortical blood flow in hypoxic mice.See Tab.1 for the mouse treatment.A:real time laser speckle images of mouse cerebral blood flow(CBF).B:statistical analysis of the relative value of CBF in each group.Relative CBF(%)=Cerebral blood flow value of experimental group/cerebral blood flow value of control group×100%.±s,n=5.**P<0.01,compared with normal control group.##P<0.01,compared with hypoxia 30 min group.ΔΔP<0.01,compared with hypoxia 60 min group.
2.4 NaCN对缺氧小鼠氧化应激水平的影响
实验结果(图3)显示,与正常对照组比较,缺氧30 min 组和缺氧60 min 组小鼠T-SOD 活性和MDA 含量均无显著性差异;NaCN 3.8 mg·kg-1组、NaCN+缺氧30 min 组和NaCN+缺氧60 min 组T-SOD活性和MDA含量均显著上调(P<0.01)。与缺氧30 min 组比较,NaCN+缺氧30 min 组T-SOD活性和MDA含量显著上调(P<0.01)。与缺氧60 min组比较,NaCN+缺氧60 min 组T-SOD 活性和MDA含量也显著上调(P<0.01)。
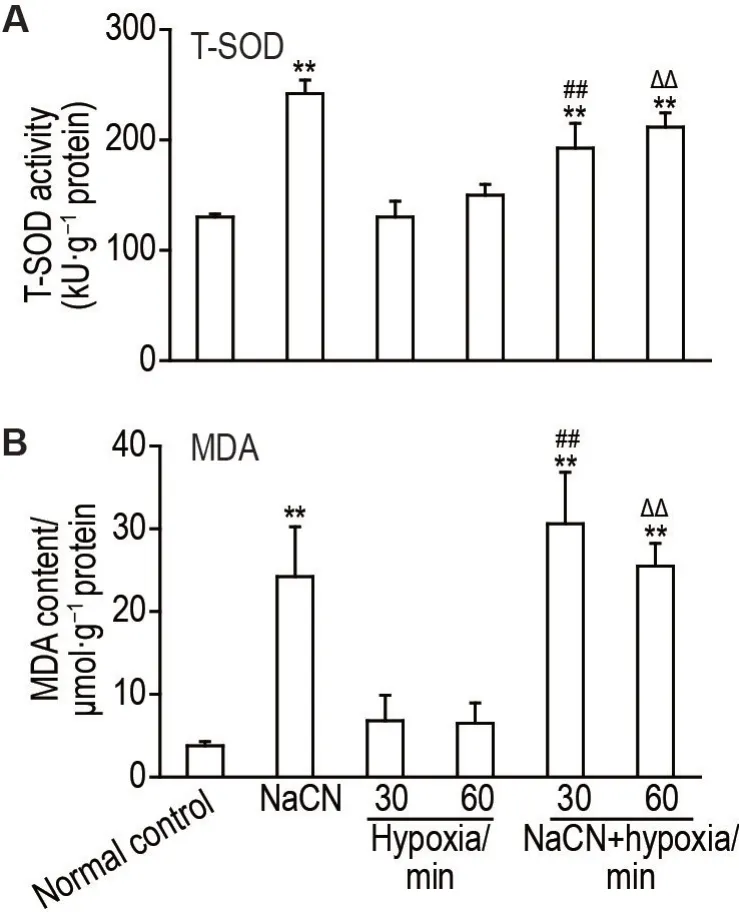
Fig.3 Effect of NaCN on MDA content(B)and TSOD activity(A)in hippocampal tissue of hypoxic mice.See Tab.1 for the mouse treatment.A:statistical analysis of total superoxide dismutase(T-SOD)activity in the hippocampus of hypoxia and NaCN poisoning combined hypoxia mice.B:statistical analysis of malondialdehyde(MDA)content in the hippocampus of hypoxia and NaCN poisoning combined hypoxia mice.±s,n=5.**P<0.01,compared with normal control group;##P<0.01,compared with hypoxia 30 min group;ΔΔP<0.01,compared with hypoxia 60 min group.
2.5 NaCN 对缺氧小鼠海马组织病理结构和脑组织含水率的影响
HE 染色结果(图4A)显示,正常对照组小鼠海马组织细胞排列层次分明,神经元结构完整;缺氧30 min 组小鼠海马细胞排列稀疏、出现空泡化;缺氧60 min 组海马神经元数目减少,细胞核固缩,颜色加深;NaCN 3.8 mg·kg-1组小鼠海马组织神经元细胞数量减少;NaCN+缺氧30 min 组和NaCN+缺氧60 min 组海马组织细胞排列稀疏紊乱,细胞肿胀,出现空泡化,神经元数目减少。
脑组织含水率检测结果(图4B)显示,与正常对照组比较,缺氧30 min组和缺氧60 min组小鼠脑组织含水率均无明显改变;NaCN 3.8 mg·kg-1组、NaCN+缺氧组30 min和60 min小鼠脑组织含水率显著增加(P<0.01)。与缺氧30 min组比较,NaCN+缺氧30 min 组脑组织含水率显著增加(P<0.01)。与缺氧60 min 组比较,NaCN+缺氧60 min 组脑组织含水率显著增加(P<0.01)。
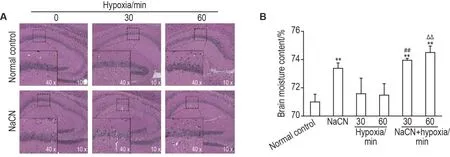
Fig.4 Effect of NaCN on pathological structure of hippocampus(A)and brain moisture content(B)in hypoxic mice.See Tab.1 for the mouse treatment.Moisture content(%)=(Wet mass-dry mass)/wet mass×100%.±s,n=4.**P<0.01,compared with normal control group;##P<0.01,compared with hypoxia 30 min group;ΔΔP<0.01,compared with hypoxia 60 min group.
2.6 NaCN对缺氧小鼠海马细胞凋亡率的影响
TUNEL 染色结果(图5)显示,与正常对照组比较,各处理组细胞凋亡率均显著增加(P<0.01);与缺氧30 min 组比较,NaCN+缺氧30 min 组细胞凋亡率显著增加(P<0.01);与缺氧60 min 组比较,NaCN+缺氧60 min 组细胞凋亡率也显著增加(P<0.01)。
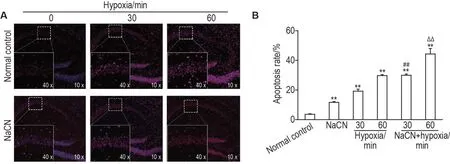
Fig.5 Effect of NaCN on apoptosis of hippocampal cells in hypoxic mice by TUNEL staining.See Tab.1 for the mouse treatment.B was the statistical analysis result of A.±s,n=3.**P<0.01,compared with normal control group;##P<0.01,compared with hypoxia 30 min group;ΔΔP<0.01,compared with hypoxia 60 min group.
3 讨论
NaCN 中毒时,线粒体有氧呼吸电子链传递过程受到抑制,从而使组织或细胞对氧的利用率降低[12]。在缺氧环境下,NaCN 染毒可降低组织对氧的利用,短时间内代偿部分急性单纯缺氧引起的肺通气和换气功能不足,延长单纯缺氧小鼠的存活时间,但由于NaCN 染毒后会造成神经组织氧利用障碍,会进一步加重缺氧造成的海马神经元损伤。本研究结果表明,给予NaCN 能延长小鼠在缺氧密闭罐内的存活时间。
动脉血气值是分析机体对缺氧响应的敏感指标。本研究结果显示,单纯缺氧30 min 时,由于外界氧供不足,小鼠体内气体交换不足,小鼠呼吸方式改变为浅快呼吸,同时出现pO2下降、pCO2上升和pH 显著下降,体内发生酸中毒。随着缺氧时间延长,由于气体交换障碍,小鼠呼吸出现缓慢深呼吸,血液CO2进一步蓄积,缺氧60 min 时,血液pH值偏酸性。NaCN 染毒小鼠组织细胞氧利用能力降低,血液中游离氧浓度相对增加,表现出sO2和pO2下降,而pCO2和pH 无显著改变。比较单纯缺氧与NaCN 染毒复合缺氧后可发现,给予NaCN 可缓解缺氧诱导的pCO2上调,纠正酸中毒,使pO2和sO2显著性上升。以上结果提示,NaCN 染毒延长小鼠缺氧存活时间的机制与NaCN 染毒后机体氧利用能力下降,血液中游离氧增加有关。
环境缺氧复合NaCN 染毒缺氧会导致小鼠体内酸中毒,导致血管扩张[15-16],血液流量和流速下降,继而出现血管代偿性改变。大脑耗氧量大,是机体对缺氧最敏感的组织器官,脑内氧供与脑血流变化密切相关[17-18]。本研究发现,NaCN 染毒复合缺氧小鼠较单纯缺氧小鼠脑血流进一步降低,并随时间延长而加重。脑血流减少导致脑组织缺氧,从而引发氧化应激反应。SOD 活性反应机体清除氧自由基的能力,MDA反应细胞受自由基攻击的严重程度。本研究对小鼠海马组织T-SOD 活性和MDA含量进行检测,发现NaCN 染毒后加重缺氧小鼠海马组织氧化应激反应。
血液是输送氧气和各种营养物质的载体,同时脑血流与脑内脑脊液和组织液回流密切相关[19]。本研究通过观察脑组织含水率发现,NaCN 染毒后小鼠出现脑水肿现象,这可能与缺氧及酸中毒导致的微血管通透性增加和神经元细胞损伤有关。本研究通过HE 染色发现,NaCN 染毒后出现明显的细胞肿胀、空泡化、神经元数量减少,部分细胞出现核固缩和细胞碎片。本研究通过TUNEL 染色发现,单纯缺氧可导致小鼠海马细胞凋亡,NaCN 染毒可加剧缺氧小鼠海马细胞凋亡。
综上所述,急性NaCN 染毒能够降低细胞利用氧的能力,延缓CO2在体内的蓄积和增加体内的游离氧,缓解单纯缺氧引发的呼吸性酸中毒,从而延长小鼠缺氧存活时间,但NaCN染毒可加剧缺氧小鼠脑血流的降低,诱发脑组织水肿,导致海马组织发生氧化应激反应和神经细胞凋亡。本研究为探讨氰化物加重缺氧诱发的小鼠中枢神经系统损伤的机制提供了实验依据,为临床缺氧类疾病提供新的治疗思路。
