小鼠两瓶自由选择模型上加波沙朵的精神依赖作用
2024-03-07阿来木合亚提赵玉俞纲苏瑞斌
阿来·木合亚提,赵玉,俞纲,苏瑞斌
(军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,神经精神药理学北京市重点实验室,北京 100850)
γ-氨基丁酸A 型受体(γ-aminobutyric acid type A receptor,GABAAR)是哺乳动物神经系统普遍存在的抑制性受体,广泛参与中枢神经系统的功能,包括警觉、疼痛、睡眠-觉醒、情绪和认知等[1-2]。目前已发现20 种GABAAR 亚基(α1-6,β1-4,γ1-3,δ,ε,π,θ 和ρ1-3),这些亚基排列组合成不同的五聚体亚型,每种亚型又表现出不同的脑区和细胞分布特点。GABAAR 结构的异质性可能与其参与介导多重生物学功能相关[1,3-5]。GABAAR 也是苯二氮类药物的作用靶点[6]。然而传统的GABAAR变构调节剂已被证实存在潜在的精神依赖风险,如地西泮剂量依赖性地降低小鼠颅内自我刺激模型中的奖赏阈值[7],氟溴西泮可诱导小鼠产生条件性位置偏爱[8]。同时已证实,苯二氮类药物可能被用于娱乐,以获得快感,具有潜在的精神依赖风险,从而限制了该类药物的临床应用[9]。
根据亚基组成和亚细胞定位的差异可将GABAAR 分为突触内和突触外2 种类型[10],前者通常由α1,2,3,5,β 和γ2亚基组成,介导时相性抑制效应,具有高电导、快速脱敏和GABA 敏感性低的特点;后者通常由α4,α6和δ 亚基组成,介导强直性抑制效应[11-12],被认为是睡眠障碍、癫痫、疼痛和抑郁的潜在治疗靶点[13]。突触外GABAAR 选择性激动剂加波沙朵(gaboxadol)在非临床研究中未见其具有精神依赖性的报道[14]。在野生型小鼠中,加波沙朵可诱导条件性位置厌恶,而在δ亚基敲除小鼠中,该行为效应消失[15];加波沙朵在小鼠和狒狒的静脉自身给药模型中也未表现出强化效应[15]。突触外GABAAR 甚至被认为是酒精和可卡因成瘾的潜在治疗靶点[16-19]。然而,加波沙朵可引起腹侧被盖区(ventral tegmental area,VTA)多巴胺(dopamine,DA)能神经元突触可塑性的改变[15,20],而神经可塑性改变是咪达唑仑(midazolam)等诱导药物依赖的标志性变化[21-22]。因此,加波沙朵是否存在精神依赖性仍有待证实。
两瓶自由选择实验(two-bottle free-choice test)是通过观察啮齿类动物自主口服摄入某种化学物质溶液的行为来评估该物质精神依赖潜能的自身给药实验。已有研究报道,在两瓶自由选择模型上,咪达唑仑可诱导小鼠产生显著偏好,且该效应与伏隔核中含α1和α2亚基的GABAAR 有关[22]。本研究旨在利用小鼠两瓶自由选择模型评价突触外GABAAR选择性激动剂加波沙朵的精神依赖潜能。
1 材料与方法
1.1 药物、试剂和主要仪器
咪达唑仑(批号201002,纯度>98%),中国食品药品检定研究院;加波沙朵(批号64603-91-4,纯度>99%),美国MedChemExpress 公司;吐温-80,北京索莱宝科技有限公司;二甲亚砜(DMSO),美国Amresco 公司;生理盐水,石家庄四药有限公司。在翻正反射消失(loss of righting reflex,LORR)实验中,咪达唑仑用含5% DMSO(V/V)和5%吐温-80(V/V)的去离子水配制,加波沙朵用生理盐水配制。两瓶自由选择实验中,咪达唑仑溶解在50 μL DMSO和50 μL 吐温-80 中,再用4%蔗糖溶液稀释至1.4×10-5mol·L-1;加波沙朵用4%蔗糖溶液配制至3.9×10-6mol·L-1。CPA225D 电子天平,德国赛托利斯公司;饮水瓶,吉祥海螺科技有限公司。
1.2 实验动物和分组
雄性C57BL/6J小鼠,SPF级,6~8周龄,18~22 g,购自北京斯贝福生物技术有限公司,实验动物许可证号:SCXK(京)2019-0010。实验前每笼5 只群养,实验期间每笼1 只孤养。饲养环境室温25 ℃,湿度50%~60%,12 h/12 h 明暗交替,小鼠自由摄食饮水。
LORR 实验设置咪达唑仑(59.0,73.7,92.2,115.2,144.0 和180.0 mg·kg-1)6 个剂量组,加波沙朵(8.4,10.5,13.1,16.4,20.5,25.6 和32.0 mg·kg-1)7 个剂量组及相应溶剂对照组,每组8 只小鼠。两瓶自由选择实验设置咪达唑仑(1.4×10-5mol·L-1)、加波沙朵(3.9×10-6mol·L-1)和正常对照组,每组10 只小鼠。所有实验操作均获军事医学研究院实验动物伦理委员会批准(编号:AMMS-06-2019-006)。
1.3 翻正反射消失实验
将小鼠单独置于有机玻璃盒(40 cm×20 cm×20 cm)中适应10 min 后开始实验。ig 给予咪达唑仑、加波沙朵或溶剂后,将小鼠轻轻仰卧位放置,每1 min 评估1 次翻正反射,直至出现LORR(仰卧姿态),且60 s 内不能恢复正常俯卧位姿态。小鼠出现LORR 后不受干扰,直至自行翻身恢复至俯卧位。小鼠在60 s内能够恢复俯卧位2次及以上即为翻正反射恢复。小鼠给药后120 min内始终能够恢复俯卧位,则认为LORR 未发生。记录出现LORR的动物数,根据LORR量效关系计算药物的半数有效量(median effective dose,ED50)。通过ED50(咪达唑仑)∶ED50(加波沙朵)=C(咪达唑仑)∶C(加波沙朵)计算出与文献咪达唑仑[22]药效相当的加波沙朵浓度,作为两瓶自由选择模型的药物使用浓度。
1.4 两瓶自由选择实验
实验分为3 个阶段进行(图1)。适应期(第1~3 天):将小鼠单笼饲养并分为正常对照组、咪达唑仑组和加波沙朵组,每笼放入2个饮水瓶,均装入饮用水,置于饲养笼对称位置;训练期(第4~5 天):2 个饮水瓶均以4%蔗糖溶液替换饮用水;测试期(第6~15 天):将咪达唑仑组和加波沙朵组小鼠笼中的1 个饮水瓶分别装入含咪达唑仑或加波沙朵的蔗糖溶液(测试瓶),另1瓶分别装入含相应溶剂的蔗糖溶液(溶剂对照瓶);将正常对照组笼中的2个饮水瓶均装入4%蔗糖溶液。每日9∶00更新溶液,21∶00更换2个饮水瓶的位置,以消除化合物降解变质及动物可能的位置偏好对实验结果的干扰。每日9∶00记录小鼠每瓶饮用量,计算每日总饮用量(每日每只小鼠测试瓶与溶剂对照瓶饮用量之和)、测试瓶累计饮用量(测试期内测试瓶总饮用量)、相对饮用量(测试瓶饮用量/溶剂对照瓶饮用量)和测试期内累计相对饮用量(测试期每日相对饮用量之和)。测试瓶累计饮用量或相对饮用量升高即表明小鼠对该药物产生偏好。
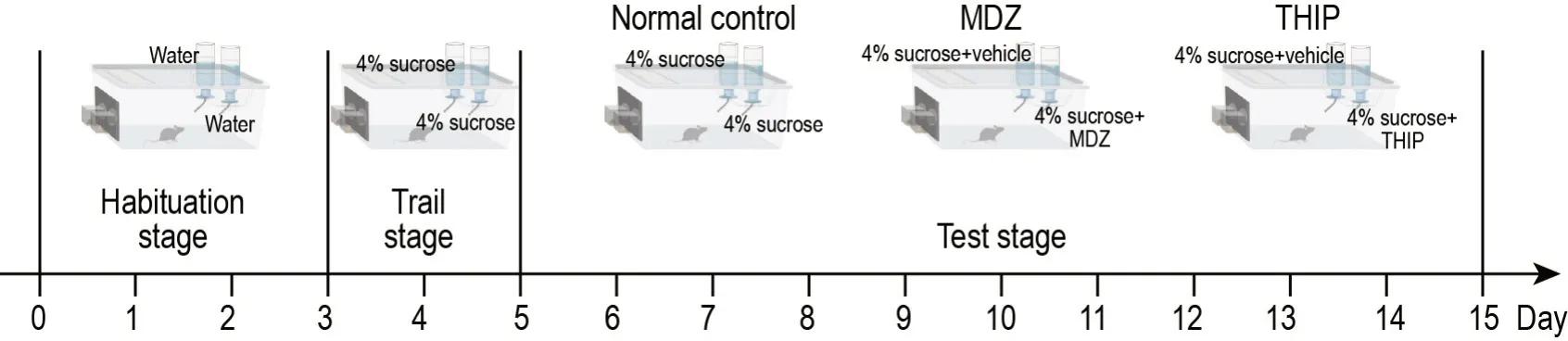
Fig.1 Flow chart of two-bottle free-choice paradigm.Mice were housed with free access to two bottles of water in their home cage during the first day(D1)to D3(habituation stage)before 4% sucrose was added to both bottles during D4-D5(trail stage).During the test stage(D6-D15),mice had access to bottles containing either midazolam(MDZ,1.4×10-5 mol·L-1)or gaboxadol(THIP,3.9×10-6 mol·L-1)in 4% sucrose or vehicle in 4% sucrose(vehicle consisting of 50 μL dimethyl sulfoxide and 50 μL Tween-80 or saline).
1.5 统计学分析
2 结果
2.1 咪达唑仑和加波沙朵ig 给药剂量依赖性诱导小鼠翻正反射消失
结果显示,咪达唑仑(图2A)和加波沙朵(图2B)ig 给药均剂量依赖性地增加小鼠LORR 率。咪达唑仑73.7 mg·kg-1诱导小鼠开始出现LORR,180.0 mg·kg-1LORR 率达100%,其诱导LORR 的ED50为105.3 mg·kg-1(95%CI:96.4~115.2 mg·kg-1,R2=0.9796)。加波沙朵8.4 mg·kg-1诱导小鼠开始出现LORR,25.6 mg·kg-1及以上剂量LORR 率为100%,其诱导LORR 的ED50为13.7 mg·kg-1(95%CI:12.6~15.0 mg·kg-1,R2=0.9773)。加波沙朵与咪达唑仑的效价(ED50)比值为7.69,参照文献[22]中咪达唑仑溶液浓度(1.4×10-5mol·L-1,相对分子质量:325.77),确定两瓶自由选择模型中加波沙朵溶液浓度为3.9×10-6mol·L-1(相对分子质量:176.60)。
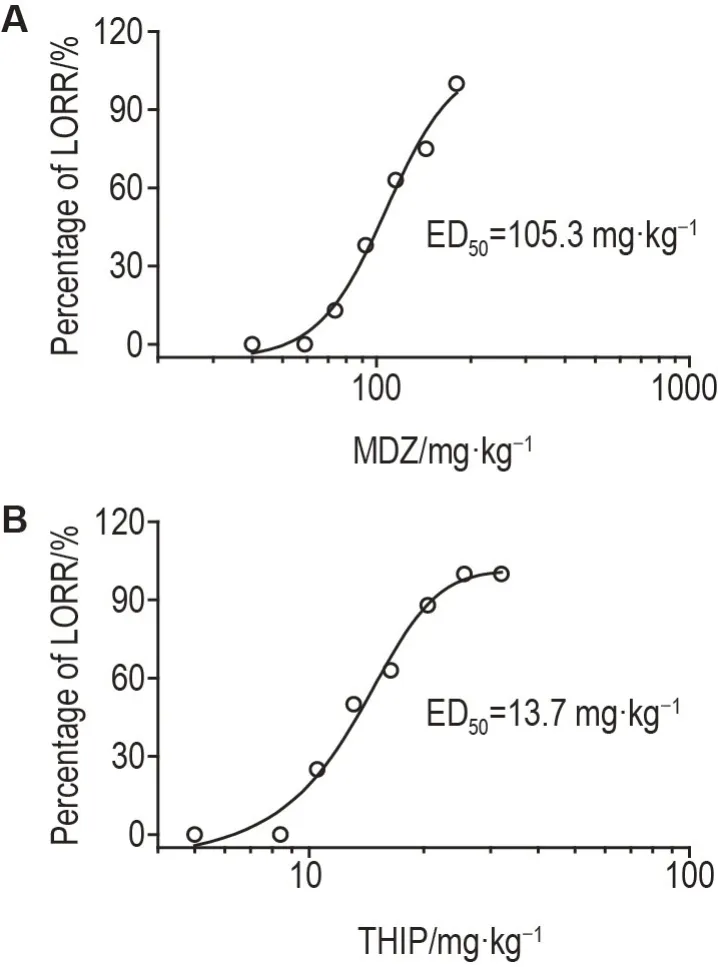
Fig.2 Dose-response effect of MDZ(A)and THlP(B)on percentage of loss of righting reflex(LORR)in mice.Mice were ig administrated with MDZ(59.0,73.7,92.2,115.2,144.0 and 180.0 mg·kg-1),THIP(8.4,10.5,13.1,16.4,20.5,25.6 and 32.0 mg·kg-1)or vehicle.Non-liner regression was performed between doses and percentage of LORR.Median effective dose(ED50)was estimated from the dose-response curve.±s,n=8.
2.2 加波沙朵不影响小鼠每日总饮用量
两瓶自由选择模型中,各组小鼠每日总饮用量如图3所示。适应期,各组小鼠每日总饮用量约为3~5 mL(图3A);训练期,以4%蔗糖溶液替换饮水,各组小鼠每日总饮用量约为8~12 mL(图3A)。在测试期内,无论瓶内溶液更新或者饮水瓶位置更换,各组小鼠每日总饮用量维持稳定,约为8~10 mL(图3B)。
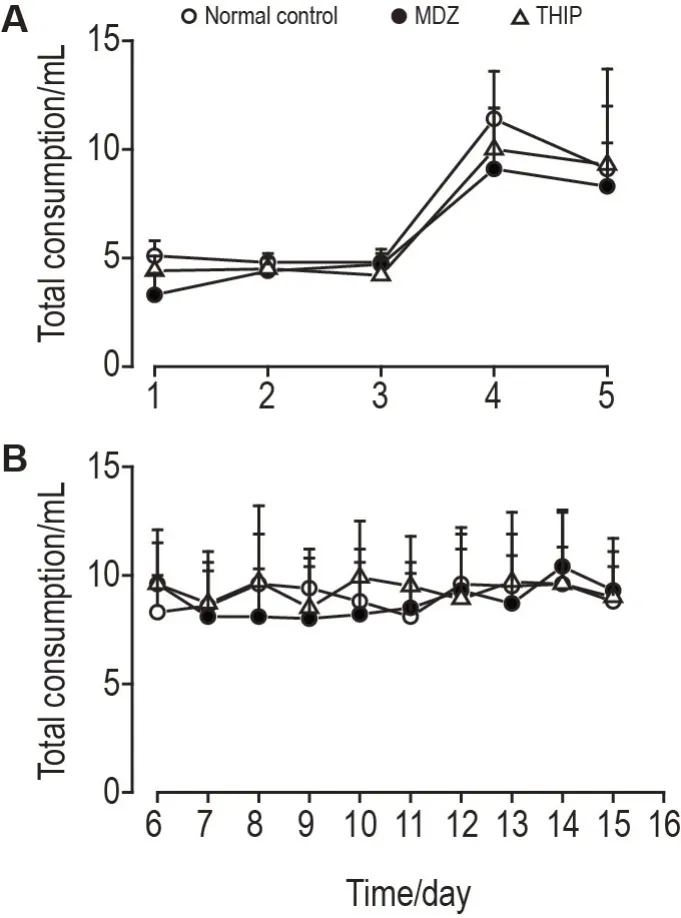
Fig.3 Two-bottle free-choice MDZ(1.4×10-5 mol·L-1)and THlP(3.9×10-6 mol·L-1)total consumption in habituation and trial stages(A)and test stage(B)in mice.See Fig.1 for the mouse treatment.±s,n=10.
2.3 加波沙朵组小鼠测试瓶饮用量增加
在测试期内,各组小鼠测试瓶和溶剂对照瓶的饮用量如图4所示。重复测量的双因素方差分析结果显示,测试期内正常对照组小鼠对两瓶溶液的每日饮用量无统计学差异(F(1,18)=0.042,P=0.839,图4A);整个测试期内咪达唑仑组对测试瓶和溶剂对照瓶的每日饮用量总体无显著性差异(F(1,18)=3.315,P=0.085),但第11~15 天测试瓶饮用量显著高于溶剂对照瓶(F(1,18)=4.613,P<0.05,图4B);加波沙朵组测试瓶整个测试期内饮用量显著高于溶剂对照瓶(F(1,18)=14.81,P<0.01,图4C),且在第8和9 天测试瓶饮用量较溶剂对照瓶显著增加(P<0.05,图4C)。单因素方差分析结果显示,与正常对照组比较,咪达唑仑组和加波沙朵组测试瓶累计饮用量有升高趋势,但无统计学差异(F(2,27)=2.123,P=0.139,图4D)。
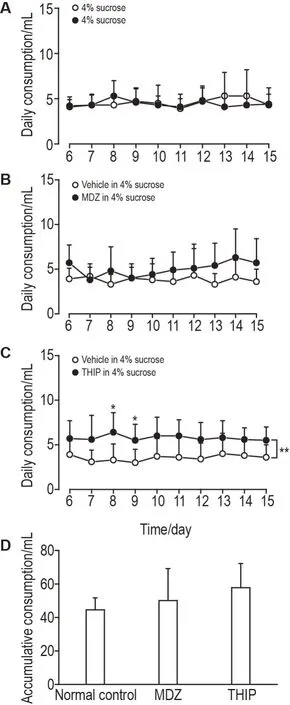
Fig.4 Two-bottle free-choice MDZ(1.4×10-5 mol·L-1)and THlP(3.9×10-6 mol·L-1)consumption in mice.See Fig.1 for the mouse treatment.A-C:daily consumption of the test bottle and vehicle bottle in the test stage.An analysis of the D11-D15 data indicated a significant increase in the daily consumption of MDZ(C).D:accumulative consumption of the test bottle in normal control,MDZ and THIP groups during the test stage.±s,n=10.*P<0.05,**P<0.01,compared with vehicle in 4% sucrose(vehicle bottle)(two-way ANOVA with Bonferroni post hoc test).
2.4 加波沙朵诱导小鼠产生饮用偏好
根据测试期各组小鼠测试瓶和溶剂对照瓶的实际饮用量,计算不同药物的相对饮用量。正常对照组小鼠相对饮用量维持在1.0~1.3(图5A);咪达唑仑组小鼠第6~9 天每日相对饮用量在0.9~1.8 波动,自第10 天起逐渐上升,第12~15 天相对饮用量维持在1.9~2.3(图5A);加波沙朵组小鼠每日相对饮用量维持在1.8~2.7。重复测量的双因素方差分析结果显示,各组每日相对饮用量之间具有统计学差异(F(2,27)=5.219,P<0.05,图5A),第9 天加波沙朵组的相对饮用量与正常对照组比较显著增加(P<0.05;图5A)。与正常对照组比较,加波沙朵组累计相对饮用量显著升高(P<0.01,图5B)。
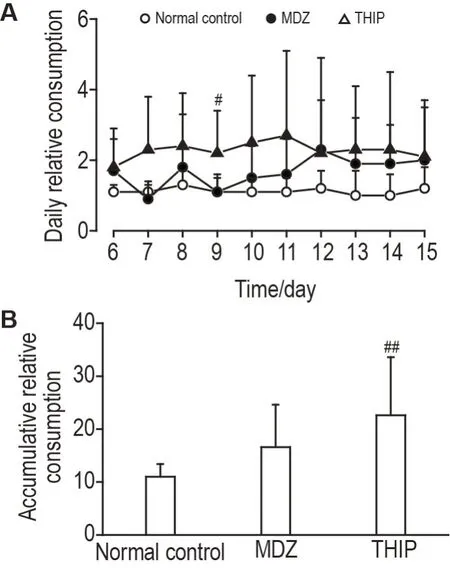
Fig.5 Two-bottle free-choice MDZ(1.4×10-5 mol·L-1)and THlP(3.9×10-6 mol·L-1)relative consumption in mice.See Fig.1 for the mouse treatment.A:daily relative consumption meant the consumption of the test bottle(mL)/ consumption of the vehicle bottle(mL).B:accumulative relative consumption means the sum of the relative consumption of each mouse during the test stage.±s,n=10.#P<0.05,compared with normal control group,two-way ANOVA with Bonferroni post hoc test.##P<0.01 compared with normal control group,one-way ANOVA with Bonferroni post hoc test.
2.5 咪达唑仑和加波沙朵不影响小鼠体重
在测试期内,各组小鼠体重均逐步增加,且各组间小鼠体重变化无统计学意义(图6)。提示自由饮用咪达唑仑或加波沙朵对小鼠体重无显著影响。
Fig.6 Body mass of mice during test stage.See Fig.1 for the mouse treatment.±s,n=10.
3 讨论
加波沙朵对突触外GABAAR 具有较高的效能和效价强度,是研究突触外GABAAR 药理学效应的常用工具药[23]。传统靶向突触内GABAAR 的药物存在精神依赖风险[9],而激活突触外GABAAR 是否诱导精神依赖仍有争议。本研究通过两瓶自由选择实验发现,突触外GABAAR 激动剂加波沙朵也存在精神依赖风险。
《精神疾病诊断和统计手册》(第5版)[24]中,“物质相关和成瘾性障碍”的基本特征是个体知道存在显著的物质相关问题仍然继续使用该物质;其临床诊断标准可概括为:长期获得,自主使用,高摄入量,强烈渴求,不计对工作、社交以及生理心理的负面影响,难以控制,产生耐受和戒断症状。研究药物精神依赖性需要建立真正模拟人类成瘾性障碍临床特征的动物模型,目前常用的动物模型主要包括行为敏化、条件性位置偏爱、脑电自我刺激和自身给药等[25],其中自身给药模型是最经典、最受认可的模型。Tan 等[22]首次尝试用两瓶自由选择模型,即口服自身给药的方式评估了苯二氮类药物的精神依赖潜能。相比于其他常用模型,两瓶自由选择模型具有简单易行、非侵入性、无混杂因素(包括施加压力诱导小鼠摄入药物)和口服给药数据的临床转化意义等优势。本研究发现,加波沙朵组小鼠在药物和溶剂之间长期、连续地自主选择服用药物,其行为表现与阳性药咪达唑仑组小鼠相似。2种药物均可诱导小鼠产生强烈的可测量的服药动机,符合人类成瘾性障碍的关键特征。本研究中,小鼠咪达唑仑的每日饮用量为0.7~1.1 mg·kg-1,与文献中的饮用量(0.8~1.1 mg·kg-1)相似[22],加波沙朵的每日饮用量为0.1~0.2 mg·kg-1。本研究在考察咪达唑仑和加波沙朵精神依赖性的同时,也观察了长期用药对小鼠体重的影响,发现咪达唑仑和加波沙朵偏好小鼠体重增长的趋势和幅度均与正常对照组接近。
药物形成精神依赖的早期阶段,VTA 的DA 神经元会表现出突触可塑性改变[21,26],包括突触部位形成新的缺乏GluA2亚基的α-氨基-3-羟基-5-甲基-4-异唑丙酸受体(α-amino-3-hydroxy-5-methyl-4 - isoxazolepropionic acid receptor,AMPAR),N-甲基-D-天冬氨酸受体(N-methyl-D-aspartic acid receptor,NMDAR)活性降低,这种可塑性改变的标志是AMPA/NMDA 比值增加[27-28]。奖赏通路中,VTA 的GABA 能神经元和中脑皮质边缘DA能神经元等均表达GABAAR[22,29]。根据这些受体被激活的位置,推测其可能通过调节VTA DA 能神经元和/或通过对DA 能神经元的投射促进奖赏或厌恶动机[30]。已有研究表明,咪达唑仑激活VTA 中含有α1亚基的GABAAR,使下游含有α3亚基的GABAAR的DA 能神经元去抑制,从而增加DA 水平,诱发突触可塑性改变[22];与此结果一致,α1突变小鼠在两瓶自由选择模型中并未对咪达唑仑形成偏好[22]。另有研究报道,化合物TPA023 对含有α1的GABAAR 无活性,在狒狒的自身给药模型上未表现出精神依赖潜能[31-32],进一步证明含有α1的突触内GABAAR 可能与精神依赖风险有较高的相关性。加波沙朵在小鼠和狒狒静脉自身给药模型上未表现出强化效应[15],甚至诱导小鼠产生条件性位置厌恶[20],加波沙朵也可诱导VTA 中AMPA/NMDA 比值升高,引发依赖相关的神经可塑性改变,因此激活突触外GABAAR 是否诱导依赖仍存在争议。在大鼠酒精口服自身给药模型上,敲减伏隔核背内侧壳核中的GABAAR δ 亚基可显著降低酒精摄入量[33],提示该核团中含δ亚基的突触外GABAAR参与了酒精的强化作用[34]。Siivonen 等[35]也发现,GABAAR δ 亚基敲除小鼠中,吗啡诱导的条件性位置偏好被逆转,即缺乏GABAAR δ 亚基,阿片类药物的条件性奖赏效应减弱。近年来有研究进一步报道,GABAAR δ 亚基(GABRD)基因甲基化修饰可能参与海洛因成瘾的奖赏,增加GABRD甲基化显著增强海洛因复吸,而抑制其甲基化能够显著减少复吸[36],GABRD基因多态性位点rs13303344 与海洛因成瘾患者的药物渴求相关联[37]。总之,加波沙朵对VTA 脑区神经可塑性的影响与药物形成精神依赖的早期阶段的变化相似,且有证据表明突触外GABAAR δ 亚基促进了酒精和吗啡的成瘾,因此靶向突触外GABAAR 的药物存在精神依赖性的可能性较大。本研究中,小鼠对口服加波沙朵产生了显著的偏好,这一结果支持突触外GABAAR 促进药物精神依赖发生的观点。
综上所述,与突触内GABAAR 变构调节剂咪达唑仑一样,突触外GABAAR 激动剂加波沙朵在两瓶自由选择模型中可诱导动物产生显著的偏向性饮用,提示加波沙朵仍可能存在精神依赖潜能。
