神经调控技术在脑科学研究中的应用研究进展
2024-03-07刘梦楠田萧羽李奕潼吴宁李锦李红
刘梦楠,田萧羽,2,李奕潼,吴宁,李锦,李红
(1.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,神经精神药理学北京市重点实验室,北京 100850;2.中国人民解放军医学院,北京 100853;3.沈阳药科大学无涯创新学院,辽宁沈阳 110016)
21世纪是脑科学的时代,脑科学研究主要是从生物医学角度阐明大脑功能的神经基础和工作原理[1]。抑郁、精神分裂症和阿尔茨海默病等精神疾病危害人体健康和社会稳定。据世界卫生组织报道,脑疾病患者人数占比28%,已超越心血管和癌症患者数量,给社会带来了巨大负担。了解大脑的结构和功能是当前最前沿的科学问题之一,因此脑科学研究的战略地位至关重要[2],世界各国对脑科学研究给予高度重视。
大脑是一个复杂的结构,过去对于大脑的研究聚焦于单个细胞或几个细胞组成的简单神经回路[3],对于大批神经元是如何动态调控行为活动仍未完全解析。近年来,脑科学研究技术不断涌现,化学遗传、光遗传等技术正朝向精准、瞬时、非侵入控制神经元活动的方向发展。在此基础上又出现了利用磁热、磁力效应控制细胞功能的磁遗传技术,该技术有望克服化学遗传技术的药物起效延迟和光遗传技术需光纤植入手术等局限,在新一代的脑科学研究中发挥重要作用。同时,经颅电刺激(transcranial electrical stimulation,TES)、经颅磁刺激(transcranial magnetic stimulation,TMS)、深部脑刺激(deep brain stimulation,DBS)和经颅超声刺激(transcranial ultrasound stimulation,TUS)等技术在脑疾病的功能调控中也显示出一定的效果。
1 化学遗传技术
化学遗传技术结合了化学方法与遗传学原理,将人工设计的受体在特定细胞内表达,随后与特异性药物结合,从而激活或抑制细胞活性。
1.1 化学遗传受体及配体
化学遗传技术于20世纪80年代兴起,早期的应用集中于对G 蛋白偶联受体(G protein-coupled receptors,GPCR)的研究。GPCR 是真核生物细胞膜上最大的一类受体家族,与配体结合后可激活下游一系列信号通路,广泛应用于神经科学领域。1991年,Strader 等[4]设计了一种突变型β2肾上腺素能受体,通过结合位点上的氨基酸突变改变受体的特异性结合能力,该受体不能与其相应的天然配体肾上腺素结合,而可被儿茶酚胺酯和酮激活。随后,Coward等[5]于1998年在合成小分子激活GPCR策略的基础上开发了工程化受体,命名为“仅由合成配体激活的受体(receptor activated solely by a synthetic ligand,RASSL)”。他们在κ 阿片受体原型基础上引入突变,构建了2 个RASSL,这2 个受体对天然肽(如强啡肽)不敏感,但可被小分子药物螺朵林(spiradoline)激活,从而抑制腺苷酸环化酶的活性[6](表1)。但RASSL容易与其内源性受体竞争配体,存在配体和受体的非特异结合,且异位表达RASSL 可能会造成信号传导异常。为克服以上问题,2007年Armbruster等[7]开发了“由人工设计药物激活的人工设计受体(designer receptor exclusively activated by a designer drug,DREARD)”,该受体只能与人工设计的药物结合,从而控制神经元活性,药物代谢完成后神经元恢复原来状态。在脑科学研究中最常用的是氯氮平-N-氧化物(clozapine-N-oxide,CNO)-毒蕈碱受体系统[7](表1)。毒蕈碱受体是一种广泛存在于动物体内的GPCR,其天然配体是乙酰胆碱,二者结合后可引发下游信号转导,激活或抑制神经元。Armbruster等[7]将人源的毒蕈碱型受体突变,构建了人工设计的人源毒蕈碱M4 受体(human M4 muscarinic DREADD receptor coupled to Gi,hM4Di)和人工设计的人源毒蕈碱M3 受体(human M3 muscarinic DREADD receptor coupled to Gq,hM3Dq)。CNO 是非典型抗精神病药物氯氮平的一种惰性代谢产物[8],其不能激活内源性毒蕈碱受体,但可激活突变型毒蕈碱受体。在CNO 作用下,hM4Di 受体可通过激活Gi蛋白进而抑制神经元;hM3Dq 受体则可通过激活Gq蛋白进而激活神经元。CNO 可通过口服等非侵入方式给药,调节神经元持续时间长,且在药物扩散后能作用于分散分布的神经元[9]。最近,基于化学遗传工具的研究集中于工程化的配体门控离子通道[10]。利用离子通道及其小分子激动剂可激活神经元中指定的离子电导,用于刺激或沉默神经元。其特点在于通过药物选择性配体结合域和离子通道孔域组合,允许不同的离子快速通过,可进行远程控制,因此适用于对神经元的瞬时控制[9],克服化学遗传技术配体不稳定、药物起效延迟等不足。
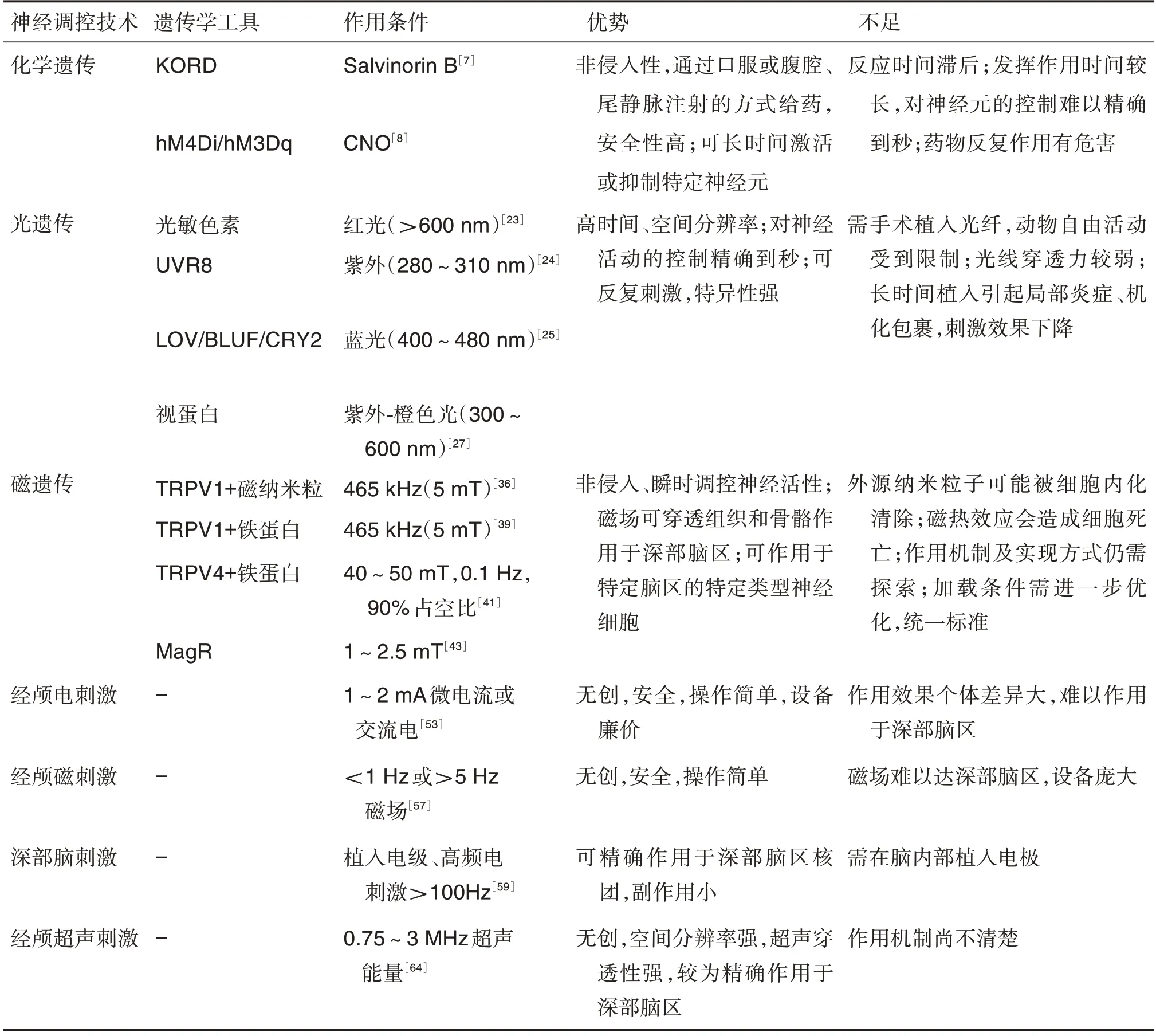
表1 常用神经调控技术的优势和不足
1.2 化学遗传技术在脑科学研究中的应用
由于化学遗传技术可针对神经系统的特定细胞类型设计工程受体,通过系统一次性给予化学药物来调控脑神经回路功能,实现了神经功能的高度选择性药物控制,因此该技术在神经科学研究中得到了广泛应用,如学习记忆、焦虑、抑郁和药物成瘾等[11]。在细胞活性依赖标记的小鼠中,急性社交挫败应激可标记被活化的屏状核神经元。应用化学遗传技术激活或沉默这群细胞的功能,可引发或减弱焦虑相关行为[12]。科学家设计并应用重组腺相关病毒载体在大鼠黑质中表达了兴奋性受体hM3Dq 和A53T 突变型α-突触核蛋白,发现慢性神经调控加重了A53T 突变型α-突触核蛋白诱导的运动障碍,而不会改变多巴胺能神经变性[13]。Mimura等[14]将表达兴奋性hM3Dq 的腺相关病毒载体注射到狨猴单侧黑质中,在食用含有高效DREADD 激动剂的食物30~90 min后,狨猴出现向激活侧对侧方向旋转行为。
1.3 化学遗传技术的优势和不足
化学遗传最大的特点是通过特异性药物作用于相应受体远程控制神经元,为解析神经元回路和破解神经元功能提供了有力的工具。化学遗传相比于其他技术的优势在于:①可长时间激活或抑制神经元活动;②非侵入性,操作简单,只需注射或喂食特异性药物即可,常规实验室就可达到;③安全性相对较高,在体内应用比较安全。随着技术不断发展,化学遗传的不足也显现出来:①化学遗传中药物发挥作用需要一定的时间,这就意味着对于神经元的控制难以精确到秒,尽管这种缓慢作用的药动学特点在研究简单的神经回路方面具有优势,但在研究复杂神经回路时缺乏精确的时间控制,且需要控制用药剂量,否则可能会导致精神不振、活动减少等并发症[15];②药物经代谢后作用减弱或消失,需反复注射,会对动物产生伤害,且配体长时间暴露会使受体脱敏[16]。
综上,化学遗传技术是一个强大的神经调节工具,可将其作为治疗手段治疗精神疾病。虽然化学遗传在应用上还有一些问题,但随着不断的改进与优化,这项技术一定会广泛应用于脑科学研究,为科研工作者带来新的惊喜。
2 光遗传技术
光遗传技术是将光学与遗传学技术结合,将光敏蛋白导入特定神经元细胞,利用光调控细胞活动的技术[17]。在特定波长的光照射下,光敏蛋白的构象发生改变,导致与之相互作用的蛋白解离或聚合,从而引发下游信号活动,如基因表达、酶与底物相互作用和神经元活化等[18]。
2.1 光敏蛋白的发展
光遗传于2005年由斯坦福大学的Deisseroth等[19]首次提出,他们将绿藻中提取的视紫红质通道蛋白2(channelrhodopsin-2,ChR2)导入哺乳动物神经元并能稳定表达,在光照下能够使神经元兴奋。
光敏蛋白的选择是该技术的关键。光敏蛋白种类繁多,通常由生色基团和效应蛋白构成,其特点是由较小的蛋白质或蛋白结构域构成,受到光照时能传递信号,并在光照停止后恢复到原来的构象[20]。光敏蛋白根据其作用可分为兴奋型、抑制型和控制G 蛋白偶联型[21],常见的主要有视紫红质、视黄质、光氧电压传感蛋白、核黄素蓝光受体、隐花色素、光敏色素[22]和紫外光受体8[23]等(表1)。除天然光敏蛋白,还有对离子通道蛋白进行改造的新光敏蛋白工具,这些离子通道的传导速度、激发光谱和光电敏感性等生物物理性质都不同,可满足不同的实验需求。Cosentino等[24]将植物的LOV2-Jα的感光模块与钾离子通道Kcv 融合,构建了感应蓝光的钾离子通道(表1)。Brown 等[25]将视紫红质进行拓扑反转产生了新的变体。新的光遗传工具仍在不断开发中。
2.2 光遗传技术在脑科学研究中的应用
光遗传对各类神经元的精确控制为神经环路和精神疾病的研究提供了新手段,同时其也是探索神经发育和神经发生机制的重要工具。2007年,Adamantidis 等[26]通过光遗传对特定的神经元进行光刺激,影响了动物的睡眠行为,使得该技术可进一步应用于探测复杂的神经行为(表1)。2011年有研究报道,对中央核基底外侧杏仁核的末端进行时间精确性光遗传学刺激,可引起急性、可逆的抗焦虑作用[27]。2013年,Kay团队利用光遗传学技术激活基底杏仁核-腹侧海马的投射增加了焦虑相关行为[28];同年,有研究通过在脑内植入电极和光纤,实时监测癫痫发作并给予光刺激进行治疗,将抑制性视蛋白在兴奋性神经元表达或兴奋性视蛋白在γ-氨基丁酸能神经元表达,均可控制癫痫的发生[29]。在小鼠中脑多巴胺能神经元转入光遗传病毒,可实现对神经元的瞬时双向控制(抑制或激发),进而双向调节(诱导或缓解)由慢性应激引起的抑郁症状[30]。
2.3 光遗传技术的优势和不足
光遗传技术的优势在于:①能够控制光照时间,从而使细胞功能控制精确到毫秒甚至微秒级别;②通过控制光的强度,可瞬时控制刺激强度;③脑注射特异性启动子可将光敏蛋白精确到某个细胞或细胞器,实现精准控制细胞活动,在清醒动物上具有时间精准性;此外,通过改造光敏蛋白已获得许多新的光遗传工具,选择多样。总的来说,光遗传的诞生让脑科学研究达到了前所未有的高度。
光遗传技术仍然存在一些不足,如光纤的插入会对脑组织造成一定损伤,长期植入后可形成机化包裹使光控强度减弱,并且动物的自由活动也会受到所连接光纤的限制,需要开发具有远程控制功能的无线光源植入物以降低侵入性[31];光敏蛋白的外源性高度表达可能会对细胞产生毒性等。
Hsueh 等[32]将视蛋白在心肌细胞中表达,并给小鼠体外安装微型LED 光源来诱导心脏节律,开创了对动物器官进行无创光遗传控制的策略,此研究结果发表在2023年Nature杂志上。相信通过不断改进,光遗传技术在脑科学研究和临床脑疾病治疗中将发挥更大作用。
3 磁遗传技术
磁遗传技术是将磁感应元件导入大脑特定区域,使其在特定神经元中表达,在外部磁场刺激下激活大脑特定区域。磁遗传技术为深部脑刺激带来了新机遇。
3.1 磁遗传相关感受器
多项研究表明,利用磁场作用于磁感应元件可达到对瞬时受体电位(transient receptor potential,TRP)离子通道门控效果[33]。TRP 通道广泛存在于从酵母到人类中,每个成员都有不同的功能和分布。该受体家族成员主要参与对刺激的感知,其中瞬时感受器电位香草酸亚型1(transient receptor potential vanilloid 1,TRPV1)离子通道是温度和痛觉感受器,TRPV4则对渗透压和机械刺激敏感[34]。
TRPV1 结合磁纳米粒或铁蛋白利用磁热效应可操控细胞活性。2012年,Stanley 等[35]利用磁热效应证明了磁性纳米颗粒可远程控制体内蛋白的合成(表1)。该技术利用包裹His 标签抗体的氧化铁纳米颗粒可与融合His 标签的TRPV1 通道蛋白特异性结合的特点,在465 kHz无线电磁波作用下,铁纳米颗粒产生的磁热效应使TRPV1 通道打开,引起细胞钙内流,并开启下游钙依赖的胰岛素基因表达。同样,Anikeeva 团队也通过磁性纳米颗粒在磁场下的热效应打开TRPV1,观察到HEK293细胞钙内流,还可激发神经元可逆性放电[36]。利用磁性纳米颗粒在磁场作用下热效应激活神经元,进而实现了对动物的行为控制[37]。2015年,Stanley 团队突破了外源纳米颗粒侵入性注射和纳米颗粒细胞内化后效果降低的局限性,将外源铁纳米颗粒换成了内源表达的铁蛋白,在电磁波刺激下利用磁热效应将铁蛋白连接的TRPV1 通道打开,促进了胰岛素的合成及分泌[38](表1)。在另一研究中,他们将TRPV1 通道的S6 区域引入突变,使其成为氯离子选择性通道,在磁热效应下抑制了葡萄糖感应神经元,从而降低血糖,提高胰岛素水平,并抑制进食[39]。
TRPV4 结合磁性纳米粒或铁蛋白利用磁力效应可操控细胞活性。Wheeler 等[40]构建并优化了TRPV4 通道与铁蛋白的融合蛋白,并命名为Magneto,在体外实验中验证了在磁场作用下铁蛋白通过磁力效应打开TRPV4通道,引起神经元动作电位发放,进一步的体内实验也证实,该策略能引起斑马鱼的自旋行为和调控小鼠的奖赏行为(表1)。本课题组也对磁遗传新策略进行了探索。通过His抗体修饰的磁性纳米颗粒特异结合在插入His 标签的TRPV4,从而靶向激活TRPV4 离子通道。激活的TRPV4 离子通道可引发神经元钙内流。此外,这种方法在自由移动的小鼠中得到了证实,可有效控制动物绕体轴旋转和步态冻结的行为[41]。
除以上2 种机制,2015年,Zhang 团队通过myo-3 和mec-4 启动子驱动IscA1基因在秀丽隐杆线虫的肌肉细胞和机械敏感神经元中特异性表达,引发了肌肉收缩和后退行为[42](表1);Xie研究组也证明了IscA1编码的蛋白具有磁感应功能,因此将此蛋白命名为磁受体蛋白(magnetic receptor,MagR)。MagR 与光感受器隐花色素组合形成杆状复合物,在磁场的作用下可发生旋转,因此该研究也将其称为“生物指南针”[43]。Li 等[44]设计合成了一种含铁的蛋白质晶体,每个晶体中都含有超过1000万个铁蛋白亚基,大大提高了矿化铁的量。当将晶体从细胞中分离并在体外加载磁铁时,晶体会向磁铁移动,证明了磁性蛋白组装的可能性。
3.2 对磁遗传技术的质疑
磁遗传技术在多项研究中已被证明是可发挥作用的,能以独特优势调控细胞活动,但同时也受到了来自多方的质疑。2016年,Meister[45]基于物理学理论对磁遗传技术的有效性提出质疑,认为实验中由磁场强度和频率产生的热量或力远远达不到打开离子通道的效果。对于MagR 的作用,也有人质疑单独的MagR不足以使细胞对加载的磁场做出反应[46],但原发现者认为,实验中未观察到阳性结果可能是质粒设计和表达效率所造成的。同时,作为新兴技术,磁遗传技术研究中的实验材料和仪器设备等也缺乏统一标准。2020年,Shen 研究团队将Magneto 在小脑浦肯野细胞表达,施加磁场后发现并没有改变浦肯野细胞的电活动[47]。而2019年,Barbic[48]提出氧化铁粒子在磁场作用下发生自旋产生的能量有可能打开离子通道实现磁感应效果。最近有研究对基于铁蛋白的磁遗传策略的实施方案进行了评估,从转染时间、温度、铁源和钙指示剂等方面进行测试,得出较为优化的实验方案,为磁遗传技术的有效应用提供了参考[49]。
磁遗传技术因其非侵入、作用迅速、重复性好的特点而倍受关注,磁遗传技术的提出无疑为脑科学研究工具的开发提供了新方向。对不同磁遗传策略发挥作用的分子机制还应进一步深入研究。
4 其他调控技术
化学遗传、光遗传和磁遗传技术可做到特定脑区指定类型神经元的操控,是脑核团环路功能研究中的常用工具。此外还有TES,TMS 和DBS 等物理调控技术在脑疾病的功能调控中发挥重要作用。TES 和TMS 技术的特点是从颅脑外非侵入性发送刺激信号,但脑区调控精准度有限。而DBS 需侵入性颅内植入电极,可达到脑区精准控制,但亦无法做到对指定类型细胞的操控。
4.1 经颅电刺激
TES 是一种非侵入的脑刺激技术,通过颅脑外粘贴电极将不同强度和频率的电流作用于特定脑区可改变神经元兴奋性,实现对大脑神经活动的调控,主要包括经颅直流电刺激(transcranial direct current stimulation,tDCS)和经颅交流电刺激(transcranial alternating current stimulation,tACS)。
tDCS 是利用低强度直流电(1~2 mA)调节大脑皮质神经元活动。直流电电极的负极可使神经元静息膜电位升高,产生超极化,降低神经元放电频率,产生抑制细胞活性的效果;反之,正极则使神经元发生去极化,增加神经元放电频率,从而激活细胞的活性。tDCS 已经成功应用于抑郁症和阿尔茨海默病等疾病的临床治疗[50-51]。tACS 是将有节律的正弦和双相交流电传递到目标脑区的神经元。目前其调节机制可能是通过同步脑波震荡进行,改变神经递质水平,长期诱导神经元突触可塑性,达到调节大脑功能和远期改善疾病临床症状的效果,临床用于强迫症、妄想和痴呆等疾病的治疗[52](表1)。
4.2 经颅磁刺激
TMS 于1985年由Barker 等[53]首次创立,是一种利用脉冲磁场无创穿透皮肤和颅骨作用于大脑中枢神经系统,改变大脑皮质神经细胞膜电位,使之产生感应电流,影响脑内代谢和神经电活动的磁刺激技术[54]。其基本原理是在线圈中通入脉冲电流,使线圈周围产生脉冲磁场,将其置于头部上方,脉冲磁场在头部产生感应电流可刺激相应的神经元。高频TMS可瞬间提高运动皮质兴奋性,而低频TMS 有抑制兴奋的作用[55]。TMS 是一种大脑皮质神经的无创性刺激技术,相对电刺激,该技术无需电极也不用直接接触人体,是一项无创、简便的技术,已广泛应用于疼痛、帕金森病和抑郁症等精神疾病的治疗[56](表1)。
4.3 深部脑刺激
DBS 是一种新兴的治疗脑部疾病的神经调控技术,其原理是通过脑立体定位手术将DBS 电极植入患者脑内特定区域,通过电刺激达到治疗疾病的目的[57],故有“脑起搏器”之称。该技术可根据患者病状特点设置不同参数,大多采用>100 Hz的高频电刺激,一般是130~180 Hz,相比于传统的物理方法该技术具有副作用小、可控、可逆的优点,在实施中患者一旦有不适即可停止,已被美国FDA 批准用于治疗帕金森病[58](表1)、肌张力障碍和原发性震颤。随着研究的深入,适应证已逐步扩展至强迫症、抑郁症和癫痫等疾病[59-60],DBS 已经在神经精神疾病的治疗中取得突破性进展。
4.4 经颅超声刺激
TUS 技术的原理是将超声连续波或脉冲波穿透颅骨作用于大脑组织,可调控特定神经元的活动。目前该技术的超声加载有2 种:高强度聚焦超声和低强度聚焦超声。高强度聚焦超声会产生高强度能量,对脑组织会造成不可逆的损伤,也会产生热量对其他部位造成伤害,所以目前研究较多的且更有效的是低强度聚焦超声[61]。超声刺激既可激活又可抑制神经活性,因此选择合适的刺激参数非常重要,目前推荐的中心频率为0.75~3 MHz。相比于TES 和TMS,TUS 具有更高的空间分辨率,穿透力更强,可刺激深部脑区。对于深部脑刺激,超声刺激可以做到无创,而目前该技术的作用机制尚不清楚,仍需进一步研究,但其无疑拥有巨大潜力[62-63](表1)。
5 结语
化学遗传、光遗传和磁遗传技术是研究大脑功能强有力的工具,都可通过病毒注射以及转基因动物实现特异性受体在脑目标核团的感兴趣类型神经元中表达[64-65]。然而化学药物起效延迟和光纤穿透组织的局限等问题也不容忽视。磁场可穿透组织和骨骼到达大脑的深部,且无需植入性手术就可控制大脑神经元的活化与失活,是更为有效且微创的方法[66]。未来磁遗传技术可针对磁感应元件的开发、实验设备和方案的标准化等方面进行优化[33]。如果能克服以上难题,那么磁遗传技术未来在脑科学上的应用也将更为深入和广泛,并有望用于临床疾病的治疗。TES,TMS,DBS 和TUS 等技术在临床脑疾病治疗中应用已获得良好效果。随着神经调控技术的研究不断发展壮大,研究人员在研究大脑结构和作用机制时有了更丰富的选择的同时,也将为脑疾病患者带来新的希望。
