Callispheres-TACE术联合信迪利单抗治疗不可切除肝细胞癌的有效性
2024-03-07张永红储建华陈国栋
张永红 储建华 陈国栋
肝细胞癌(HCC)是临床上常见且难治的一种恶性肿瘤,虽然目前已经达成了一些诊疗共识和规范,但流行病学调查显示[1],原发性肝癌的发病率和全因死亡率仍处于较高水平。HCC的侵袭性较高,多数患者在就诊时已经处于疾病中晚期,无法进行外科手术切除[2]。目前临床上对于不可手术切除的HCC首选肝动脉化疗栓塞(TACE)术治疗,Callispheres载药微球的TACE术可弥补传统TACE术的不足,能长效释药和彻底栓塞血管,但然而仍有部分患者在短期内进展,预后不佳[1, 3]。研究报道[4],肝脏具有特殊的免疫微环境,发生HCC时可导致肿瘤免疫逃逸,程序性死亡受体-1(PD-1)及其配体属最常见的免疫检查点,参与肿瘤细胞的免疫逃逸。信迪利单抗属于一种PD-1抑制剂,其可经阻断PD-1信号通路的作用,改善肝脏免疫微环境,抵抗肿瘤进展[5]。目前信迪利单抗已经广泛用于多种恶性肿瘤的治疗,但关于不可切除的HCC的报道较少。本研究将Callispheres-TACE术与信迪利单抗联合用于不可切除的HCC的治疗,探讨其应用有效性,为临床上治疗方案的选择提供参考。
资料与方法
一、一般资料
选取海安市人民医院肿瘤科2020年1月—2022年2月收治的不可手术切除的HCC患者110例,作为研究对象;采用随机数字表法分成观察组和对照组,各为55例。纳入标准:①根据病史、血清学和影像学检查,符合《原发性肝癌诊疗规范(2019版)》中的诊断标准[6];②疾病分期处于B或C期,无法行手术切除,预期生存期≥3个月,未接受过其他相关治疗。排除标准:①合并其他恶性肿瘤,腹腔或远处转移,肝性脑病、无法控制的大出血和顽固性腹水;②全身炎症性疾病,免疫性疾病;③资料不完整,失访等。观察组中男性30例,女性25例;年龄37~75岁,平均(61.49±6.24)岁;肿瘤分期B期27例,C期28例;ECOG评分为1分26例,2分29例;肝功能Child分级为A级20例,B级35例;肿瘤数目1~4枚,平均(2.65±0.97)枚;肿瘤最大直径5.2~11.5 cm,平均(6.98±2.04)cm;合并血管侵犯19例,肝硬化46例,乙型肝炎病毒(HBV)感染33例。对照组中男性28例,女性27例;年龄36~75岁,平均(61.38±6.27)岁;肿瘤分期B期31例,C期24例;ECOG评分为1分29例,2分26例;肝功能Child分级为A级22例,B级33例;肿瘤数目1~4枚,平均(2.61±0.94)枚;肿瘤最大直径5.0~11.6 cm,平均(6.95±2.06)cm;合并血管侵犯18例,肝硬化44例,乙型肝炎病毒(HBV)感染31例。两组一般资料比较无统计学意义(P>0.05),具可比性。该研究经患方知情同意和医学伦理审批。
二、研究方法
(一)治疗方法 (1)对照组:采用Callispheres-TACE术治疗,使用苏州恒瑞迦俐生生物医药公司蓝色型CalliSpheres载药微球,将1瓶载药微球与注射用盐酸表柔比星30~50 mg充分混合,30 min完成载药,静置5 min后备用。5F动脉鞘利用Seldinger法置入股动脉,根据肿瘤部位和血供情况将2.7F微导管超选择进入至供血动脉,连通载药微球的混合液、碘对比剂,经微导管脉冲式注射至病灶供血动脉内,对比剂流动停止时暂停栓塞,并行DSA观察病灶是否染色完全,直至病灶染色完全消失,即结束栓塞。栓塞完成后拔除导管鞘,止血、包扎伤口,术后下肢制动伸直6~12 h。每月1次,治疗3次。(2)观察组:在Callispheres-TACE术治疗后1周静脉滴注信迪利单抗(信达生物制药有限公司,国药准字S20180016),静脉滴注200 mg信迪利单抗,每3周静脉滴注1次,共治疗4次。
(二)观察指标 (1)与治疗前和疗程结束后,采集清晨空腹静脉血5 mL,预处理后采用酶联免疫吸附试验法(ELISA)测定血清甲胎蛋白(AFP)、糖类抗原242(CA242)和糖类抗原724(CA724)等肿瘤标志物,碱性成纤维细胞生长因子(bFGF)和血管内皮生长因子(VEGF)等肿瘤生长因子,以及增殖相关基因(C-myc)和成纤维细胞生长因子2(FGF2)等癌基因,细胞周期依赖性蛋白激酶抑制剂(P16)和铁凋亡蛋白(Hepcidin)等癌基因指标水平。试剂盒购自上海科培瑞生物科技公司,严格按照试剂盒说明书进行检测。(2)采集患者治疗前后3 mL清晨空腹静脉血,使用美国BD FACSAria Fusion 流式细胞仪检测CD3+、CD4+、CD8+和CD4+/CD8+等抗肿瘤免疫应答因子水平。
(三)疗效评价 (1)治疗结束后依据WHO实体瘤评价标准评价近期疗效,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD)。患者治疗结束后病灶完全消失并维持4周定义为CR;患者治疗结束后病灶减少50%以上并维持4周定义为PR;患者治疗结束后病灶减少25%或增大25%,但无新病灶形成定义为SD;病灶增加25%或者出现新的病灶定义为PD。客观缓解率(ORR)=(CR例数+PR例数)/总例数×100%。(2)统计治疗过程中所出现的不良反应。(3)治疗结束后通过门诊复诊或电话等形式,进行为期12个月的生存状况随访,统计无进展生存时间、总生存时间和生存率。
三、统计学方法
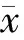
结 果
一、两组肿瘤标志物水平的比较
治疗前两组AFP、CA242和CA724水平比较无差异(P>0.05);治疗后两组的肿瘤标志物水平均较前下降,观察组低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 两组治疗前后内皮功能水平的比较
二、两组肿瘤生长因子水平的比较
治疗前两组bFGF和VEGF水平比较无差异(P>0.05);治疗后两组的肿瘤标志物水平均较前下降,观察组低于对照组,差异有统计学意义(P<0.05)。见表2。
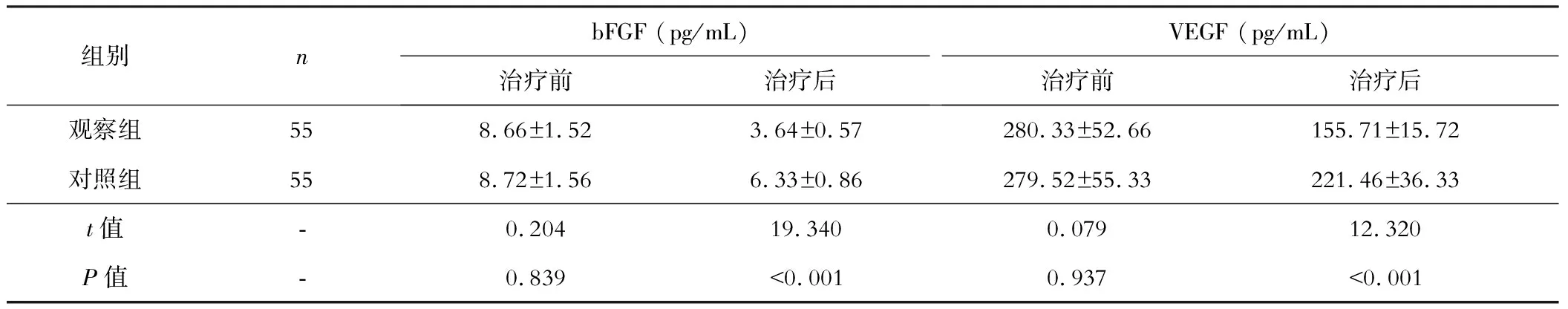
表2 两组治疗前后肿瘤生长因子水平的比较
三、两组抗肿瘤免疫应答因子水平的比较
治疗前两组CD3+、CD4+、CD8+和CD4+/CD8+水平比较无差异(P>0.05);治疗后两组的CD3+、CD4+和CD4+/CD8+水平较前升高,CD8+水平降低,观察组的改善幅度高于对照组,差异有统计学意义(P<0.05)。见表3。
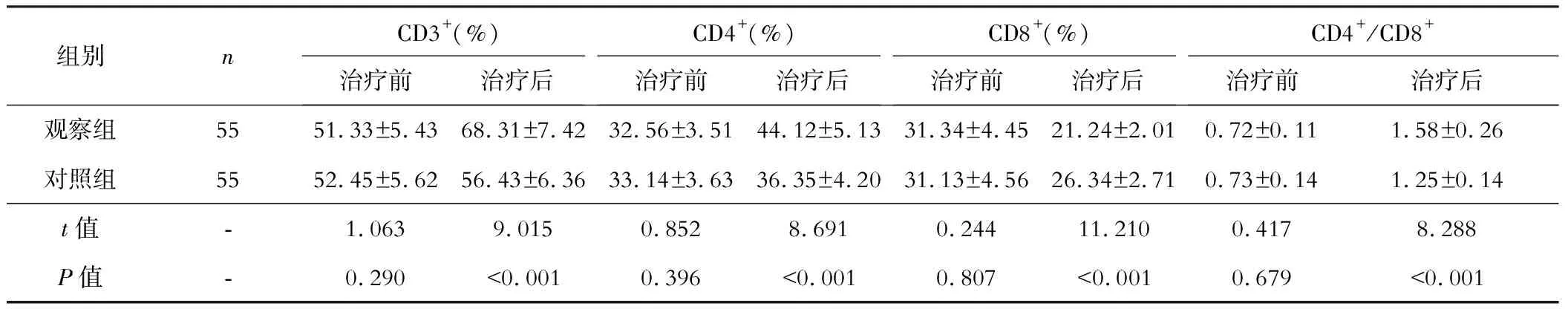
表3 两组治疗前后抗肿瘤免疫应答因子水平的比较
四、两组癌基因和抑癌基因水平的比较
治疗前两组癌基因C-myc、FGF2、抑癌基因P16、Hepcidin水平比较无差异(P>0.05);治疗后两组的C-myc和FGF2水平较前降低,P16和Hepcidin水平较前升高,观察组的改善幅度高于对照组,差异有统计学意义(P<0.05)。见表4。
五、两组近期疗效的比较
观察组ORR高于对照组,差异有统计学意义(P<0.05)。见表5。
表5 两组近期疗效的比较
六、两组不良反应的比较
两组不良反应发生率比较差异无统计学意义(P>0.05)。见表6。
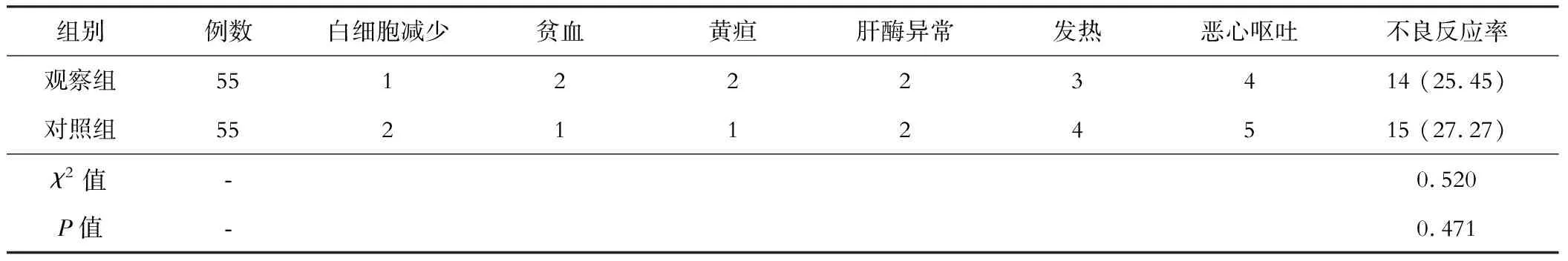
表6 两组不良反应的比较
七、两组生存状况的比较
两组患者均完成随访,无一例失访,观察组的中位无进展生存时间、中位总生存时间和12个月生存率均高于对照组,差异有统计学意义(P<0.05)。见表7和图1。

图1 两组生存状况曲线图
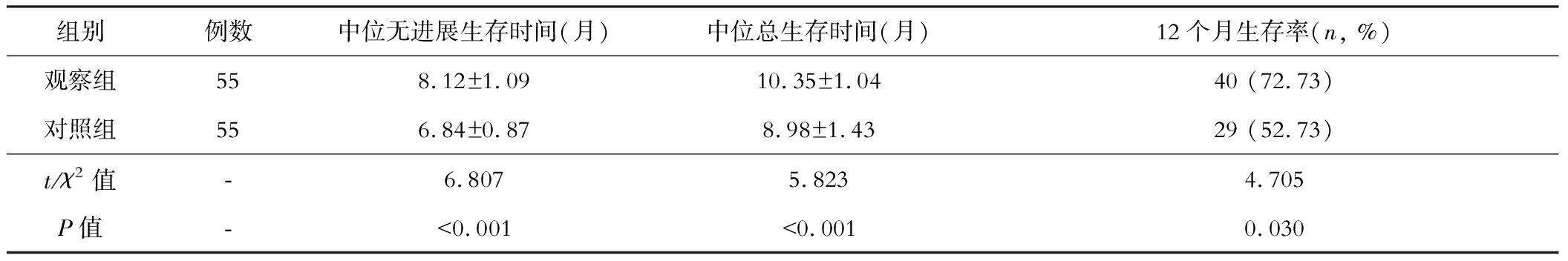
表7 两组生存状况的比较
讨 论
目前治疗不可切除HCC的首选方法为TACE术,可阻断肿瘤血供而抗肿瘤进展,但在临床应用中发现,术中使用的碘油栓塞剂在药物释放期间稳定性不足,且由于肿瘤供血动脉模式的差异,沉积的碘油栓塞剂极易流失,导致供血血管再通[7]。Callispheres载药微球相比传统碘油栓塞剂载药稳定性明显提高,在稳定载药的基础上缓慢释药延长药物作用时间,可较彻底栓塞肿瘤血供动脉,抑制肿瘤生长[8-9]。Callispheres载药微球由聚乙烯醇构成,结构较稳定,在微导管内可变小压缩,当其释放至靶血管后即可恢复至自身形态,可永久性地栓塞远端分支血管[10]。宋文等[11]报道,Callispheres-TACE术可明显控制肝癌患者肿瘤进展。谢璇丞等[12]研究同样证实,Callispheres-TACE术治疗中晚期肝癌效果理想。本研究结果显示,不可切除的HCC患者在接受Callispheres-TACE术治疗后肿瘤标志物水平显著降低,肿瘤生长明显被抑制,提示Callispheres-TACE术治疗不可切除的HCC有效,与上述报道结果一致。
目前免疫治疗是恶性肿瘤的新型治疗方法之一,其可刺激免疫应答,诱导肿瘤细胞凋亡,从而发挥作用,其中以PD-1为代表的免疫检查点抑制剂应用最为广泛,整体效果较理想[13]。信迪利单抗作为一种免疫检查点抑制剂,在结合PD-1后阻断PD-1信号传导,激活机体抗肿瘤免疫活性,诱导效应T细胞浸润至病灶内,诱发强抗肿瘤免疫应答[5, 14]。杨建奇等[15]研究发现,在HCC患者使用仑伐替尼的基础上使用信迪利单抗效果理想,可明显抑制肿瘤生长,提高临床疗效。本研究结果显示,在HCC患者使用Callispheres-TACE术的基础上联合信迪利单抗的近期疗效更显著,肿瘤生长因子bFGF、VEGF明显被抑制,生存周期明显延长,有效性较高,与李利珍等[16]的研究结果一致。
正常状态下,机体T淋巴细胞亚群CD4+、CD8+表达平衡,具有维持机体免疫的作用,但当肝细胞癌变后,患者免疫功能损伤,CD4+、CD8+分泌失衡,CD3+分泌减少,免疫损伤后肿瘤细胞免疫逃逸,疾病快速进展[17-18]。本研究结果显示,加用信迪利单抗治疗的HCC患者抗肿瘤免疫应答因子表达异常明显被纠正,结果验证了信迪利单抗的抗肿瘤免疫应答作用,分析其原因可能与信迪利单抗激活T淋巴细胞活性,增强HCC患者机体免疫能力进而提高抗肿瘤效应有关。
随着临床对HCC的研究发现,其发生进展过程中癌基因、抑癌基因明显突变,一般情况下两者含量正常,但当两者在机体内突变、失活、失衡后诱导肿瘤形成[19]。C-myc和FGF2均属于癌基因,其中C-myc可将信号从细胞外向传导至细胞核内,参与病灶形成和发展[20]。P16和Hepcidin均属于抑癌基因,P16在肿瘤形成后合成减少,是较常见的抑癌基因,其活性降低是肿瘤细胞增殖过度的重要机制[21]。Hepcidin主要由肝细胞分泌,对机体铁代谢具有调节作用,HCC患者机体内铁含量明显增加,因此临床认为Hepcidin可能是HCC的抗肿瘤防御机制的一部分[22]。本研究结果显示,HCC患者治疗后癌基因C-myc和FGF2表达水平降低,抑癌基因P16和Hepcidin表达水平升高,且观察组的表达改变更为显著,结果说明,Callispheres-TACE术联合信迪利单抗具有阻碍肿瘤进展的作用,具有表现为癌基因表达降低,抑癌基因表达升高。
综上所述,Callispheres-TACE术联合信迪利单抗可抑制病灶生长、改变癌基因和抑癌基因表达失衡,从而延长不可切除的HCC患者生存周期,提高近期疗效,值得在临床推广。
利益冲突声明:所有作者均声明不存在利益冲突。
