食管癌多倍体肿瘤巨细胞DNA定量分析
2024-03-07张国栋任旖琳
张国栋,任旖琳,王 卫
食管癌是全球第六大常见的癌症死亡原因,患者预后较差,5年生存率仅为15%~25%[1]。近年来,多倍体肿瘤巨细胞(polyploid giant cancer cells, PGCCs)在恶性肿瘤研究中被重新重视,病理医师在日常工作中常发现肿瘤组织中含有单个巨大的细胞核或多个细胞核的瘤巨细胞。Fei等[2]将细胞核体积与二倍体肿瘤细胞核的比例≥3的癌细胞定义为PGCCs。PGCCs促进实体肿瘤的异质性,具有肿瘤干细胞(cancer stem cells, CSCs)的特征[3]。PGCCs的数量通常随着病理分级和分期程度的增高而增加[3-5]。CSCs具有自我更新和多能分化的能力,以促进癌症进展和化疗耐药[6]。CD133是食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)CSCs的标志物[7],ESCC中CD133的中位阳性率为31.9%(21%~44.2%),CD133+ESCC患者的5年总生存率仅为1.27%(0.93%~1.73%)[8]。CD133+肿瘤细胞和PGCCs均与肿瘤的恶性进展相关,目前有关CD133+肿瘤细胞与PGCCs关系的相关研究报道较少,因此本文将重点分析CD133+CSCs与PGCCs DNA含量之间的关系,探究定义PGCCs DNA含量的阈值。
1 材料与方法
1.1 细胞培养人ESCC细胞系TE-1和KYSE-150购自德国生物材料资源中心(Deutsche Sammlung von Mikroorganismen und Zellkulturen, DSMZ)。细胞系用含10%胎牛血清、100 U/mL青霉素和100 μg/mL链霉素的RPMI-1640培养液,在37 ℃、5%CO2恒温培养箱中培养。
1.2 PGCCs诱导TE-1细胞置于10 cm培养皿中培养,当细胞密度达90%时,加入300 nmol/L紫杉醇(M1970,Abmole公司)培养24 h,然后撤销紫杉醇,更换培养基,继续培养至第9天获得TE-1-PGCCs。
1.3 细胞块制作TE-1对照细胞和紫杉醇处理细胞分别消化,离心富集,在10%中性福尔马林中固定12 h。按照细胞块制备试剂盒(净优,北京赛普九洲公司)说明书制作细胞块,后经脱水、浸蜡、包埋制作成石蜡细胞块。
1.4 免疫细胞化学染色将制成的石蜡细胞块4 μm厚切片,二甲苯脱蜡,梯度乙醇水化,EDTA高温抗原修复,随后按照通用两步法检测试剂盒(小鼠/兔增强聚合物法检测系统)(货号PV-9000,北京中杉金桥公司)实验步骤操作:内源性过氧化物酶阻断,一抗CD133(稀释比1 ∶100)、CD44(稀释比1 ∶100)和c-Myc(稀释比1 ∶100)4 ℃孵育过夜(均购自Proteintech公司),滴加反应增强剂,滴加HRP标记的抗小鼠/兔IgG聚合物室温孵育1 h,DAB染色。
1.5 磁珠分选CD133+肿瘤细胞分别计数2×107个TE-1和KYSE-150细胞与CD133微珠(货号130-097-049,Miltenyi公司)4 ℃孵育15 min,离心后弃上清液。细胞和磁珠被重悬并转移至分离柱(货号130-042-201,Miltenyi公司),安装在MACS分离器上(miniMACS,货号130-042-102)。用普通缓冲液洗涤获得CD133-细胞(未结合磁珠),用洗脱缓冲液洗涤获得CD133+细胞(结合磁珠)。
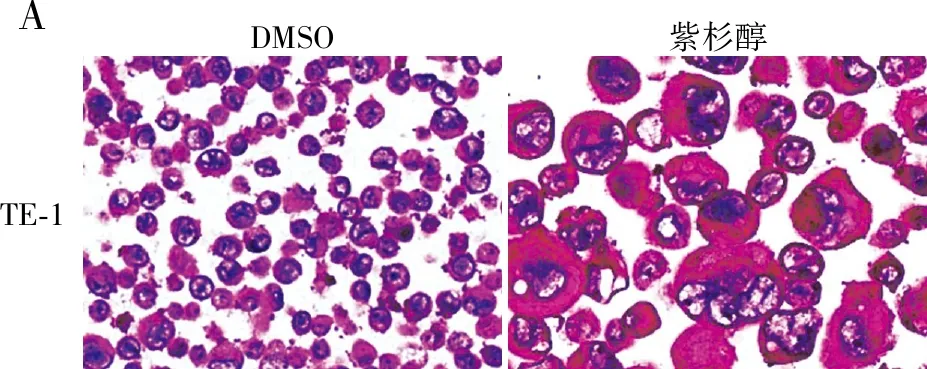
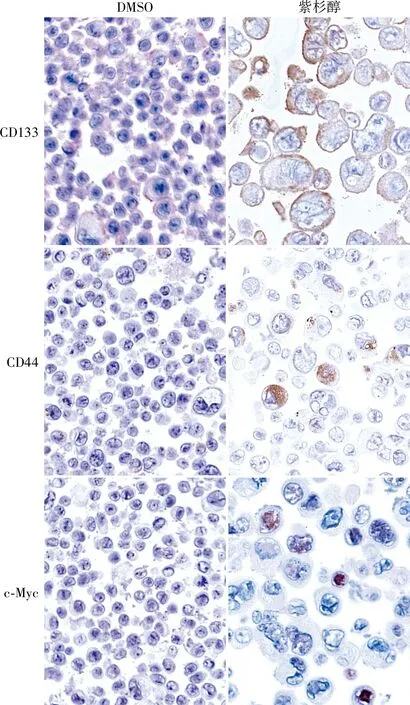
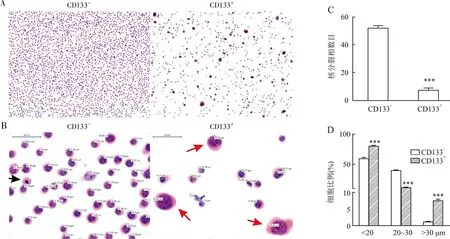
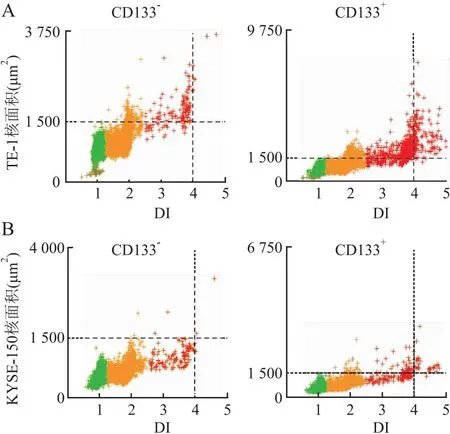
1.6 细胞DNA定量分析分选获得的TE-1-CD133+、TE-1-CD133-、KYSE-150-CD133+、KYSE-150-CD133-细胞采用Liquid-Prep液基(厦门麦克奥迪医疗诊断公司)方法固定,滴片制成薄片,行Feulgen染色。所有Feulgen染色片用MotiCytometer全自动细胞DNA定量图像分析系统进行扫描处理。定义扫描细胞数量为25 000,以标本中二倍体细胞作为内参照,并根据100多个参数特征值对被测细胞核进行自动分类和计数,其中DNA指数(DNA Index, DI)为关键参数,可表示DNA含量。DI计算方法:被测细胞的积分光密度(IOD)与二倍体细胞IOD的比值。如为二倍体细胞(N,染色体组的数量,作为单倍体基因组的倍数:1N是单倍体的精子或卵细胞染色体含量,2N是二倍体细胞的染色体含量),DI值为1±0.25;当1.25 1.7 统计学分析采用SPSS 16.0软件对所有数据进行统计学分析,两组间差异采用T检验分析,以P<0.05为差异有统计学意义。 2.1 紫杉醇诱导食管癌细胞产生PGCCs验证采用紫杉醇处理TE-1细胞诱导产生的TE-1-PGCCs经HE染色显示,PGCCs细胞体积明显大于对照组细胞(图1A);DNA定量分析显示,与对照组细胞相比,紫杉醇处理的细胞中≥5N亚群的比例显著增加,而≤2N和2N~4N细胞亚群的比例显著降低(P<0.000 1,图1B);进一步观察DI分布发现,紫杉醇诱导的细胞在DI≥4(≥8N)细胞亚群中显著富集,对照组细胞也有少量≥8N细胞(图1C),表明普通培养细胞中也存在一定数量的≥8N肿瘤细胞,这提示定义PGCCs DNA含量的最小数值可能是8N。 图1 紫杉醇诱导食管癌细胞产生PGCCs验证:A.HE染色显示TE-1-DMSO细胞和紫杉醇诱导的TE-1-PGCCs体积大小;B.细胞DNA定量分析每个亚群中的细胞比例;C.细胞DNA定量分析不同DI细胞亚群的分布,每个“+”代表1个细胞;***P<0.000 1 2.2 PGCCs中CD133、CD44、c-Myc蛋白的表达免疫细胞化学染色检测CSCs标志物CD133、CD44和c-Myc蛋白表达水平,结果显示:TE-1-PGCCs高表达CD133,对照细胞弱表达CD133;部分TE-1-PGCCs高表达CD44和c-Myc,对照细胞则不表达CD44和c-Myc(图2)。上述结果提示紫杉醇诱导的PGCCS高表达CSCs标志物,尤其是CD133。 DMSO紫杉醇CD133CD44c-Myc 2.3 CD133+和CD133-亚群细胞的形态学特征将采用CD133磁珠分选获得的TE-1-CD133+细胞和TE-1-CD133-细胞分别行Feulgen染色,结果显示:与TE-1-CD133-组相比,PGCCs主要富集于TE-1-CD133+组(图3A)。CD133-细胞的有丝分裂相明显多于CD133+细胞(P<0.000 1,图3B、C),说明CD133-细胞的增殖能力强于CD133+细胞。与CD133-细胞相比,CD133+细胞含有更多的(直径<20)小核或大核(直径>30 μm)细胞,而中等大小核(直径20~30 μm)细胞数量显著低于CD133-组(图3D)。 图3 CD133-和CD133+食管癌的细胞特征:A.低倍视野广泛分布PGCCs(500 μm);B.高倍视野有丝分裂细胞(黑箭头),红箭头示PGCCs(50 μm);C.低倍视野下细胞有丝分裂相数量(5个随机视野),***P<0.000 1;D.低倍视野中不同核直径细胞的比例(5个随机视野),***P<0.000 1 2.4 CD133+和CD133-亚群细胞DNA含量特征细胞DNA定量分析显示,TE-1-CD133+和KYSE-150-CD133+中富集了DI≥4(≥8N)的PGCCs,而TE-1-CD133-和KYSE-150-CD133-细胞中几乎不存在这种多倍体细胞(图4)。本组结果提示,在ESCC中PGCCs(特别是≥8N的PGCCs)是CSCs的一个特殊亚群。 图4 细胞DNA定量分析:A.TE-1-CD133-和TE-1-CD133+细胞亚群的DNA定量分析;B.KYSE-150-CD133-和KYSE-150-CD133+细胞亚群的DNA定量分析;DI=1(2N)为二倍体,DI=2(4N)为四倍体,DI=4(8N)为八倍体 细胞多倍体化是由发育程序或应激诱导的,产生于细胞融合或细胞内复制的过程,内复制过程是细胞完成DNA复制后,不能完成胞质分裂或完全不进入M期[9]。多倍体现象在人类癌症中较常见,PGCCs在多种癌症中被发现,数量相对较少(5%~20%)[10]。在约37%的人类肿瘤中观察到PGCCs,在化、放疗和CoCl2模拟低氧环境下,PGCCs的数量可能显著增加。在癌症治疗中,大多数基因毒性药物可导致基因组休克和细胞体积增大,从而导致基因组复制和PGCCs形成。虽然PGCCs长期被忽略,但最近其被认为是引发癌症、耐药和转移的罪魁祸首,PGCCs中核异型性的产生也是病理诊断中最重要的癌症标志[11]。PGCCs基因组拷贝数增加,更适应缺氧微环境和各类应激,并通过无丝分裂更高效地产生子代细胞,这些机制可以共同工作,促进肿瘤快速恶性生长[12]。 PGCCs表达多种干细胞标志物,如胚胎干细胞标志物OCT4、NANOG、SOX2和YAP及某些CSCs标志物CD133、CD44等[3-4, 12-13],PGCCs与人类胚胎发生于早期的卵裂球高度相似,如果把肿瘤起源的第二条途径(PGCCs途径)与人类生命周期联系起来,可将体细胞去分化经PGCCs形成的未分化肿瘤称为卵裂球样(性)肿瘤[3]。本实验发现,紫杉醇诱导的TE-1-PGCCs高表达CSCs标志物CD133。未经紫杉醇处理的TE-1细胞中也含有少量的PGCCs,这部分PGCCs主要富集在CD133+细胞亚群,进一步对CD133+细胞进行DNA定量分析,发现八倍体(8N,相当于4个正常细胞核)及以上PGCCs几乎完全富集在CD133+细胞亚群,提示≥8N的PGCCs是CSCs。 在另一项研究中,作者也发现PGCCs主要分布在鼻咽癌细胞CNE2-CD133+亚群,且分散在小细胞中,而CD133-细胞大小较为均一[14],本组在食管癌中观察到的结果与之一致,提示这是在肿瘤中普遍存在的现象。PGCCs通过两种不对称分裂(非有丝分裂)方式产生子细胞:出芽和破裂,可以单独或一起发生,随后产生大量小体积的子代细胞[4]。卵巢癌HEY细胞的研究显示,肿瘤出芽中的HEY-PGCCs高表达CD133和CD44,表明这些出芽的细胞具有CSCs样特性[4],由于子细胞的数量远超PGCCs,这可能解释了CSCs的体积可以很小(子代细胞)或很大(PGCCs),但以小体积细胞为主。 Feulgen染色是一种DNA定量染色方法,染色强度与DNA浓度呈正比,通过测定染色细胞核的IOD来计算细胞核DNA含量,用DI来表示DNA含量。细胞DNA定量分析采用全自动数字扫描结合AI细胞识别和深度学习算法对细胞核中的DNA含量或染色体倍数进行定量检测和分析,来判断是否存在癌变或癌前病变的风险,同时为肿瘤的恶性程度提供参考依据。细胞DNA定量分析作为一种成熟的病理技术,已广泛用于子宫颈脱落细胞的辅助诊断[15]。然而,当前仍主要通过细胞/细胞核等形态特征定义PGCCs。 综上,本实验通过分析食管癌细胞DNA含量、CSCs和PGCCs三者之间的关系,首次发现八倍体及以上的PGCCs是一类CD133+CSCs。这一发现可能为定义PGCCs提供了一个DNA含量的参考,也为开发靶向PGCCs治疗肿瘤提供新思路。2 结果
3 讨论