注重背景病变
——胃增生性息肉的诊断思考
2024-03-07叶菊香石雪迎
叶菊香,石雪迎,王 晔
胃增生性息肉是常见的良性上皮性病变,病变特征为胃小凹延长扭曲、腺体囊性扩张、间质水肿伴炎症细胞浸润。胃增生性息肉多发生于慢性胃炎或胃黏膜损伤的基础之上[1],可继发反应性增生、异型增生,甚至恶变,也可以有多种其他疾病表现出类似增生性息肉的形态。关注临床病史和内镜表现,细致观察息肉背景病变,有利于更准确地判断患者疾病,为临床提供更多的诊断信息。本文通过介绍3例胃增生性息肉样病变,以梳理诊断思路。
例1女性,38岁,无明显诱因间断性上腹痛2年。既往史:3个月前神经内科诊断“周围神经病,缺铁性贫血”。胃镜检查提示胃底隆起,癌变?慢性浅表性胃炎伴糜烂。行内镜黏膜下剥离术(ESD)切除胃底隆起。眼观:胃黏膜中央可见一灰红色隆起,大小1.7 cm×1 cm×1 cm,切面灰白、灰红色,实性,质脆、糟碎。镜检:息肉中央区域腺体上皮中-重度异型增生,局灶可见复杂乳头分支,腺管不规则,腺腔内可见坏死(图1A、B),周边区域腺体增生,上皮富含黏液,无明显异型性,间质水肿伴少量炎细胞浸润(图1C、D),这些形态改变符合增生性息肉伴重度异型增生,局灶呈高分化腺癌。标本取自胃底,但息肉周围黏膜未见胃底腺,可见幽门腺样腺体,局灶伴肠上皮化生,黏膜肌上方固有层内可见多灶小团神经内分泌细胞增生(图1E、F),组织学形态提示自身免疫相关性慢性萎缩性胃炎。本例(胃底息肉)ESD标本最终病理诊断:胃增生性息肉伴重度异型增生,局灶癌变呈高分化腺癌。周围胃黏膜呈重度慢性萎缩性胃炎伴幽门腺化生、轻度肠上皮化生和神经内分泌细胞微结节状、腺瘤样增生。结合患者存在周围神经病和贫血,高度提示自身免疫相关性慢性萎缩性胃炎,请结合临床相关检查进一步确诊。
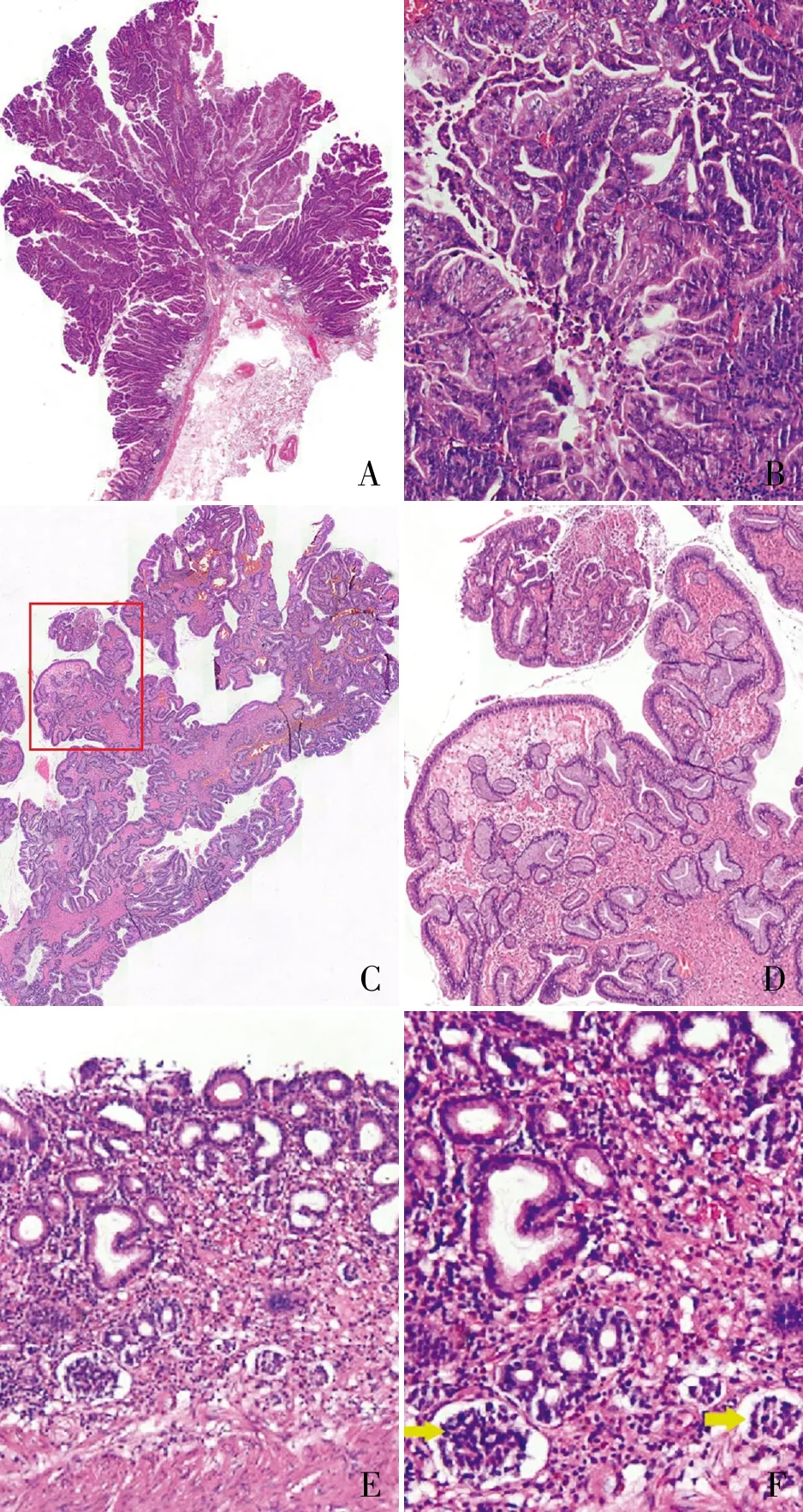
ABCDEF
由于自身免疫相关性慢性萎缩性胃炎患者血清中存在抗壁细胞抗体和抗内因子抗体,一方面可导致胃黏膜壁细胞减少或消失,胃酸分泌减少;另一方面导致内因子减少,进而影响小肠吸收维生素B12,维生素B12缺乏既能影响红细胞生成而发生恶性贫血,又可导致神经细胞的损伤和退变而出现神经系统症状。增生性息肉好发于萎缩性胃炎的背景上,本例患者由于存在明显的胃癌特征,易造成诊断医师忽视增生性息肉的背景病变,从而遗漏能解释导致患者贫血和外周神经病的真正原因,即隐藏在背景黏膜中的自身免疫相关性慢性萎缩性胃炎。另外自身免疫相关性慢性萎缩性胃炎患者胃酸分泌减少,反馈性刺激胃窦胃泌素的分泌,而胃泌素可刺激胃底和胃体肠嗜铬样(ECL)细胞增生,因此神经内分泌细胞的增生不仅提示自身免疫相关性慢性萎缩性胃炎的线索之一[2-3],还提示患者需定期内镜随访监测可能发生的I型胃神经内分泌肿瘤。
例2女性,50岁,上腹部不适2年,加重1个月。胃镜检查发现胃多发息肉样隆起,以胃底体部为著(图2A)。2次活检标本镜下均表现为胃小凹增生、扭曲,部分扩张,固有膜间质可见多量慢性炎症细胞浸润,形态符合胃增生性息肉(图2B、C),部分区域上皮细胞有异型性,符合低级别管状腺瘤,部分区域腺体异型性明显,符合乳头状管状腺癌(图2D)。后行手术切除。胃切除标本镜下可见多发增生性息肉样病变(图3A、B),部分区域腺体有异型性,多灶癌变(图3C),部分区域可见增生上延至固有膜近腔面的黏膜肌(图3D)。结合患者内镜和影像学表现,考虑Peutz-Jeghers(P-J)息肉可能。追问患者病史,曾于外院行结肠镜检查示“多发息肉”,查体皮肤黏膜未见色素沉着。对肿瘤组织和正常组织行STK11/LKB1基因测序检测,结果显示存在STK11/LKB1基因第8外显子胚系错义突变:NM_000455: c.1062C>G(p.F354L)(图4)。最终病理诊断:胃多发P-J型错构瘤性息肉,多灶癌变呈中分化管状腺癌、印戒细胞癌。结合基因突变检测结果,符合P-J综合征。
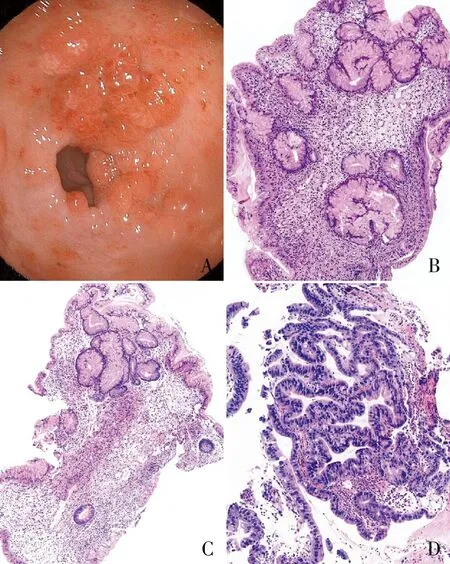
ABCD
P-J综合征为常染色体显性遗传性疾病,约75%的P-J综合征患者存在LKB1基因突变。患者胃肠道可发生多发错构瘤性息肉,发生胃肠道癌和其他器官系统肿瘤的风险明显增加,确诊后需定期筛查[4-5]。P-J息肉多见于空肠,其次为回肠、结肠、直肠、胃和十二指肠。典型的P-J息肉呈圣诞树样外观,由增生的上皮和叶脉样穿插其中的平滑肌束组成。胃P-J息肉远不如肠道多见,且形态也不典型,在小活检标本中很难发现增生穿插的平滑肌束,多以炎性水肿间质为主,与增生性息肉形态基本一致。如果未能发现内镜下息肉密集多发的形态特点,就有可能仅凭镜下形态特征简单诊断为增生性息肉,而未能提醒临床有存在遗传肿瘤综合征的可能,需要我们进一步工作来确诊(如深部大块活检、行肠镜检查或分子检测),从而造成患者的诊断延迟。
例3男性,58岁,纳差半年。腹部超声检查发现胃壁增厚2个月。胃镜检查发现胃、十二指肠多发息肉,黏膜弥漫不平。胃镜多处活检标本镜下表现相似:(齿状线下隆起、底体交界隆起、窦大弯隆起、窦后壁隆起)胃黏膜间质高度水肿,少量淋巴单核细胞和嗜酸性粒细胞浸润,部分小凹增生、延长、扭曲、扩张(图5A~C),形态符合增生性息肉。临床查体发现患者头发稀少,双手指甲营养不良、质脆,色素沉着,结合内镜所见,怀疑Cronkhite-Canada综合征(CCS)。进一步行小肠、结肠检查:小肠造影示空肠黏膜颗粒不平。肠镜示结肠多发息肉。腹部CT示胃壁明显增厚,胃、结肠多发结节状突起。辅助检查:白蛋白29 g/L,尿蛋白(-),肝功能正常。肠镜活检标本镜下可见大肠黏膜隐窝增生延长、排列不规则,间质水肿伴淋巴浆细胞、嗜酸性粒细胞和中性粒细胞浸润,形态类似肠道幼年性息肉,但在息肉周边相对平坦的黏膜中亦可见囊性扩张的腺体(图5D~F)。最终结合内镜和临床表现,诊断为Cronkhite-Canada综合征。患者行激素治疗后症状好转。

ABCDEF
CCS是一种极为罕见的非遗传性疾病,病因不明,部分研究者认为该病的发生与自身免疫有关,患者预后差,5年生存率为55%。典型的临床表现为蛋白丢失性肠病和外胚层改变(如毛发丢失、指趾甲营养不良)。内镜下可见胃肠道弥漫性息肉样病变,息肉广基、无蒂;上消化道可见弥漫性黏膜增厚。临床治疗方式包括抗生素、激素和手术等。患者罹患肿瘤的风险不确定。需内镜下监测,治疗后不能消退的息肉则可在内镜下切除[6-7]。发生于胃的CCS息肉镜下形态类似增生性息肉,表现为胃小凹增生/腺体囊性扩张,间质水肿,明显的单核淋巴细胞浸润,可有嗜酸性粒细胞,发生于结肠的CCS息肉形态则类似幼年性息肉,部分体积较大者可因继发脱垂性改变导致黏膜肌层增生上延,类似P-J息肉。但与胃增生性息肉和肠道幼年性息肉不同的是CCS息肉广泛弥漫分布,且息肉之间相对平坦部位的黏膜活检亦可见囊性扩张的腺体。因此,临床发现患者具有典型的外胚层改变和内镜下表现怀疑CCS时,应对息肉和息肉间背景黏膜均取活检进行镜下观察。
综上,增生性息肉是组织损伤后的一种炎性增生性反应,是胃内常见的息肉类型之一,可以发生于胃内任何部位,可在日常工作中经常遇到。1%~20%的增生性息肉可继发异型增生并可进一步进展为癌变,特别是当息肉最大径>1 cm时,需与息肉表面糜烂时腺体的反应性增生鉴别,p53免疫组化染色可协助诊断[8-9]。近年来,异型增生和早期癌诊断知识的普及使大多数病理医师对此类改变保持高度警惕,不易遗漏,但对这种常见息肉的背景病变和临床表现(息肉多发,伴有贫血、消化道症状或其他器官系统体征等)的关注可能存在不足。作者对以上3例进行总结分析,发现多种疾病发生的胃息肉(包括上文未提及的幼年性息肉病)均可能表现为增生性息肉样形态[10],如果仅仅关注息肉本身或大家通常比较警惕的增生性息肉继发的异型增生或癌,就有可能导致我们丢失重要的背景基础病变诊断线索,造成患者重要相关疾病的漏诊或延迟诊断。病理医师在诊断增生性息肉这一胃内最常见的息肉类型时,切勿因病变常见而掉以轻心,应养成了解临床病史和内镜信息的良好工作习惯,同时注意镜下观察肿瘤或瘤样病变以外的背景黏膜,必要时采用分子检测等辅助检查协助做出更精确的诊断,才能让每一块送检组织的价值得到充分体现。