大半夏汤提取物对食管癌EC9706细胞恶性生物学行为及JAK1/STAT3通路的影响*
2024-03-07马燕凌叶子豪魏武杰孙建海
马燕凌 叶子豪 晏 菲 魏武杰 李 黎 刘 莉 孙建海
(江汉大学附属湖北省第三人民医院,湖北 武汉 430000)
食管癌是起源于食管内任何部位的消化系统恶性肿瘤,预后较差,造成了极大的公共卫生负担。目前以外科为主的综合治疗是食管癌的主要治疗措施,但仍无法获得满意的治疗效果,5年生存率不及25%[1]。近年来中医药在恶性肿瘤的治疗方面获得了认可。食管癌属于中医学“噎膈”范畴,中医理论认为噎膈病机为痰瘀互结,致食道狭窄,病久则耗伤精血,以致血枯津涸,因此行气散结、降逆化痰为治疗之法[2]。大半夏汤出自《金匮要略》,有开结降逆、化痰理气之功。王克穷等[3]以“益气化痰和胃”理论为依据,使用大半夏汤治疗食管癌等病症,效果显著,但关于食管癌治疗的具体机制仍未明确。酪氨酸蛋白激酶1(JAK1)/信号转导和转录激活因子3(STAT3)是由细胞因子刺激的信号转导通路,在细胞的生长、分化、凋亡及免疫调节等生命活动中有重要作用。研究发现,JAK/STAT3 信号转导通路介导人食管癌微环境下未成熟树突状细胞内皮样分化[4]。亦有研究认为JAK/STAT3信号转导通路影响食管癌细胞的增殖、侵袭和凋亡[5],但关于大半夏汤干预食管癌的分子机制是否与JAK/STAT3信号转导通路有关仍未明确。故此,本研究以STAT3 信号通路抑制剂Stattic 作为阳性对照,以离体培养的人食管癌EC9706 细胞作为实验对象,探索大半夏汤通过STAT3信号通路干预食管癌EC9706细胞增殖的分子机制,为其临床应用提供实验依据。
1 材料与方法
1.1 试剂与仪器
人食管癌EC9706细胞(中科院上海细胞库)、大半夏汤参照《金匮要略》组方:生半夏260 g,人参45 g,白蜜126 g。药材均购自河南张仲景大药房股份有限公司,并经鉴定为真品;酪氨酸蛋白激酶抑制剂(Stattic)购于美国Sigma 公司;二甲基亚砜(DMSO)购于南京医科大学;RPMI1640 培养基购于美国GIBCO 公司;小牛血清购于杭州四季青生物工程材料有限公司;JAK1、STAT3抗体、磷酸化JAK1(p-JAK1)、磷酸化STAT3(p-STAT3)抗体购自美国Cell Signaling Technology 公司,Trizol RNA 抽提试剂盒购自北京索宝来科技有限公司。E-Gel Imager 凝胶成像仪购自美国Invitrogen 公司,M500 荧光显微镜购自美国Thermo 公司、CO2培养箱购自赛默飞世尔科技中国有限公司、HaierHXC-158型低温冰箱购自青岛海尔股份有限公司,8 μm Transwell小室购自美国康宁公司。
1.2 实验方法
1.2.1 药物制备 大半夏汤药物混合后加入乙酸乙酯提取。水浴加热至85 ℃之后回流提取4 h,少冷却后减压蒸馏,去除溶剂,获得的浓缩物经低温减压干燥至干浸膏状(含水量<10%),以二甲基亚砜(DMSO)充分溶解,配置为100 mg/mL 原液,经0.22 μm 过滤、灭菌,保存于-20 ℃备用。
1.2.2 细胞培养 食管癌EC9706 细胞培养于10%胎牛血清的RPMI1640 培养基,常规条件培养(5% CO2,37 ℃),细胞单层贴壁后经胰酶消化重悬培养传代,2~3 d传代1次,取对数生长期细胞进行实验。
1.2.3 MTT 法检测大半夏汤提取物、Stattic 对EC906细胞增殖影响 大半夏汤提取物(200、100、50、25、12.5 μg/mL)、Stattic(4、3.5、3、2.5、2 μmol/L)使用RPMI1640 稀释。EC9706 细胞以1×108/L 密度接种于96孔板中,培养至细胞贴壁后,分别加入各浓度药物,每个浓度设置5 个复孔,再次孵育48 h,每孔加入MTT 溶液20 μL,继续培养3 h,丢弃MTT 溶液,加DMSO 溶液150 μL,震荡后使用酶标仪检测570 nm 处吸光度(OD值),计算不同浓度半夏汤提取物、Stattic溶液对EC906细胞的抑制率,抑制率=(实验组OD 值-对照组OD值)÷实验组OD值×100%,曲线拟合计算大半夏汤提取物、Stattic的IC50值。
1.2.4 细胞分组及干预 对数生长期食管癌EC9706细胞以1×106个接种于6 孔板,常规条件培养于含10%胎牛血清RPMI1640 培养基,分为大半夏汤组、Stattic组、大半夏汤+Stattic 组及空白对照组。大半夏汤组、Stattic 组分别给予大半夏汤提取物、Stattic 浓度为IC50值浓度;大半夏汤+Stattic 组给予含大半夏汤提取物和Stattic IC50值浓度;空白对照组未做特殊处理。
1.2.5 MTT法检测细胞增殖能力 参照“1.2.3”检测各组细胞培养48 h OD值,OD值越高表示细胞活性越高。
1.2.6 划痕实验检测细胞迁移能力 各组转染48 h后的细胞消化后洗涤,继续在无血清培养基中培养,细胞几乎长满后,弃培养基,以10 μL枪头划线,PBS轻柔冲洗,于显微镜下记录划痕宽度(0 h),继续培养24 h后弃培养液,再次经PBS轻柔冲洗,显微镜下拍照记录划痕宽度(24 h),以Image-ProPlus6.0 计算划痕愈合率。
1.2.7 Transwell实验检测各组GES-1细胞侵袭能力吸取各组细胞100 μL 接种于8 μm 孔径含有液态Matrigel基质胶的小室上室,下室加入10%FBS的培养基中,继续常规条件下培养24 h,24 h 后PBS 洗涤、甲醛固定,1%结晶紫染色,显微镜下(400 倍)随机选取5个视野拍照计算细胞侵袭数目。
1.2.8 qRT-PCR 法检测 Trizol 试剂盒提取总RNA,逆转为cDNA,使用TB GreenTMPremix Ex TaqTMⅡ,以cDNA 为模板进行qRT-PCR 为反应液配置。扩增,进行预变性、变性、退火和延伸(条件:95 ℃、3 min,95 ℃、5 s,60 ℃、30 s、72 ℃、30 s),40个循环,单样品设3个复孔,U6、GAPDH 为内参,紫外线下观察电泳结果,以2-ΔΔct法计算目的基因相对表达量。
1.2.9 Western blotting 法检测 各组细胞弃培养液,加入细胞裂解液裂解,1 400 r/min 离心5 min,离心半径30 cm,取上清,BCA 法检测蛋白浓度,SDS-PAGE电泳,转膜,TBST 稀释蛋白一抗,室温下封闭孵育2 h,二抗稀释后室温下孵育1 h,进行化学发光反应,暗室中显影、定影,经凝胶成像系统分析目的蛋白相对表达量。
1.3 统计学处理
2 结 果
2.1 大半夏汤提取物、Stattic 对食管癌EC9706细胞的抑制率
见表1。不同浓度的大半夏汤提取物、Stattic 对EC9706 细胞的抑制率比较,差异有统计学意义(P<0.05),随着干预浓度的增加,抑制率明显增加(P<0.05)。拟合细胞抑制率-浓度曲线,结果显示大半夏汤提取物与Stattic 的曲线拟合优度结果均为优(R2=0.957、0.961),达到标准,其IC50值分别为98.50 μg/mL、3.82 μmol/L。
表1 不同浓度大半夏汤提取物、Stattic对食管癌EC9706细胞的抑制率比较(%,±s)

表1 不同浓度大半夏汤提取物、Stattic对食管癌EC9706细胞的抑制率比较(%,±s)
注:与12.5 μg/mL 及2 μmol/L 比较,*P <0.05;与25 μg/mL 及2.5 μmol/L 比较,#P <0.05;与50 μg/mL 及3 μmol/L 比较,△P <0.05;与100 μg/mL及3.5 μmol/L比较,▲P <0.05。
抑制率12.33±2.01 15.20±2.80 22.55±3.50*#46.33±5.00*#△56.20±6.00*#△▲大半夏汤提取物12.5 μg/mL 25 μg/mL 50 μg/mL 100 μg/mL 200 μg/mL抑制率20.02±3.50 25.33±4.50 36.42±5.30*#54.50±6.00*#△65.33±7.80*#△▲Stattic 2 μmol/L 2.5 μmol/L 3 μmol/L 3.5 μmol/L 4 μmol/L
2.2 各组细胞增殖情况比较
见表2。与空白对照组比较,大半夏汤组、Stattic组、大半夏汤+Stattic 组的OD 值均更低(P<0.05);与Stattic 组和大半夏汤组比较,大半夏汤+Stattic 组的OD值更低(P<0.05);Stattic 组与大半夏汤组的OD 值比较,差异无统计学意义(P>0.05)。
表2 各组细胞增殖情况比较(±s)

表2 各组细胞增殖情况比较(±s)
注:与空白对照组比较,*P <0.05;与Stattic组比较,#P <0.05;与大半夏汤组比较,△P <0.05。下同。
OD值1.20±0.40 0.80±0.25*0.70±0.20*0.40±0.10*#△组 别空白对照组Stattic组大半夏汤组大半夏汤+Stattic组n5555
2.3 各组细胞迁移能力比较
见表3。与空白对照组比较,大半夏汤组、Stattic组、大半夏汤+Stattic 组的迁移率更低(P<0.05);与Stattic 组及大半夏汤组比较,大半夏汤+Stattic 组的迁移率更低(P<0.05);Stattic 组与大半夏汤组的迁移率比较,差异无统计学意义(P>0.05)。
表3 各组细胞迁移率比较(%,±s)
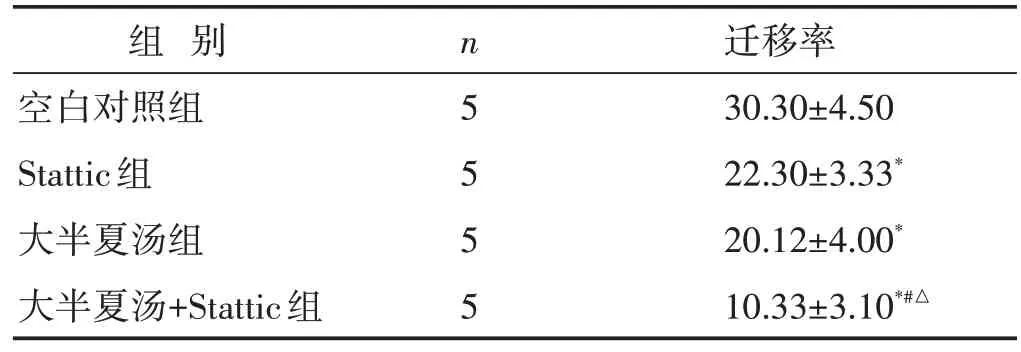
表3 各组细胞迁移率比较(%,±s)
组 别空白对照组Stattic组大半夏汤组大半夏汤+Stattic组n5555迁移率30.30±4.50 22.30±3.33*20.12±4.00*10.33±3.10*#△
2.4 各组细胞侵袭能力比较
见表4。与空白对照组比较,大半夏汤组、Stattic组、大半夏汤+Stattic 组的侵袭数量更低(P<0.05);与Stattic 组及大半夏汤组比较,大半夏汤+Stattic 组的侵袭数量更低(P<0.05);Stattic 组与大半夏汤组的侵袭数量比较,差异无统计学意义(P>0.05)。
表4 各组细胞侵袭能力比较(个/视野,±s)

表4 各组细胞侵袭能力比较(个/视野,±s)
组 别空白对照组Stattic组大半夏汤组大半夏汤+Stattic组n5555侵袭数量200.02±30.50 150.33±20.20*140.45±22.00*100.01±15.50*#△
2.5 各组细胞JAK1 mRNA、STAT3 mRNA表达情况比较
见表5。与空白对照组比较,大半夏汤组、Stattic组、大半夏汤+Stattic 组的JAK1 mRNA、STAT3 mRNA表达量更低(P<0.05);与Stattic组及大半夏汤组比较,大半夏汤+Stattic 组的JAK1 mRNA、STAT3 mRNA 表达量更低(P<0.05);Stattic 组与大半夏汤组的JAK1 mRNA、STAT3 mRNA 表达量比较,差异无统计学意义(P>0.05)。
表5 各组细胞JAK1 mRNA、STAT3 mRNA表达比较(±s)
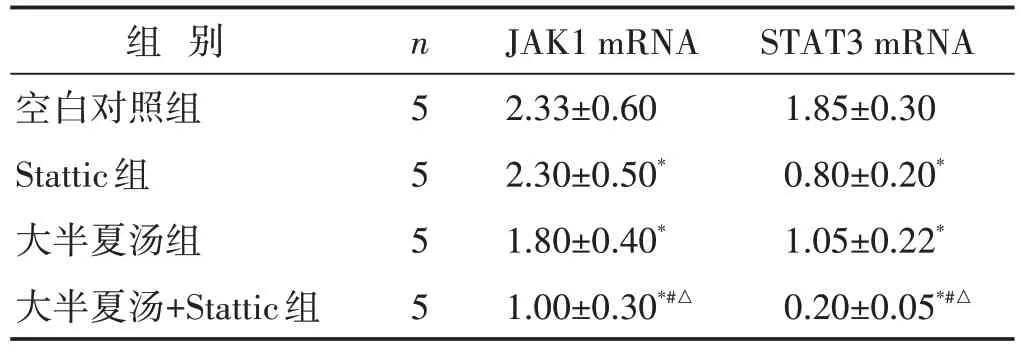
表5 各组细胞JAK1 mRNA、STAT3 mRNA表达比较(±s)
组 别空白对照组Stattic组大半夏汤组大半夏汤+Stattic组n5555 JAK1 mRNA 2.33±0.60 2.30±0.50*1.80±0.40*1.00±0.30*#△STAT3 mRNA 1.85±0.30 0.80±0.20*1.05±0.22*0.20±0.05*#△
2.6 各组细胞JAK1、STAT3蛋白表达比较
见表6、图1。与空白对照组比较,大半夏汤组与大半夏汤+Stattic 组p-JAK1 蛋白表达量更低(P<0.05);与大半夏汤组比较,大半夏汤+Stattic 组p-JAK1蛋白表达量更低(P<0.05)。与空白对照组比较,Stattic 组、大半夏汤组、大半夏汤+Stattic 组的p-STAT3 蛋白表达量更低(P<0.05);与Stattic 组及大半夏汤组比较,大半夏汤+Stattic 组的p-STAT3 蛋白表达量更低(P<0.05)。各组JAK1 与STAT3 蛋白表达量比较,差异无统计学意义(P>0.05)。
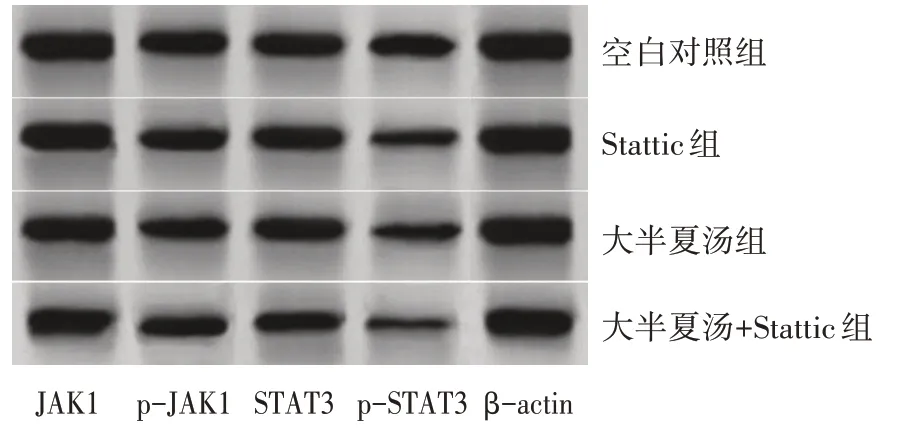
图1 各组细胞JAK1、STAT3蛋白表达条带
表6 各组细胞JAK1、STAT3蛋白表达比较(±s)
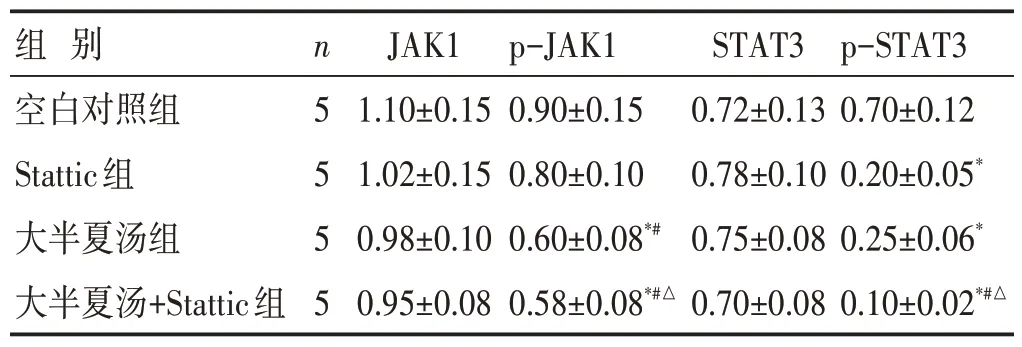
表6 各组细胞JAK1、STAT3蛋白表达比较(±s)
组 别空白对照组Stattic组大半夏汤组大半夏汤+Stattic组n5555 JAK1 1.10±0.15 1.02±0.15 0.98±0.10 0.95±0.08 p-JAK1 0.90±0.15 0.80±0.10 0.60±0.08*#0.58±0.08*#△STAT3 0.72±0.13 0.78±0.10 0.75±0.08 0.70±0.08 p-STAT3 0.70±0.12 0.20±0.05*0.25±0.06*0.10±0.02*#△
3 讨 论
国际癌症研究结果显示,2018 年全球食管癌的发病率和死亡率分别达到了3.2%和5.3%,全世界每年约有30 万人死于食管癌[6]。我国是食管癌高发地区,2019年中国肿瘤登记年报显示,我国2015年的食管癌发病率为24.6 万,发病率为17.8%,居于恶性肿瘤的第6 位,死亡率为18.8 万例,居于恶性肿瘤的第4 位[7]。中国食管癌负担分析显示,从1990 至2019 年,我国的食管癌疾病负担得到有效控制,但因人口老龄化的加重,食管癌的防治仍面临重大挑战[8]。近年来对食管癌的研究有了一定进展,西医联合中医药治疗的综合疗法成为食管癌治疗方式的主流。通过中医药的参与治疗,在提高治疗效果、减少手术及放化疗副作用、提高患者生存质量方面有明显获益。
本研究以大半夏汤提取物干预食管癌EC9706 细胞,发现能够抑制食管癌EC9706 细胞的增殖,且其作用具有浓度依赖性,计算抑制率-拟合曲线,以IC50浓度大半夏汤提取物干预食管癌EC9706细胞后,OD值、细胞迁移率、侵袭数量均降低,说明大半夏汤可抑制食管癌EC9706细胞的增殖、迁移和侵袭。大半夏汤主治胃反(反酸、恶心、呕逆、消化不良等症),近年来将其应用于恶性肿瘤化疗呕吐及肿瘤晚期恶液质的治疗中获得了较满意的效果[9-10]。大半夏汤药物组成为生半夏、人参及白蜜,方中半夏入脾胃及肺经,能降逆止呕、消痞散结、燥湿化痰,为止呕之要药;蜂蜜归脾、肺及大肠经,可补中缓急、润燥、解毒;人参可大补元气、生津安神。以上药物合用达到补中益气、降逆化痰、消痞散结的功效。药理研究表明,人参能增强人体免疫力、清除氧自由基,并有抗肿瘤的作用[11-12]。半夏中的有效物质可抑制延脑呕吐中枢控制呕吐[13],熊常州等[14]研究显示,半夏的KEGG 信号通路富集涉及癌症通路、肿瘤蛋白多糖、PI3K/Akt 信号通路、癌症的MicroRNAs、癌症中的转录失调和化学致癌等信号通路,并认为半夏可能通过调控信号通路、增强化疗药物敏感性和抗化疗耐药等方面来抑制肿瘤的发生、增殖、侵袭和转移,诱导肿瘤细胞凋亡,从而起到防治肺癌的作用。白蜜中含有多酚化合物、有机酸、酶、蛋白质、类黄酮、抗菌肽等成分,有消炎、杀菌、抗氧化、抗肿瘤、逆转耐药细菌对抗生素的抗性及中度抗肿瘤和显著抗肿瘤转移作用[15-16]。上述研究证实了大半夏汤具有良好的抗癌作用。
癌症的发生与多种信号通路参与细胞生长的调节异常,导致细胞过度增殖有关。研究发现,在人类肿瘤、心血管疾病及恶性白血病中JAK-STAT 信号通路的异常持续激活,且其蛋白水平可作为疾病检测指标[17]。STAT3 是一类具有调节细胞增殖、分化及免疫反应等功能的转录因子,为JAK-STAT 信号途径中的一个关键性转录因子,可介导细胞的恶性转化,并参与肿瘤的增殖、分化、血管生成、侵袭转移和免疫逃避等生理功能的调控。研究发现,活化STAT3 蛋白在细胞质中接受细胞因子和生长因子的刺激而活化,活化后的STAT3蛋白随后进入细胞核中与相应的下游靶基因位点相结合,从而引起下游靶基因的异常表达,促进细胞增殖和恶性转化[18]。本研究中发现STAT3 抑制剂干预Stattic 作用食管癌EC9706 细胞后,细胞的抑制率上升,OD 值、细胞迁移率、侵袭数量均下降,说明抑制JAK1/STAT3 通路能抑制食管癌的生长。此外本研究中经大半夏汤干预后的JAK1、STAT3 mRNA 及蛋白相对表达量均下降,且大半夏汤与Stattic 联合干预组的JAK1、STAT3 mRNA 及蛋白相对表达量下降更为明显,证实大半夏汤对食管癌的抑制作用与对JAK1/STAT3信号通路的抑制作用有关。
综上所述,大半夏汤提取物能抑制食管癌EC9706细胞的侵袭、转移和增殖,其机制可能与抑制JAK1/STAT3 通路的激活有关。本研究的不足之处在于,中药汤剂大半夏汤的抑癌过程中涉及多个活性、多个作用靶点及信号通路,本研究对经典的JAK1/STAT3通路进行探讨,后续仍需进一步深入研究其他信号通路及作用靶点,为食管癌的治疗提供更多的参考。
