苍术酮通过调节Nrf2-NLRP3通路减轻LPS诱导的小鼠急性肺损伤实验研究*
2024-03-07陈天阳李鹏程郑佳萍金源源
陈天阳 李鹏程 严 佳 郑佳萍 金源源 成 扬 王 倩
(上海中医药大学附属曙光医院,上海 210203)
急性肺损伤(ALI)及其更严重的形式急性呼吸窘迫综合征(ARDS)是由各种原因所导致的肺组织结构发生特征性病理改变而出现的临床综合征,其主要由败血症、胰腺炎、多发性创伤、肺炎或吸入有害气体等引发[1-2]。氧化应激是体内许多疾病始发的关键因素,机体内氧化还原反应调节失衡是众多疾病的病理生理基础。核因子NF-E2相关因子(Nrf2)氧化应激通路中最重要的调节因子之一,在应对各种细胞应激时从细胞质释放并转位到细胞核,发挥抗炎及抗损伤、抑制氧化应激反应与调节细胞凋亡等作用[3-4]。NLRP3炎性小体作为先天免疫系统的重要组成部分,在抗感染宿主防御中具有重要作用,而其异常激活与ALI 的发生发展密切相关[5]。
苍术酮是从中药苍术中分离出的倍半萜类化合物,作为苍术的主要成分之一,具有抗肿瘤、降血压、抗炎镇痛、抗氧化、保肝、抗流感病毒、除螨等作用[6]。课题组前期研究发现,苍术酮对ALI 具有保护作用[7-8]。本研究通过构建LPS诱导ALI小鼠模型,使用不同剂量苍术酮处理后,测定相关指标,旨在从Nrf2-NLRP3 信号通路揭示苍术酮对ALI小鼠的保护作用机制,为苍术酮在临床上治疗ALI提供实验依据。现报告如下。
1 材料与方法
1.1 实验动物
SPF 级雄性C57BL/6 小鼠48 只,6~8 周龄,体质量(22±3)g,购自浙江维通利华实验动物技术有限公司,动物合格证编号:SCXK(浙)2019-0001。饲养于上海中医药大学实验动物中心。本实验遵循3R保护原则,经上海中医药大学伦理委员会批准,批准号:PZSHUTCM2303200003。
1.2 试药与仪器
苍术酮(源叶,纯度≥85%),地塞米松(源叶),LPS(上海碧云天)、白细胞介素-1β(IL-1β)(江莱生物)、白细胞介素-6(IL-6)(ABclonal)和肿瘤坏死因子-α(TNF-α)(上海碧云天),白细胞介素-10(IL-10)(ABclonal),谷胱甘肽过氧化物酶(GSH-Px)(源叶),丙二醛(MDA)(索莱宝Solarbio),超氧化物歧化酶(SOD)(源叶),抗髓过氧化物酶抗体(MPO)(士锋生物),Trizol 裂解和提取试剂盒(上海Biotechnology 公司),cDNA 合成试剂盒(大连Takara 公司),实时定量PCR仪(美国ABI,StepOne Plus)。
1.3 分组与给药
48 只小鼠随机分为6 组:对照组、模型组、地塞米松组及苍术酮低、中、高剂量组,每组各8 只。地塞米松组以10 mg/kg 灌胃,苍术酮低、中、高剂量组分别按10、20、40 mg/kg 灌胃,正常组和模型组以等量生理盐水灌胃,连续7 d。
1.4 模型制备
给药7 d 后进行造模,造模前24 h 禁食不禁水。第7 天当天灌胃2 h 后实验组予以气管内注射LPS(10 mg/kg)造模6 h,正常组注射相同容量的生理盐水。
1.5 标本采集与检测
1.5.1 ELISA 检测肺泡灌洗液中炎症因子 取小鼠肺泡灌洗液[9],并按试剂盒说明书进行白细胞介素-1β(IL-1β)、IL-6和TNF-α含量的检测。
1.5.2 ELISA检测血清中炎症因子 离心小鼠血清,按试剂盒说明书进行IL-1β、IL-6、IL-10和TNF-α水平检测。
1.5.3 肺湿干质量比的测定 取肺组织,除去右肺上叶组织的水分和部分血液后称量,记为W,再将其置于60 ℃的恒温烘箱中烘干至恒重称量,记为D。计算湿/干质量比值(W/D)。
1.5.4 肺组织MPO 表达检测 剪取适量肺组织,置于预冷过的玻璃组织匀浆器中,在冰浴上制成5%匀浆液,按照相关说明书操作步骤检测MPO表达。
1.5.5 肺组织GSH-Px、MDA、SOD 测定 取适量右肺组织剪碎后匀浆、离心,并收取上清液按照试剂盒说明书检测GSH-Px、MDA、SOD水平。
1.5.6 肺组织病理学 取小鼠右肺下叶,4%多聚甲醛溶液固定、石蜡包埋,切片厚度为5 μm,根据流程进行脱蜡及水化,然后进行HE染色,在光学显微镜下观察。拍照肺泡壁厚度、肺组织破坏、炎症细胞浸润情况进行评分[10]。
1.5.7 RT-qPCR检测 肺组织中Nrf2、HO-1、NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA 取适量右肺组织于灭菌的离心管中,根据说明书使用Trizol 法提取总RNA,使用PrimeScriptRTReagent Kit 进行cDNA 合成,使用SYBRPremixExTaq 进行荧光定量PCR 实验。本研究使用的特异性引物由上海生工公司合成,见表1。PCR 反应体系为20 μL,步骤为预变性95 ℃30 s,PCR反应(95 ℃5 s,60 ℃20 s,40 个循环),使用2-ΔΔct法检测mRNA表达水平。

表1 RT-qPCR指标引物序列表
1.6 统计学处理
2 结 果
2.1 各组小鼠肺泡灌洗液中炎症因子水平比较
见表2。与对照组相比,模型组IL-1β、IL-6 和TNF-α 含量显著升高(P<0.05);与模型组相比,地塞米松组及苍术酮低、中、高剂量组IL-1β、IL-6 和TNFα 含量显著降低(P<0.05);苍术酮高剂量组与地塞米松组比较,差异具有统计学意义(P<0.05)。
表2 各组小鼠肺泡灌洗液中炎症因子水平比较(pg/mL,±s)
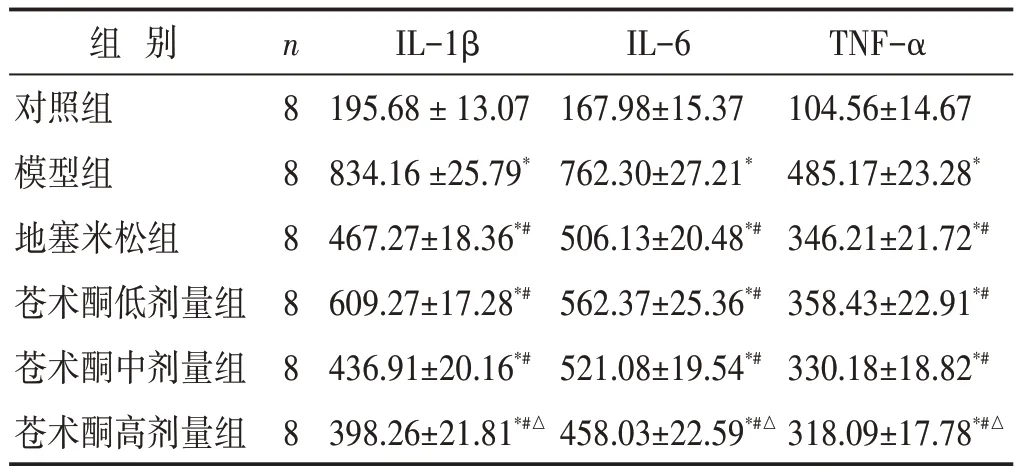
表2 各组小鼠肺泡灌洗液中炎症因子水平比较(pg/mL,±s)
注:与正常组比较,*P <0.05;与模型组比较,#P <0.05;与地塞米松组比较,△P <0.05。下同。
组 别对照组模型组地塞米松组苍术酮低剂量组苍术酮中剂量组苍术酮高剂量组n888888 IL-1β 195.68±13.07 834.16±25.79*467.27±18.36*#609.27±17.28*#436.91±20.16*#398.26±21.81*#△IL-6 167.98±15.37 762.30±27.21*506.13±20.48*#562.37±25.36*#521.08±19.54*#458.03±22.59*#△TNF-α 104.56±14.67 485.17±23.28*346.21±21.72*#358.43±22.91*#330.18±18.82*#318.09±17.78*#△
2.2 各组小鼠血清中炎症因子水平比较
见表3。与对照组相比,模型组IL-1β、IL-6 和TNF-α 水平显著升高(P<0.05),IL-10 水平显著降低(P<0.05);与模型组相比,地塞米松组及苍术酮低、中、高剂量组IL-1β、IL-6 和TNF-α含量显著降低(P<0.05);IL-10 水平显著升高(P<0.05);苍术酮高剂量组与地塞米松组比较,差异具有统计学意义(P<0.05)。
表3 各组小鼠血清中炎症因子水平比较(pg/mL,±s)

表3 各组小鼠血清中炎症因子水平比较(pg/mL,±s)
组 别对照组模型组地塞米松组苍术酮低剂量组苍术酮中剂量组苍术酮高剂量组n888888 IL-1β 19.26±4.29 78.49±11.33*40.12±8.16*#58.02±9.39*#46.62±7.83*#35.29±8.04*#△IL-6 12.45±3.02 51.26±7.29*39.37±5.53*#41.92±6.32*#34.07±4.72*#30.56±4.34*#△TNF-α 6.14±1.34 21.46±4.27*14.70±3.01*#16.72±3.20*#14.29±2.87*#10.36±2.69*#△IL-10 4.78±1.27 1.61±0.82*2.78±0.91*#2.17±0.89*#2.80±1.02*#3.33±1.16*#△
2.3 各组小鼠肺组织病理学及评分
见表4。与模型组相比,地塞米松组及苍术酮组肺泡壁毛细血管扩张充血减轻,肺泡间隔增宽减少,肺泡腔水肿减少,炎症细胞浸润减少,见图1。与对照组比较,模型组、地塞米松组及苍术酮低、中、高剂量组肺组织病理评分明显提高(P<0.05),与模型组比较,地塞米松组及苍术酮低、中、高剂量组病理评分降低(P<0.05)。
表4 各组病理评分、W/D、MPO水平比较(±s)
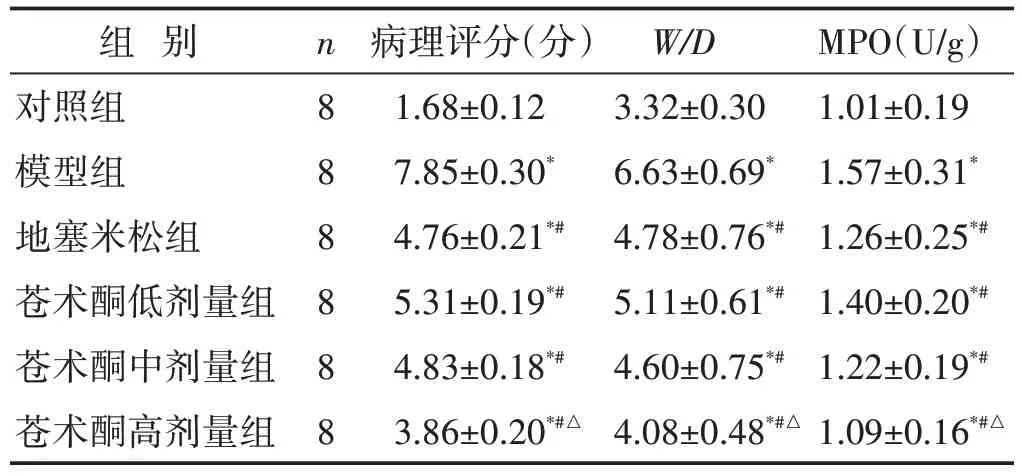
表4 各组病理评分、W/D、MPO水平比较(±s)
组 别对照组模型组地塞米松组苍术酮低剂量组苍术酮中剂量组苍术酮高剂量组n888888病理评分(分)1.68±0.12 7.85±0.30*4.76±0.21*#5.31±0.19*#4.83±0.18*#3.86±0.20*#△W/D 3.32±0.30 6.63±0.69*4.78±0.76*#5.11±0.61*#4.60±0.75*#4.08±0.48*#△MPO(U/g)1.01±0.19 1.57±0.31*1.26±0.25*#1.40±0.20*#1.22±0.19*#1.09±0.16*#△
2.4 各组小鼠肺组织W/D和MPO水平比较
见表4。与对照组相比,模型组W/D、MPO 显著升高(P<0.05);与模型组相比,地塞米松组及苍术酮低、中、高剂量组W/D、MPO 显著降低(P<0.05);苍术酮高剂量组W/D、MPO 与地塞米松组比较,差异具有统计学意义(P<0.05)。
2.5 各组小鼠肺组织中GSH-Px、MDA、SOD水平比较
见表5。与对照组相比,模型组MDA 水平显著升高(P<0.05),GSH-Px、SOD 水平显著降低(P<0.05);与模型组相比,地塞米松组及苍术酮低、中、高剂量组MDA 含量显著降低(P<0.05);GSH-Px、SOD 水平显著升高(P<0.05);苍术酮高剂量组与地塞米松组差异具有统计学意义(P<0.05)。
表5 各组小鼠肺组织中GSH-Px、MDA、SOD水平比较(U/g,±s)

表5 各组小鼠肺组织中GSH-Px、MDA、SOD水平比较(U/g,±s)
组 别对照组模型组地塞米松组苍术酮低剂量组苍术酮中剂量组苍术酮高剂量组n888888 GSH-Px 122.53±20.13 71.82±18.54*93.27±19.37*#89.68±17.09*#97.56±19.20*#108.43±21.73*#△MDA 1.86±0.17 3.59±0.49*2.58±0.26*#2.61±0.23*#2.45±0.21*#2.27±0.15*#△SOD 50.06±4.21 19.67±3.89*39.15±2.83*#31.12±3.65*#40.72±3.45*#45.98±3.76*#△
2.6 各组小鼠肺组织中Nrf2、HO-1、NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA表达比较
见表6。与对照组相比,模型组NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA 水平显著升高(P<0.05),Nrf2、HO-1水平显著降低(P<0.05);与模型组相比,地塞米松组及苍术酮低、中、高剂量组NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA 含量显著降低(P<0.05);Nrf2、HO-1 mRNA水平显著升高(P<0.05);苍术酮高剂量组与地塞米松组比较,差异具有统计学意义(P<0.05)。
表6 各组小鼠肺组织Nrf2、HO-1、NLRP3、Caspase-1、ASC、IL-1β、IL-18 mRNA表达水平比较(±s)
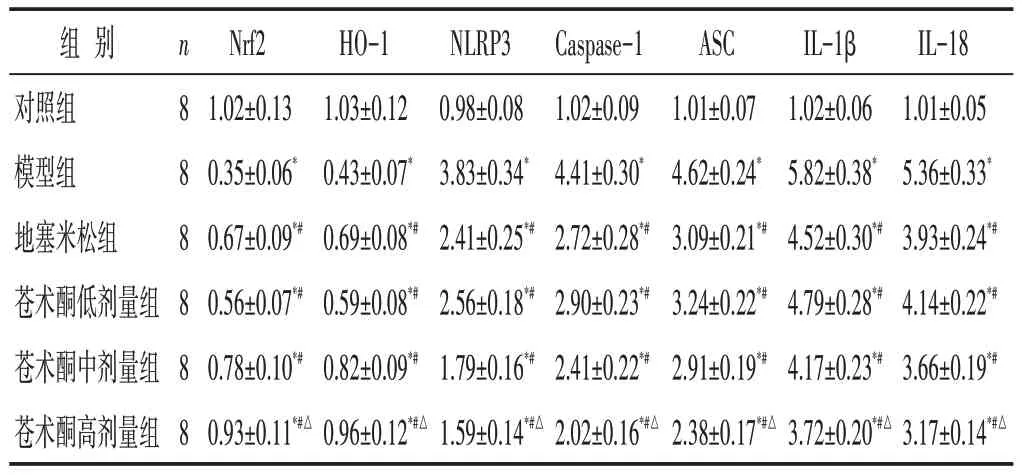
表6 各组小鼠肺组织Nrf2、HO-1、NLRP3、Caspase-1、ASC、IL-1β、IL-18 mRNA表达水平比较(±s)
组别对照组模型组地塞米松组苍术酮低剂量组苍术酮中剂量组苍术酮高剂量组n888888 Nrf2 1.02±0.13 0.35±0.06*0.67±0.09*#0.56±0.07*#0.78±0.10*#0.93±0.11*#△HO-1 1.03±0.12 0.43±0.07*0.69±0.08*#0.59±0.08*#0.82±0.09*#0.96±0.12*#△NLRP3 0.98±0.08 3.83±0.34*2.41±0.25*#2.56±0.18*#1.79±0.16*#1.59±0.14*#△Caspase-1 1.02±0.09 4.41±0.30*2.72±0.28*#2.90±0.23*#2.41±0.22*#2.02±0.16*#△ASC 1.01±0.07 4.62±0.24*3.09±0.21*#3.24±0.22*#2.91±0.19*#2.38±0.17*#△IL-1β 1.02±0.06 5.82±0.38*4.52±0.30*#4.79±0.28*#4.17±0.23*#3.72±0.20*#△IL-18 1.01±0.05 5.36±0.33*3.93±0.24*#4.14±0.22*#3.66±0.19*#3.17±0.14*#△
3 讨 论
ALI 的发病机制错综复杂,目前西医治疗以原发病的治疗、呼吸支持、激素治疗为主,总体上缺乏特效的药物及方法,不能达到理想的治疗效果,故临床上病死率依然很高[11]。近年来随着中药在ALI治疗中的应用,通过多环节、多靶点作用可以取得更佳的疗效,又为其治疗提供了新的突破口[12-13]。前期研究发现,苍术酮对ALI 小鼠具有保护作用,但其具体作用机制不明确,本研究在此基础上,通过生化方法及分子生物学方法进一步探究苍术酮对ALI的干预机制。
呼吸道作为参与整个机体代谢和维持生命活动的重要器官之一,是人体直接与外界相通的一个特别器官,当受到活性氧化物刺激,可引起氧化还原失衡从而产生炎症。MPO 是中性粒细胞嗜天青颗粒所释放的过氧化物酶类,其活性的高低与炎症反应相关[14]。SOD 是氧自由基的清除剂,其活力高低间接反映机体清除氧自由基的能力。MDA 是氧自由基攻击生物膜中多不饱和脂肪酸所形成的脂质过氧化物,它的增加表明器官组织内存在脂质过氧化损伤[15]。GSH-Px 作为一种重要的过氧化物分解酶可使有毒的过氧化物还原成无毒的羟基化合物,保护细胞膜的结构和功能的完整性[16]。本研究发现,模型组小鼠肺组织MPO、MDA 水平升高,GSH-Px、SOD 水平降低,而苍术酮能够降低ALI 小鼠肺泡灌洗液及血清中炎症因子表达,提高W/D 比值、降低肺组织MPO 活性及MDA 表达,升高SOD、GSH-Px表达,同时可显著改善肺组织损伤,说明苍术酮可以调节氧化应激改善小鼠肺损伤。
相关研究发现ALI 和ARDS 发病机制与氧化应激有关,而Nrf2 在其中扮演重要角色[17]。研究表明Nrf2敲除的小鼠急性肺损伤的程度更重,提示Nrf2 是ALI保护的关键靶点[18]。NLRP3 炎性小体主要表达于免疫细胞,其激活后导致IL-1β/18 的产生,促进细胞因子风暴(IL-6/8/10/1RA、TNF-α 和CXCL10)的形成,从而加剧肺内皮和肺泡损伤[19-20]。研究发现,在肺损伤的大鼠模型中,可通过Nrf2 途径抑制NLRP3 炎性小体的激活,从而减少肺损伤大鼠模型中肺炎症细胞浸润和炎性细胞因子的水平[21]。本研究结果发现,模型组小鼠肺组织NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA 水平显著升高,Nrf2、HO-1 mRNA 水平显著降低,苍术酮可显著提高ALI 小鼠肺组织Nrf2、HO-1 mRNA 的表达,抑制NLRP3、ASC、Caspase-1、IL-1β、IL-18 mRNA 水平,提示苍术酮可能通过上调Nrf2 表达,抑制NLRP3 炎症小体的活性,进而抑制炎症因子的释放,从而减轻小鼠肺损伤程度。
综上所述,本研究结果表明苍术酮预处理对LPS诱导小鼠ALI 具有较强的保护作用,其作用机制可能与通过调控Nrf2-NLRP3 信号通路改善氧化应激水平及抑制炎症因子释放有关。但本研究不足之处缺乏体外研究,我们接下来将进一步探究苍术酮在体外对该信号通路调控,为开发防治ALI药物打下基础。
