化工有机废水的净化及水质成分分析实验综述报告
2024-03-05荣俊锋刘瑾琳韩家林李新月兰青青
荣俊锋,刘瑾琳,韩家林,李新月,兰青青
(安徽理工大学 化学工程学院,安徽淮南 232001)
化工专业实验作为化学工程与工艺专业学生的重要实践教学环节,要求学生具备较强的专业理论素养,其重在培养学生实际动手操作能力、团队协作能力以及创新思维。工程教育专业认证理念强调专业实验应增强综合性、设计性实验比重,“化工有机废水的净化及水质成分分析”实验是依托相关省级教学研究项目、省级教学示范课,结合老师科研方向开发出的设计性实验,经化学工程与工艺专业多届学生试点,实验教学效果良好。
综合设计性实验主要训练学生归纳总结能力,并结合具体实际设计出合理、可行实验方案的一种实验。“化工有机废水的净化及水质成分分析”实验是“一题多解”的综合性实验,采用不同工艺方法净化化工废水,研究对比其优缺点;其又是“多参数优化”的设计性实验,对废水不同指标进行优化,获取最佳方案。实验采用讲授法、直观演示法、自主学习法。结合学生小组协作研究学习,让学生熟悉并掌握常见的化工有机废水净化方法,学会归纳总结,结合实际情况设计组合工艺解决实际问题。通过分析实验前后废水各项指标(SS、COD、BOD、NH3-N、VOC、色度、浊度等)来检验净化效果,达到综合训练的目的[1-2]。
1 实验目的
(1)了解并掌握几种常见的化工有机废水净化方法。
(2)学会归纳总结,结合实际情况设计组合工艺,解决实际问题。
(3)掌握几种常规水质指标分析方法及相关仪器的使用方法。
2 实验原理
低温等离子体处理化工有机废水兼具高能电子辐射、O3氧化和紫外光解等3 种效能,放电作用下活性粒子攻击有机污染物中的C-C键及其他不饱和键,使其发生断键和开环等一系列氧化反应,最终降解为CO2和H2O,或使部分大分子物质变成小分子物质。产生低温等离子体的方法主要有介质阻挡放电(DBD)、电晕放电(CD)、滑动弧放电(GRD)及接触辉光放电(CGD),其中以DBD 最为常用,本次设计性实验让学生在众多DBD反应器类型中进行选择[3-7],如表1。

表1 反应器类型优缺点对比
3 实验步骤
(1)连接好自制的等离子体水处理反应装置。
(2)取模拟DMP 废水50 mL,加入等离子体反应器,接通等离子体反应器电源,打开回流冷凝装置,通入压缩空气,调节接触调压器,进行放电实验。在阴、阳极之间,绝缘有机玻璃和DMP废水充当放电介质,形成介质阻挡放电,产生具有高能活性的低温等离子体降解废水中的DMP。
(3)调节放电电压、放电时间及DMP 废水的指标参数。
(4)在不同反应条件下取样,采用重铬酸钾法(HJ 828—2017)测定溶液COD 值,再计算COD 的降解率。采用高精度浊度分析测定仪(HI 88703)测定浊度值,计算浊度去除率[3-6]。
4 结果与讨论
4.1 Fenton体系组分摩尔比对废水净化效果的影响
控制Fenton 体系H2O2/Fe2+摩尔比分别为2∶1,4∶1,6∶1,8∶1,10∶1。
取DMP 废水50 mL 于反应器中,先加入2 mL 0.1 mol/L的FeSO4溶液,按H2O2/Fe2+摩尔比分别为2∶1,4∶1,6∶1,8∶1,10∶1 加入0.4 mol/L 浓度的H2O21 mL,密封,测得pH 为3,为Fenton 氧化的最佳pH,氧化时间为1 h。然后其他组分别加入2 mL、3 mL、4 mL、5 mL 的H2O2溶液,测其COD值和浊度值。
由图1可见,当Fenton 氧化H2O2/Fe2+摩尔比例较小时,里面的Fe2+过量,导致·OH 生成速率过大,造成H2O2的无效分解,并且过量的Fe2+会捕获·OH。随H2O2/Fe2+摩尔比上升,DMP废水COD降解率逐渐增大,最高达71.4%。

图1 H2O2/Fe2+摩尔比对COD去除率的影响
由图2 可见,随着H2O2/Fe2+摩尔比增加,浊度会有波动,这跟硫酸亚铁的矾花(明矾在水解之后与水溶液里的杂质吸附结合,从而形成絮状物)有关。因此加入FeSO4后要给其一定的接触反应时间,且测浊度前要静置。
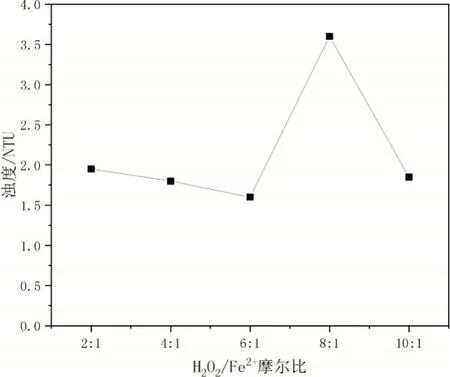
图2 H2O2/Fe2+摩尔比对浊度的影响
4.2 Fenton体系中H2O2初始浓度对废水净化效果的影响
取50 mL DMP 废水于反应瓶中,加入2 mL 的0.1 mol/L FeSO4溶液于反应瓶中,再加入0.2 mol/L 的H2O2溶液。密封,测得pH 为3,此为Fenton 氧化的最佳pH,氧化时间为1 h。其他组分别加入0.4 mol/L、0.6 mol/L、0.8 mol/L、1.0 mol/L 的H2O2溶液,测定COD 值并计算COD降解率,结果如图3。
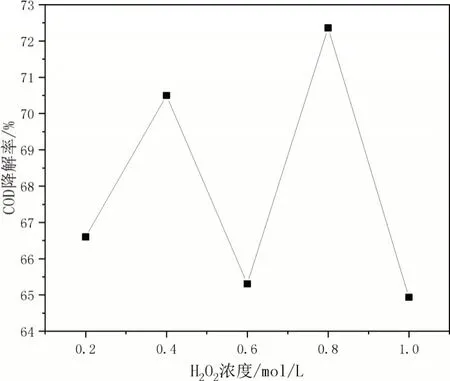
图3 H2O2浓度对COD降解率的影响
由图3、图4 看出,随着H2O2浓度升高,COD 降解率和浊度都是波动变化的。反应刚开始氢氧化铁胶体逐渐增多,但随着H2O2的浓度增加,溶液产生的·OH 增多,·OH 与Fe2+结合速率加快[8-11]。H2O2浓度再升高时,H2O2会过多消耗·OH,H2O2把Fe2+氧化成Fe3+。

图4 H2O2浓度对浊度的影响
4.3 等离子体放电时间对废水净化效果的影响
控制放电电压为35 kV,放电时间分别为0.5 h、1 h、1.5 h、2 h、2.5 h,反应结束后测量其COD 值并计算COD的降解率,结果如图5所示。

图5 放电时间对COD降解率的影响
由图5 看出,随着放电时间增加,COD 的降解率随着时间的推移呈现先上升后下降再上升的趋势。最佳单独放电时间为2.5 h,此时COD 的降解率达到52.3%。
由图6 看出,随着放电时间增加,样品浊度整体呈先下降再上升的趋势。当单独放电2 h,浊度最低,浊度随着放电时间延长而逐渐下降;但是当放电时间继续增加时,浊度上升的原因可能是因为等离子体放电时间过长时,产生了一种新的化合物,这种新的化合物污染了样品,导致浊度上升。

图6 放电时间对浊度的影响
4.4 等离子体放电电压对废水净化效果的影响
取100 mL浓度为50 mg/L的DMP废水于针板式等离子体反应器,设置放电时间为1 h,放电电压为100 V。放电结束后取样。重复上述步骤,分别设置放电电压为20 kV、25 kV、30 kV、35 kV、40 kV,测量其COD和浊度。
由图7 看出,放电电压对DMP 废水的COD 降解率最高可达到37.7%,但是整体的COD降解率并不高。随着放电电压升高,COD 降解率由高到低再到高,原因可能是在25~35 kV 时,当电压升高时,在反应体系里的等离子体密度已经趋于饱和,导致COD降解率降低;当电压高于35 kV时,在有限的空间内等离子体的密度上升了,所以在相同时间内有机污染物被氧化的量上升了。但是当电压高于40 kV 时,放电电压过高,导致热量太大,在等离子体反应器的壁上沾满了大量水蒸气,导致放电总是断断续续的,放电效率低,甚至不放电,所以不探究电压高于40 kV的情况[8-14]。

图7 放电电压对COD降解率的影响
由图8 看出,在单独等离子体放电的情况下,浊度呈现先下降再上升再下降的趋势,当电压等于35 kV时,浊度突然上升,是因为电压升高时产生了新的絮状化合物,导致水样的浊度值升高。但随电压继续升高,絮状化合物逐渐被降解,浊度值下降。电压40 kV 时,浊度小于1.0 NTU,达到国家排放标准。

图8 放电电压对浊度的影响
4.5 联用方法顺序对废水净化效果的影响
本实验有两种研究方向:①先Fenton氧化,后NTP;②先NTP,后Fenton 氧化。投加摩尔比为4∶1 的H2O2/Fe2+的Fenton 试剂,放电时间为1.5 h,在不同放电电压条件下,用上述两种不同的研究方法测定样品的COD,选择最佳方法。
图9 选用两种不同降解方法研究其中的某一变量(放电电压)对COD 降解率的影响可以明显看出,先进行Fenton氧化、后等离子体放电对COD降解率更高,且两者差别相当明显。可能是先等离子体放电会破坏有机大分子的结构,导致Fenton氧化产生的羟基自由基作用效果不明显,亦或是抑制了羟基自由基的活性。因此后续实验让同学们采取先Fenton氧化,后NTP的方法。

图9 不同处理方法放电电压对COD的影响
5 总结
本实验通过介绍新型水处理方法,分析各种水处理方法的原理、优缺点,阐述各种方式的具体操作过程,重点介绍水质指标的含义与测定方法,让学生根据处理前后水质指标变化分析所采用方法的净化效率,并对实验进行总结,训练了学生的归纳总结能力和综合设计实验方案的能力;让学生总结可能获得的实验结论,并分析实验结论对后续水处理方式改进的指导意义,进一步培养了学生科学严谨的实验学习态度,为后续其毕业实习、毕业(设计)论文以及走上工作岗位打下坚实基础。
